解题方法
1 . 根据要求回答下列问题:
(1)amol单质碳和16g氧气恰好在某恒容密闭容器中发生反应: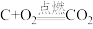 、
、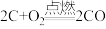 ,当恢复到原来的温度时,测得容器内的压强增大了0.5倍(忽略固体对压强的影响)。
,当恢复到原来的温度时,测得容器内的压强增大了0.5倍(忽略固体对压强的影响)。
①a=_______ ;16g氧气的体积为_______ L(标准状况下)
②若将反应后的气体通过盛有足量Na2O2的U形管,发生反应的化学方程式为_______ 。
(2)二氧化氯(ClO2)是一种广谱杀菌消毒剂。某工厂以213gNaClO3固体、117gNaCl固体和876g一定溶质质量分数的稀硫酸为原料制取ClO2,反应的化学方程式为2NaClO3+2NaCl+2H2SO4=2ClO2 +Cl2↑+2H2O+2Na2SO4,假设反应物均恰好完全反应。
+Cl2↑+2H2O+2Na2SO4,假设反应物均恰好完全反应。
①NaClO2中Cl的化合价是_______
②“84消毒液”也是一种含氯消毒剂,写出实验室制备“84消毒液”的化学方程式:_______
③876g稀硫酸中H2SO4的质量分数是_______ %(结果保留1位小数)。
④30℃时,将所得的硫酸钠溶液蒸发掉_______ g水可以恰好形成该温度下的饱和溶液(已知:30℃时,Na2SO4的溶解度为40g)。
(1)amol单质碳和16g氧气恰好在某恒容密闭容器中发生反应:
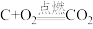 、
、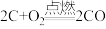 ,当恢复到原来的温度时,测得容器内的压强增大了0.5倍(忽略固体对压强的影响)。
,当恢复到原来的温度时,测得容器内的压强增大了0.5倍(忽略固体对压强的影响)。①a=
②若将反应后的气体通过盛有足量Na2O2的U形管,发生反应的化学方程式为
(2)二氧化氯(ClO2)是一种广谱杀菌消毒剂。某工厂以213gNaClO3固体、117gNaCl固体和876g一定溶质质量分数的稀硫酸为原料制取ClO2,反应的化学方程式为2NaClO3+2NaCl+2H2SO4=2ClO2
 +Cl2↑+2H2O+2Na2SO4,假设反应物均恰好完全反应。
+Cl2↑+2H2O+2Na2SO4,假设反应物均恰好完全反应。①NaClO2中Cl的化合价是
②“84消毒液”也是一种含氯消毒剂,写出实验室制备“84消毒液”的化学方程式:
③876g稀硫酸中H2SO4的质量分数是
④30℃时,将所得的硫酸钠溶液蒸发掉
您最近一年使用:0次
解题方法
2 . 如图是某硫酸试剂瓶标签上的部分文字说明。请计算:
(1)H2SO4的摩尔质量为_____ g/mol。
(2)该试剂瓶中H2SO4的物质的量浓度为______ mol/L。
(3)取10mL该硫酸稀释至100mL,与足量锌粒充分反应求生成氢气的质量______ (写出计算过程)。
| 硫酸 500mL 化学式: H2SO4 密度: 1.84 g/cm3 质量分数: 98% |
(2)该试剂瓶中H2SO4的物质的量浓度为
(3)取10mL该硫酸稀释至100mL,与足量锌粒充分反应求生成氢气的质量
您最近一年使用:0次
2023-01-07更新
|
311次组卷
|
2卷引用:2021年河南省普通高中学生学业水平考试化学试题
3 . 回答下列问题:
(1)在一定条件下,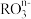 和氟气可发生如下反应
和氟气可发生如下反应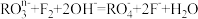 从而可知在
从而可知在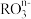 中,元素R的化合价为
中,元素R的化合价为_______ 。
(2)若在标准状况下,将VLHCl气体溶于1L水中,所得溶液密度为dg/L,则此溶液的物质的量浓度为_______ mol/L。(用含V,d字母的算式表示)
(3)某学生用 和
和 组成的均匀混合物进行以下实验。(气体体积已折算成标准状况下的体积,不考虑
组成的均匀混合物进行以下实验。(气体体积已折算成标准状况下的体积,不考虑 在水中的溶解,不考虑HCl的挥发)
在水中的溶解,不考虑HCl的挥发)
实验1:取2.96g固体混合物加入质量分数为12.0%,密度为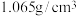 的盐酸40mL共产生672mL气体。
的盐酸40mL共产生672mL气体。
实验2:取8.88g该固体混合物逐滴加入40mL该盐酸,则产生amL的气体。
①盐酸的物质的量浓度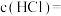
_______ (保留两位小数)。
②样品中物质的量之比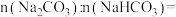
_______ 。
③a=_______ mL。
(1)在一定条件下,
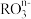 和氟气可发生如下反应
和氟气可发生如下反应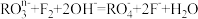 从而可知在
从而可知在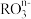 中,元素R的化合价为
中,元素R的化合价为(2)若在标准状况下,将VLHCl气体溶于1L水中,所得溶液密度为dg/L,则此溶液的物质的量浓度为
(3)某学生用
 和
和 组成的均匀混合物进行以下实验。(气体体积已折算成标准状况下的体积,不考虑
组成的均匀混合物进行以下实验。(气体体积已折算成标准状况下的体积,不考虑 在水中的溶解,不考虑HCl的挥发)
在水中的溶解,不考虑HCl的挥发)实验1:取2.96g固体混合物加入质量分数为12.0%,密度为
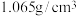 的盐酸40mL共产生672mL气体。
的盐酸40mL共产生672mL气体。实验2:取8.88g该固体混合物逐滴加入40mL该盐酸,则产生amL的气体。
①盐酸的物质的量浓度
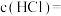
②样品中物质的量之比
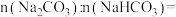
③a=
您最近一年使用:0次
名校
4 . 现有以下物质:①H2SO4;②液氨;③KOH固体;④熔融KHSO4;⑤Fe(OH)3胶体;⑥银;⑦SO2;⑧CH3COOH;⑨蔗糖;⑩苯;⑪酒精。请回答下列问题:
(1)以上物质中能导电的是_______ (填序号),以上物质中属于电解质的是_______ (填序号)。以上物质中属于非电解质的是_______ (填序号)。
(2)某物质A加热时按化学方程式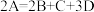 分解,产物均为气体,测得相同条件下由生成物组成的混合物气体对
分解,产物均为气体,测得相同条件下由生成物组成的混合物气体对 的相对密度为40,则反应物A的摩尔质量为
的相对密度为40,则反应物A的摩尔质量为_______ 。
(3)质量比为11:7:16的 、CO、
、CO、 ,它们所含分子数之比为
,它们所含分子数之比为_______ ,所含氧原子数之比为_______ 。
(4)标准状况下有①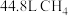 ,②
,②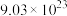 个
个 分子,③
分子,③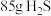 三种气体,对这三种气体的物质的量从大到小的顺序是
三种气体,对这三种气体的物质的量从大到小的顺序是_______ 。(填序号)
(5)在标准状况下,用干燥的烧瓶装满一瓶氯化氢和氢气的混合气体倒置于水槽中,此时烧瓶中盐酸的物质的量浓度是_______ mol/L。(假设烧瓶内的液体不扩散出水槽)
(6)标准状况下,将V L的氨气溶于0.2L的水中,所得溶液的密度为d g·cm-3,此氨水的物质的量浓度是_______ mol/L;已知25%的氨水的密度为ρ1g/cm3,5%的氨水的密度为ρ2g/ cm3,ρ1<ρ2,若将上述两种溶液等体积混合,所得氨水的质量分数_______ 15%(填>、<或=)。
(1)以上物质中能导电的是
(2)某物质A加热时按化学方程式
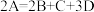 分解,产物均为气体,测得相同条件下由生成物组成的混合物气体对
分解,产物均为气体,测得相同条件下由生成物组成的混合物气体对 的相对密度为40,则反应物A的摩尔质量为
的相对密度为40,则反应物A的摩尔质量为(3)质量比为11:7:16的
 、CO、
、CO、 ,它们所含分子数之比为
,它们所含分子数之比为(4)标准状况下有①
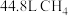 ,②
,②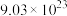 个
个 分子,③
分子,③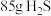 三种气体,对这三种气体的物质的量从大到小的顺序是
三种气体,对这三种气体的物质的量从大到小的顺序是(5)在标准状况下,用干燥的烧瓶装满一瓶氯化氢和氢气的混合气体倒置于水槽中,此时烧瓶中盐酸的物质的量浓度是
(6)标准状况下,将V L的氨气溶于0.2L的水中,所得溶液的密度为d g·cm-3,此氨水的物质的量浓度是
您最近一年使用:0次
2022-11-02更新
|
624次组卷
|
3卷引用:河南省南阳市第一中学校2022-2023学年高一上学期第二次月考化学试题
5 . 将yg由 、
、 两种固体组成的混合物投入适量水中,再向溶液中通入
两种固体组成的混合物投入适量水中,再向溶液中通入 ,通入
,通入 的体积(已折算成标准状况)与生成沉淀质量的关系如图所示:
的体积(已折算成标准状况)与生成沉淀质量的关系如图所示:
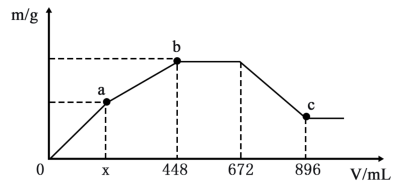
请回答下列问题:
(1)ab段发生反应的离子方程式是___________ 。
(2)x=___________ ;混合物中 的质量分数为
的质量分数为___________ (保留两位有效数字)。
(3)c点对应溶液中的溶质为___________ (填化学式)。
 、
、 两种固体组成的混合物投入适量水中,再向溶液中通入
两种固体组成的混合物投入适量水中,再向溶液中通入 ,通入
,通入 的体积(已折算成标准状况)与生成沉淀质量的关系如图所示:
的体积(已折算成标准状况)与生成沉淀质量的关系如图所示:
请回答下列问题:
(1)ab段发生反应的离子方程式是
(2)x=
 的质量分数为
的质量分数为(3)c点对应溶液中的溶质为
您最近一年使用:0次
名校
6 . Ⅰ.对一定量气体体积的探究。已知1 mol不同气体在不同条件下的体积:
(1)从表中分析得出的结论:
①1 mol任何气体,在标准状况下的体积都约为_______ 。
②1 mol不同的气体,在不同的条件下,体积_______ (填序号)。
A.一定相等 B.一定不相等 C.不一定相等
(2)理论依据:相同条件下,1 mol任何气体的体积几乎相等,原因是①_______ ,②_______ 。
(3)应用:在标准状况下,4 g氧气的体积是_______ 。
Ⅱ.在标准状况下15 g CO与CO2的混合气体,体积为11.2 L。则:
(1)混合气体的密度是_______ 。
(2)混合气体的平均摩尔质量是_______ 。
(3)CO2和CO的体积之比是_______ 。
(4)CO的体积分数是_______ 。
(5)CO2和CO的质量之比是_______ 。
(6)CO的质量分数是_______ 。
(7)混合气体中所含氧原子的物质的量是_______ 。
(8)混合气体中所含碳原子的物质的量是_______ 。
| 化学式 | 条件 | 1mol气体的体积/L |
| H2 | 0℃,101kPa | 22.4 |
| O2 | 22.4 | |
| CO | 22.4 | |
| H2 | 0℃,202kPa | 11.2 |
| CO2 | 11.2 | |
| N2 | 11.2 | |
| NH3 | 273℃,202kPa | 22.4 |
(1)从表中分析得出的结论:
①1 mol任何气体,在标准状况下的体积都约为
②1 mol不同的气体,在不同的条件下,体积
A.一定相等 B.一定不相等 C.不一定相等
(2)理论依据:相同条件下,1 mol任何气体的体积几乎相等,原因是①
(3)应用:在标准状况下,4 g氧气的体积是
Ⅱ.在标准状况下15 g CO与CO2的混合气体,体积为11.2 L。则:
(1)混合气体的密度是
(2)混合气体的平均摩尔质量是
(3)CO2和CO的体积之比是
(4)CO的体积分数是
(5)CO2和CO的质量之比是
(6)CO的质量分数是
(7)混合气体中所含氧原子的物质的量是
(8)混合气体中所含碳原子的物质的量是
您最近一年使用:0次
7 . 标准状况下,560mL某气体A的质量为0.75g,则其摩尔质量为________ ;已知该气体在水中的溶解度为448L(气体溶解度指该气体在压强为101kPa,0℃时,溶解在1体积水里达到饱和状态时的气体的体积),则得到的饱和溶液中溶质A的质量分数为________ (A不与水反应),若测得该溶液密度为1.24g/cm3, 则该溶液的物质的量浓度为________ .
您最近一年使用:0次
11-12高一上·辽宁抚顺·阶段练习
名校
解题方法
8 . 常温下,将20.0g质量分数为14.0%的KNO3溶液跟30.0g质量分数为24.0%的KNO3溶液混合,得到密度为1.15g•cm-3的混合溶液。计算:
(1)混合后溶液中溶质的质量分数为____ 。
(2)混合后溶液中溶质的物质的量浓度为___ 。
(3)在1000g水中需溶解____ molKNO3才能使其浓度恰好与上述混合后溶液的浓度相等。
(1)混合后溶液中溶质的质量分数为
(2)混合后溶液中溶质的物质的量浓度为
(3)在1000g水中需溶解
您最近一年使用:0次
2020-08-31更新
|
1444次组卷
|
35卷引用:2016-2017学年北大附中河南分校高一上第一次月考化学卷
2016-2017学年北大附中河南分校高一上第一次月考化学卷河南省林州市第一中学2017-2018学年高一(普通班)10月调研化学试题(已下线)2011-2012学年辽宁省抚顺县高中高一9月月考理科综合试题(化学部分)(已下线)2014-2015学年云南省玉溪市一中高一上学期期中化学试卷2016-2017学年湖南省双峰县第一中学高一上第一次月考化学试卷2016-2017学年湖南省湘潭县第一中学高一下学期第一次模块考试化学试卷河北省定州中学2017-2018学年高一上学期开学考试化学试题甘肃省武威第五中学2017-2018学年高一上学期第一次月考化学试题四川省乐山沫若中学2017-2018学年高一上学期第一次月考化学试题河北省石家庄市第一中学2017-2018学年高一上学期期中考试化学试题广东省仲元中学2017-2018学年高一上学期期中考试化学试题福建省晋江市季延中学2017-2018学年高一上学期期中考试化学试题云南省峨山彝族自治县第一中学2017-2018学年高一上学期11月考试化学试题河北省辛集市第一中学2017-2018学年高二上学期第三次月考化学试题江苏省南通市、盐城市六校联盟2017-2018学年高一上学期期中联考(通泰)化学试题(已下线)2018年9月7日 《每日一题》人教必修1-溶液稀释或混合的计算(已下线)2018年9月16日《每日一题》人教必修1- 每周一测(已下线)2018年10月20日 《每日一题》人教必修1 - 周末培优四川省三台中学实验学校2018-2019学年高一上学期第一次月考化学试题(已下线)第16天 溶解度、溶质质量分数和物质的量浓度之间的关系——《2019年暑假作业总动员》高一化学(已下线)2019年9月6日《每日一题》 必修1 溶液稀释或混合的计算(已下线)2019年9月15日 《每日一题》必修1 —— 每周一测2019年10月19日《每日一题》2019-2020学年高一化学人教必修1——周末培优吉林省榆树市第一高级中学2019-2020学年高一上学期期中考试化学试卷四川省成都市成都外国语学校2019-2020学年高一上学期期中考试化学试题四川省成都三中2019-2020学年高一11月月考化学试题(已下线)期中模拟卷(二)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)苏教版(2020)高一必修第一册专题2第二单元突破1 物质的量浓度的有关计算人教版(2019)高一必修第一册 第二章 专题2 物质的量浓度的有关计算鲁科版(2019)高一必修第一册第1章 认识化学科学 第3节 物质的量 专题1 物质的量浓度的有关计算高一必修第一册(鲁科2019)第1章 章末综合检测卷甘肃省武威八中2020-2021学年高一上学期10月月考化学试题甘肃省民勤县第一中学2020-2021学年高一上学期第一次月考化学试题安徽桐城重点中学2021-2022学年高一上学期开学教学质量检测化学试题(已下线)【南昌新东方】2019 湾里一中 高一上第一次月考
12-13高三上·安徽滁州·阶段练习
名校
解题方法
9 . 在标准状况下,将224LHCl气体溶于635mL水中,所得盐酸的密度为1.18g·cm-3试计算:
(1)所得盐酸的质量分数和物质的量浓度分别是___________ 、___________ 。
(2)取这种盐酸100 mL,稀释至1.18L,所得稀盐酸的物质的量浓度是___________ 。
(3)在40.0 mL 0.065 mol·L-1Na2CO3溶液中,逐滴加入上述稀释后的稀盐酸,边加边振荡。若使反应不产生CO2气体,加入稀盐酸的体积最多不超过___________ mL。
(4)将不纯的NaOH样品1g(样品含少量Na2CO3和水),放入50mL2mol·L-1的盐酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40 mL1mol·L-1的NaOH溶液。蒸发中和后的溶液,最终得到___________ g固体。
(1)所得盐酸的质量分数和物质的量浓度分别是
(2)取这种盐酸100 mL,稀释至1.18L,所得稀盐酸的物质的量浓度是
(3)在40.0 mL 0.065 mol·L-1Na2CO3溶液中,逐滴加入上述稀释后的稀盐酸,边加边振荡。若使反应不产生CO2气体,加入稀盐酸的体积最多不超过
(4)将不纯的NaOH样品1g(样品含少量Na2CO3和水),放入50mL2mol·L-1的盐酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40 mL1mol·L-1的NaOH溶液。蒸发中和后的溶液,最终得到
您最近一年使用:0次
2021-01-11更新
|
752次组卷
|
22卷引用:河南省新蔡县第一高级中学2020-2021学年高一上学期1月月考化学试题
河南省新蔡县第一高级中学2020-2021学年高一上学期1月月考化学试题(已下线)2013届安徽省来安县半塔中学高三上学期第一次月考化学试卷(已下线)2014年高考化学苏教版一轮复习1-2-2溶液的配制及误差分析练习卷2015-2016学年吉林省松原市油田高中高二下期中化学试卷2017届江西省新余一中、宜春一中高三7月联考化学试题2015-2016学年贵州省思南中学高二下学期期末化学卷安徽省阜阳市第三中学2019-2020学年高一上学期期末考试化学试题(已下线)第04讲 一定物质的量浓度的溶液及其配制(精练)——2021年高考化学一轮复习讲练测(已下线)第02章 海水中的重要元素——钠和氯(B卷能力提高篇)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)安徽省六安中学2021届高三上学期开学考试化学试题湖南省邵阳市邵东县创新实验学校2021届高三上学期第一次月考化学试题甘肃省武威市第十八中学2021届高三上学期第一次月考化学试题黑龙江省实验中学2020-2021学年高一12月月考化学试题(已下线)第02讲 物质的量浓度与溶液的配制(精练)-2022年高考化学一轮复习讲练测(已下线)考点03 物质的量的浓度及溶液配制-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点03 物质的量的浓度及溶液配制-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题一 能力提升检测卷 (测) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)第02讲 物质的量浓度(练)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)第一单元 化学计量在实验中的应用(A卷 新题基础练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)(已下线)考点03 物质的量的浓度及溶液配制-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第02讲 物质的量浓度与溶液的配制(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)考点03 物质的量浓度及溶液配制(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
10 . 化合物A经李比希法测得其中含碳的质量分数为72.0%、含氢的质量分数为6.67%,其余为氧,质谱法分析得知A的相对分子质量为150。现代仪器分析有机化合物的分子结构有以下两种方法。
方法一:核磁共振仪可以测定有机物分子里不同化学环境的氢原子及其相对数量,如乙醇(CH3CH2OH)的1H核磁共振谱有3个峰,其峰面积之比为3∶2∶1。现测出A的1H核磁共振谱有5个峰,其峰面积之比为1∶2∶2∶2∶3。
方法二:利用红外光谱仪可初步检测有机化合物中的某些基团,现测得A分子的红外光谱如图所示。

已知:A分子中只含一个苯环,且苯环上只有一个取代基。试回答下列问题:
(1)A的分子式:________ 。
(2)A的结构简式:__________________ (任写一种)。
(3)A的芳香类同分异构体有多种,请按要求写出其结构简式。
①分子中不含甲基的芳香酸:_____________________ ;
②遇FeCl3显紫色且苯环上只有两个取代基的芳香醛:________________ (任写一种)。
方法一:核磁共振仪可以测定有机物分子里不同化学环境的氢原子及其相对数量,如乙醇(CH3CH2OH)的1H核磁共振谱有3个峰,其峰面积之比为3∶2∶1。现测出A的1H核磁共振谱有5个峰,其峰面积之比为1∶2∶2∶2∶3。
方法二:利用红外光谱仪可初步检测有机化合物中的某些基团,现测得A分子的红外光谱如图所示。

已知:A分子中只含一个苯环,且苯环上只有一个取代基。试回答下列问题:
(1)A的分子式:
(2)A的结构简式:
(3)A的芳香类同分异构体有多种,请按要求写出其结构简式。
①分子中不含甲基的芳香酸:
②遇FeCl3显紫色且苯环上只有两个取代基的芳香醛:
您最近一年使用:0次
2020-06-15更新
|
154次组卷
|
2卷引用:河南信阳商城县丰集高级中学2019-2020学年高二下开学化学测试题



