1 . (1)称量一定质量表面含油污的纯铜屑(铜含量为99.84%),置于坩埚中灼烧,将油污充分氧化后除去,直至铜屑表面均呈黑色。冷却后称量,固体质量比灼烧前增加了3.2 %,固体中铜与氧化铜的质量之比为_______。(请将结果化为小数,且保留至小数点后两位)
(2)向1000克未知溶质质量分数的硫酸铜溶液中加入一定量的氢氧化钠溶液,过滤、干燥后得到蓝色固体19.6克。在所得滤液中加入过量铁粉,充分反应后,再加入足量盐酸,最后得到6.4克固体,求原溶液中硫酸铜的质量分数。(请写出计算过程)
(2)向1000克未知溶质质量分数的硫酸铜溶液中加入一定量的氢氧化钠溶液,过滤、干燥后得到蓝色固体19.6克。在所得滤液中加入过量铁粉,充分反应后,再加入足量盐酸,最后得到6.4克固体,求原溶液中硫酸铜的质量分数。(请写出计算过程)
您最近一年使用:0次
名校
2 . 肼是一种强还原剂,用NaClO与NH3反应可用于生产肼(N2H4),其反应的化学方程式为:NaClO+2NH3= N2H4+NaCl+H2O。
⑴生产1000 g质量分数为25.6%的肼溶液最少需要___________ L(标准状况)NH3。
⑵工业次氯酸钠溶液中含有氯酸钠会影响所得肼的产品质量。测定次氯酸钠样品中的氯酸钠含量的方法如下:取10.00 mL 碱性NaClO溶液试样,加入过量H2O2,将次氯酸钠完全还原( 在酸性条件下具有强氧化性,但碱性条件下几乎无氧化性),加热煮沸,冷却至室温,加入硫酸至酸性,再加入0.1000 mol·L-1 硫酸亚铁标准溶液30.00 mL,充分反应后,用0.01000 mol·L-1酸性K2Cr2O7溶液滴定至终点(
在酸性条件下具有强氧化性,但碱性条件下几乎无氧化性),加热煮沸,冷却至室温,加入硫酸至酸性,再加入0.1000 mol·L-1 硫酸亚铁标准溶液30.00 mL,充分反应后,用0.01000 mol·L-1酸性K2Cr2O7溶液滴定至终点( 被还原为Cr3+),消耗该溶液20.00 mL。
被还原为Cr3+),消耗该溶液20.00 mL。
①用H2O2与次氯酸钠反应的离子方程式为___________ 。
②实验中加热煮沸的目的是___________ 。
③计算样品中NaClO3的含量(以g·L-1表示),写出计算过程。___________
⑴生产1000 g质量分数为25.6%的肼溶液最少需要
⑵工业次氯酸钠溶液中含有氯酸钠会影响所得肼的产品质量。测定次氯酸钠样品中的氯酸钠含量的方法如下:取10.00 mL 碱性NaClO溶液试样,加入过量H2O2,将次氯酸钠完全还原(
 在酸性条件下具有强氧化性,但碱性条件下几乎无氧化性),加热煮沸,冷却至室温,加入硫酸至酸性,再加入0.1000 mol·L-1 硫酸亚铁标准溶液30.00 mL,充分反应后,用0.01000 mol·L-1酸性K2Cr2O7溶液滴定至终点(
在酸性条件下具有强氧化性,但碱性条件下几乎无氧化性),加热煮沸,冷却至室温,加入硫酸至酸性,再加入0.1000 mol·L-1 硫酸亚铁标准溶液30.00 mL,充分反应后,用0.01000 mol·L-1酸性K2Cr2O7溶液滴定至终点( 被还原为Cr3+),消耗该溶液20.00 mL。
被还原为Cr3+),消耗该溶液20.00 mL。①用H2O2与次氯酸钠反应的离子方程式为
②实验中加热煮沸的目的是
③计算样品中NaClO3的含量(以g·L-1表示),写出计算过程。
您最近一年使用:0次
2017-04-16更新
|
620次组卷
|
4卷引用:2017届江苏省南通市高三第一次模拟考试化学试卷
9-10高三·江苏·阶段练习
3 . 维生素C(分子式为C6H8O6)具有较强的还原性,放置在空气中易被氧化,其含量可通过在弱酸性溶液中用已知溶液的I2溶液进行滴定。该反应的化学方程式如下:
C6H8O6+I2 C6H6O6+2HI
C6H6O6+2HI
现欲测定某样品中维生素C的含量,具体的步骤及测得的数据如下。取10mL 6mol·L-1CH3COOH,加入100mL蒸馏水,将溶液加热煮沸后放置冷却。精确称取0.2000g样品,溶解于上述冷却的溶液中,加入1mL淀粉指示剂,立即用浓度为0.05000mol·L-1的I2溶液进行滴定,直至溶液中的蓝色持续不褪为止,共消耗21.00mLI2溶液。
(1)为何加入的CH3COOH稀溶液要先经煮沸、冷却后才能使用?
(2)计算样品中维生素C的质量分数。
C6H8O6+I2
 C6H6O6+2HI
C6H6O6+2HI 现欲测定某样品中维生素C的含量,具体的步骤及测得的数据如下。取10mL 6mol·L-1CH3COOH,加入100mL蒸馏水,将溶液加热煮沸后放置冷却。精确称取0.2000g样品,溶解于上述冷却的溶液中,加入1mL淀粉指示剂,立即用浓度为0.05000mol·L-1的I2溶液进行滴定,直至溶液中的蓝色持续不褪为止,共消耗21.00mLI2溶液。
(1)为何加入的CH3COOH稀溶液要先经煮沸、冷却后才能使用?
(2)计算样品中维生素C的质量分数。
您最近一年使用:0次
9-10高二下·浙江·期末
名校
4 . 氢氧化钡是一种使用广泛的化学试剂。某课外小组通过下列实验测定某试样中Ba(OH)2·nH2O的含量。
(1)称取3.50 g试样溶于蒸馏水配成100 mL溶液,从中取出10.0 mL溶液于锥形瓶中,加2滴指示剂,用0.100 mol/L HCl标准溶液滴定至终点,共消耗标准液20.0 mL(杂质不与酸反应),试样中氢氧化钡的物质的量为________ mol。
(2)另取5.25 g试样加热至失去全部结晶水(杂质不分解),称得质量为3.09 g,则Ba(OH)2·nH2O中的n的值为________ 。
(3)试样中Ba(OH)2·nH2O的质量分数为________ 。
(1)称取3.50 g试样溶于蒸馏水配成100 mL溶液,从中取出10.0 mL溶液于锥形瓶中,加2滴指示剂,用0.100 mol/L HCl标准溶液滴定至终点,共消耗标准液20.0 mL(杂质不与酸反应),试样中氢氧化钡的物质的量为
(2)另取5.25 g试样加热至失去全部结晶水(杂质不分解),称得质量为3.09 g,则Ba(OH)2·nH2O中的n的值为
(3)试样中Ba(OH)2·nH2O的质量分数为
您最近一年使用:0次
2010·上海徐汇·一模
5 . 粉煤灰是燃煤电厂排出的工业废渣,其中含莫来石(Al6Si2O13)的质量分数为43.4%,还有含量较多的SiO2(其他成分不含Al和Si)。用粉煤灰和纯碱在高温下烧结,可制取NaAlSiO4(霞石)、Na2SiO3和NaAlO2,有关化学方程式为:
Al6Si2O13 + 3Na2CO3→ 2NaAlSiO4+ 4NaAlO2+ 3CO2↑ ①
Al6Si2O13 + 5Na2CO3→ 2Na2SiO3 + 6NaAlO2+ 5CO2↑ ②
SiO2+ Na2CO3→ Na2SiO3+ CO2↑ ③
(1)粉煤灰中铝的质量分数为________ % 。
(2)用1 mol Al6Si2O13 和 4 mol SiO2制得5mol NaAlO2、1mol NaAlSiO4,还应制得Na2SiO3____________ mol,共消耗Na2CO3________ mol(得到的固体中无SiO2)。
(3)若粉煤灰中 Al6Si2O13 与 SiO2的物质的量之比为1:2,则1kg粉煤灰与6mol Na2CO3反应(反应物全部都参与反应),可制得NaAlO2_________________ mol。
(4)若用100 mol Al6Si2O13同时生产NaAlSiO4和NaAlO2,且n(NaAlSiO4):n(NaAlO2) =x,消耗Na2CO3 ymol,试确定y与x的关系式________________ 。
Al6Si2O13 + 3Na2CO3→ 2NaAlSiO4+ 4NaAlO2+ 3CO2↑ ①
Al6Si2O13 + 5Na2CO3→ 2Na2SiO3 + 6NaAlO2+ 5CO2↑ ②
SiO2+ Na2CO3→ Na2SiO3+ CO2↑ ③
(1)粉煤灰中铝的质量分数为
(2)用1 mol Al6Si2O13 和 4 mol SiO2制得5mol NaAlO2、1mol NaAlSiO4,还应制得Na2SiO3
(3)若粉煤灰中 Al6Si2O13 与 SiO2的物质的量之比为1:2,则1kg粉煤灰与6mol Na2CO3反应(反应物全部都参与反应),可制得NaAlO2
(4)若用100 mol Al6Si2O13同时生产NaAlSiO4和NaAlO2,且n(NaAlSiO4):n(NaAlO2) =x,消耗Na2CO3 ymol,试确定y与x的关系式
您最近一年使用:0次
名校
解题方法
6 . 完成下列问题。
(1)阅读、分析下列两个材料。
材料一
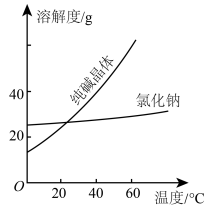
材料二
选择以下方法分离物质:
A.过滤法 B.冷却结晶法 C.蒸发结晶法 D.蒸馏法 E.分液法
①将纯碱从氯化钠和纯碱的混合物中分离出来,最好应用___________ 法。
②将乙二醇和丙三醇相互分离的最佳方法是___________ 法。
(2)取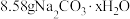 溶于水配成溶液然后逐滴滴入质量分数为
溶于水配成溶液然后逐滴滴入质量分数为 ,密度为
,密度为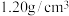 的盐酸直至没有气体放出,用去盐酸
的盐酸直至没有气体放出,用去盐酸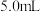 。则生成标况下
。则生成标况下 气体的体积为
气体的体积为___________ ; 的值
的值___________ 。
(3)在无土栽培中,需配制 含有
含有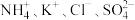 的植物培养液。且要求该培养液中
的植物培养液。且要求该培养液中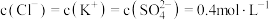 ,该培养液中,
,该培养液中,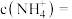
___________  。若用
。若用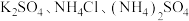 配制培养液,则需
配制培养液,则需___________  。
。
(4)硫酸镁溶液的密度是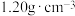 ,其中镁离子的质量分数是
,其中镁离子的质量分数是 ,硫酸镁溶液物质的量浓度是
,硫酸镁溶液物质的量浓度是___________ 。
(1)阅读、分析下列两个材料。
材料一

材料二
| 物质 | 熔点/ | 沸点/ | 密度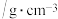 | 溶解性 |
乙二醇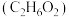 | 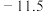 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇 | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
A.过滤法 B.冷却结晶法 C.蒸发结晶法 D.蒸馏法 E.分液法
①将纯碱从氯化钠和纯碱的混合物中分离出来,最好应用
②将乙二醇和丙三醇相互分离的最佳方法是
(2)取
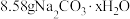 溶于水配成溶液然后逐滴滴入质量分数为
溶于水配成溶液然后逐滴滴入质量分数为 ,密度为
,密度为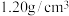 的盐酸直至没有气体放出,用去盐酸
的盐酸直至没有气体放出,用去盐酸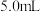 。则生成标况下
。则生成标况下 气体的体积为
气体的体积为 的值
的值(3)在无土栽培中,需配制
 含有
含有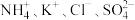 的植物培养液。且要求该培养液中
的植物培养液。且要求该培养液中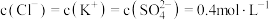 ,该培养液中,
,该培养液中,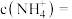
 。若用
。若用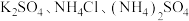 配制培养液,则需
配制培养液,则需 。
。(4)硫酸镁溶液的密度是
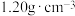 ,其中镁离子的质量分数是
,其中镁离子的质量分数是 ,硫酸镁溶液物质的量浓度是
,硫酸镁溶液物质的量浓度是
您最近一年使用:0次
解题方法
7 . 完成下列填空:
(1)某市售的浓氨水, 的质量分数为
的质量分数为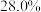 ,密度为
,密度为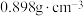 ,则该氨水的物质的量浓度为
,则该氨水的物质的量浓度为___________ 。
(2)已知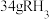 气体中含有
气体中含有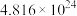 个原子,则该气体的摩尔质量为
个原子,则该气体的摩尔质量为___________ 。
(3)质量为___________  的
的 所含的电子的物质的量为
所含的电子的物质的量为 。
。
(4)质量比为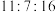 的
的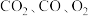 ,其物质的量之比为
,其物质的量之比为___________ 。
(5)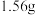 某金属与足量盐酸完全反应,生成
某金属与足量盐酸完全反应,生成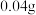 氢气,生成氯化物中金属显
氢气,生成氯化物中金属显 价,则该金属的摩尔质量为
价,则该金属的摩尔质量为___________ 。(写出计算过程)
(1)某市售的浓氨水,
 的质量分数为
的质量分数为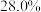 ,密度为
,密度为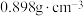 ,则该氨水的物质的量浓度为
,则该氨水的物质的量浓度为(2)已知
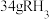 气体中含有
气体中含有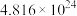 个原子,则该气体的摩尔质量为
个原子,则该气体的摩尔质量为(3)质量为
 的
的 所含的电子的物质的量为
所含的电子的物质的量为 。
。(4)质量比为
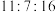 的
的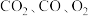 ,其物质的量之比为
,其物质的量之比为(5)
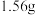 某金属与足量盐酸完全反应,生成
某金属与足量盐酸完全反应,生成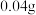 氢气,生成氯化物中金属显
氢气,生成氯化物中金属显 价,则该金属的摩尔质量为
价,则该金属的摩尔质量为
您最近一年使用:0次
解题方法
8 . I.填空。
(1)同温同压下,同体积的氨气和硫化氢( )气体的质量比为
)气体的质量比为___________ ,若二者氢原子数相等,则它们的体积比为___________ 。
(2)在一定条件下44.8g某金属单质A与1.2mol 恰好完全反应,生成0.8molAClx,则x=
恰好完全反应,生成0.8molAClx,则x=___________ ,A的摩尔质量为___________ 。
II.常温下,将20.0g质量分数为14.0%的 溶液与30.0g质量分数为24.0%的
溶液与30.0g质量分数为24.0%的 溶液混合,得到的密度为
溶液混合,得到的密度为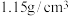 的混合溶液。计算:
的混合溶液。计算:
(3)混合后溶液的质量分数___________ ;
(4)混合后溶液的物质的量浓度___________ 。
(1)同温同压下,同体积的氨气和硫化氢(
 )气体的质量比为
)气体的质量比为(2)在一定条件下44.8g某金属单质A与1.2mol
 恰好完全反应,生成0.8molAClx,则x=
恰好完全反应,生成0.8molAClx,则x=II.常温下,将20.0g质量分数为14.0%的
 溶液与30.0g质量分数为24.0%的
溶液与30.0g质量分数为24.0%的 溶液混合,得到的密度为
溶液混合,得到的密度为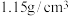 的混合溶液。计算:
的混合溶液。计算:(3)混合后溶液的质量分数
(4)混合后溶液的物质的量浓度
您最近一年使用:0次
9 . Ⅰ.根据物质的组成、结构、性质等进行分类,可预测物质的性质及变化:
(1)SiO2是普通玻璃的主要成分,与CO2一样是酸性氧化物,写出SiO2溶于NaOH溶液的化学方程式:___________ 。
(2)现有:①固体KOH②稀硫酸③氨气④熔融NaCl⑤蔗糖⑥铜;其中能导电的是___________ (填序号,下同)属于电解质的是___________ 。
(3)写出NaClO在水溶液中的电离方程式:___________ 。
Ⅱ.物质的量是联系宏观和微观的桥梁:
(4)40.5g某金属氯化物MCl2中含0.6molCl-,则该氯化物的摩尔质量为___________ 。
(5)标准状况下,与34g的H2S气体含相同H原子数的CH4的体积为___________ 。
(6)由CO、CO2两气体组成的混合气体12.8g,标准状况下,体积为8.96L。则CO、CO2的物质的量之比为___________ 。
(7)在VmL的硫酸铁溶液中,含有mgFe3+离子,则此溶液中 的物质的量浓度为
的物质的量浓度为_______ 。
(8)若用容量瓶以质量分数98%、密度为1.84g/cm3的浓硫酸配制480mL浓度0.2mol/L稀硫酸,计算需要用量筒量取___________ mL的浓硫酸。
(9)用4×10-3mol的KZO4恰好将60mL0.1mol/L的Na2SO3溶液氧化为Na2SO4,则元素Z在还原产物中的化合价是___________ 。
(1)SiO2是普通玻璃的主要成分,与CO2一样是酸性氧化物,写出SiO2溶于NaOH溶液的化学方程式:
(2)现有:①固体KOH②稀硫酸③氨气④熔融NaCl⑤蔗糖⑥铜;其中能导电的是
(3)写出NaClO在水溶液中的电离方程式:
Ⅱ.物质的量是联系宏观和微观的桥梁:
(4)40.5g某金属氯化物MCl2中含0.6molCl-,则该氯化物的摩尔质量为
(5)标准状况下,与34g的H2S气体含相同H原子数的CH4的体积为
(6)由CO、CO2两气体组成的混合气体12.8g,标准状况下,体积为8.96L。则CO、CO2的物质的量之比为
(7)在VmL的硫酸铁溶液中,含有mgFe3+离子,则此溶液中
 的物质的量浓度为
的物质的量浓度为(8)若用容量瓶以质量分数98%、密度为1.84g/cm3的浓硫酸配制480mL浓度0.2mol/L稀硫酸,计算需要用量筒量取
(9)用4×10-3mol的KZO4恰好将60mL0.1mol/L的Na2SO3溶液氧化为Na2SO4,则元素Z在还原产物中的化合价是
您最近一年使用:0次
名校
解题方法
10 . 现有铜与另一种金属的混合物粉末,另一种金属可能是镁、铁、锌中的一种,欲测定其组成。现取该混合物粉末8.0g放入烧杯中,将140.0g14.0%的稀硫酸分四次加入该烧杯中,充分反应后,测得剩余固体质量的数据记录如下:
(1)该混合物粉末中铜的质量分数_______ 。
(2)该混合物粉末中另一金属是_______ 。
(3)求充分反应后生成氢气的质量_______ (取三位有效数字,并有计算过程)。
| 次数 | 1 | 2 | 3 | 4 |
| 加入稀硫酸的质量/g | 35.0 | 35.0 | 35.0 | 35.0 |
| 剩余固体的质量/g | 6.8 | 5.6 | 4.4 | 4.2 |
(2)该混合物粉末中另一金属是
(3)求充分反应后生成氢气的质量
您最近一年使用:0次



