解题方法
1 . 工业上常用电解 溶液制得
溶液制得 ,反应方程式为:
,反应方程式为: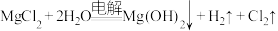 。现将
。现将 溶质质量分数为
溶质质量分数为 的
的 溶液通电一段时间后停止通电,将溶液中物质过滤,得到固体
溶液通电一段时间后停止通电,将溶液中物质过滤,得到固体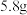 和若干滤液。试计算:
和若干滤液。试计算:
(1) 中
中 和
和 的质量比为
的质量比为________ 。
(2)滤液中 的质量分数(结果精确到
的质量分数(结果精确到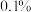 )
)_______ 。
(3)若要将滤液中的 恢复到原来的量分数,并把溶液质量增加到
恢复到原来的量分数,并把溶液质量增加到 。应在滤液中加入一定量水和
。应在滤液中加入一定量水和 固体,计算加入水的体积(水的密度为
固体,计算加入水的体积(水的密度为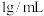 )
)_______ 。
 溶液制得
溶液制得 ,反应方程式为:
,反应方程式为: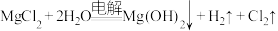 。现将
。现将 溶质质量分数为
溶质质量分数为 的
的 溶液通电一段时间后停止通电,将溶液中物质过滤,得到固体
溶液通电一段时间后停止通电,将溶液中物质过滤,得到固体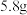 和若干滤液。试计算:
和若干滤液。试计算:(1)
 中
中 和
和 的质量比为
的质量比为(2)滤液中
 的质量分数(结果精确到
的质量分数(结果精确到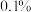 )
)(3)若要将滤液中的
 恢复到原来的量分数,并把溶液质量增加到
恢复到原来的量分数,并把溶液质量增加到 。应在滤液中加入一定量水和
。应在滤液中加入一定量水和 固体,计算加入水的体积(水的密度为
固体,计算加入水的体积(水的密度为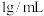 )
)
您最近一年使用:0次
2 . 某纯碱样品中含有少量氯化钠。江津中学化学兴趣小组为测定样品中碳酸钠的质量分数,现称取该样品 ,加入到盛有
,加入到盛有 稀盐酸的烧杯中,恰好完全反应,最后称得烧杯中溶液的质量为
稀盐酸的烧杯中,恰好完全反应,最后称得烧杯中溶液的质量为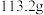 。计算:
。计算:
(1)产生的二氧化碳质量是多少_____ ?
(2)纯碱样品中碳酸钠的质量分数_____ ;(结果精确到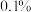 )
)
(3)反应后所得溶液的溶质质量分数_____ 。(结果精确到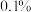 )
)
 ,加入到盛有
,加入到盛有 稀盐酸的烧杯中,恰好完全反应,最后称得烧杯中溶液的质量为
稀盐酸的烧杯中,恰好完全反应,最后称得烧杯中溶液的质量为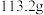 。计算:
。计算:(1)产生的二氧化碳质量是多少
(2)纯碱样品中碳酸钠的质量分数
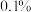 )
)(3)反应后所得溶液的溶质质量分数
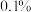 )
)
您最近一年使用:0次
解题方法
3 . 碱式碳酸铜[Cu2(OH)2CO3]用作农药防治小麦黑穗病。实验室用加热法测定某农药中碱式碳酸铜的质量分数(假设杂质受热不参与反应)。充分加热100 g样品,得到固体84.5 g。已知反应的化学方程式为:Cu2(OH)2CO3 2CuO+H2O+CO2↑,Cu2(OH)2CO3的相对分子质量为222。
2CuO+H2O+CO2↑,Cu2(OH)2CO3的相对分子质量为222。
试计算:(1)Cu2(OH)2CO3中铜元素与氧元素的质量比___________ 。(最简整数比)
(2)质量分数最大的元素是___________ 。(填元素名称)
(3)样品中碱式碳酸铜的质量分数是多少__________ ?(保留1位小数)
 2CuO+H2O+CO2↑,Cu2(OH)2CO3的相对分子质量为222。
2CuO+H2O+CO2↑,Cu2(OH)2CO3的相对分子质量为222。试计算:(1)Cu2(OH)2CO3中铜元素与氧元素的质量比
(2)质量分数最大的元素是
(3)样品中碱式碳酸铜的质量分数是多少
您最近一年使用:0次
名校
解题方法
4 . “84 消毒液”是一种常用含氯消毒用品,可通过氯气与氢氧化钠反应制取,生成.物中有氯化钠、次氯酸钠(NaClO)和水,其中有效成分是次氯酸钠。使用时,可根据实际需求进行配比,并规范使用,以防引发危险。
(1)写出制取“84”消毒液的化学方程式______________________ 。
(2)“84消毒液”中的有效氯来自次氯酸钠,次氯酸钠中氯元素的质量分数为______ % (计算结果精确到0.1%)
(3)现需要5 L有效氯浓度为500 mg/L 的稀溶液,选用有效氯浓度为50000 mg/L的某品牌“84消毒液”进行配制,需加水_______ 升 (忽略混合前后溶液体积的变化)。
(4)“84消毒液”不能与洁厕灵混合使用,因为“84消毒液”里的次氯酸钠与洁厕灵里的盐酸会发生化学反应:NaClO+2HCl=X+Cl2↑+H2O,产生的氯气对人体有害,不同浓度氯气对人体的影响如表所示。
①X为_____ (填化学式)。
②通过计算分析,在10 m3密闭空间里,若将1.49 g 次氯酸钠与盐酸完全反应,产生的氯气会对人体造成怎样的影响?____ (要求写出计算过程)。
(1)写出制取“84”消毒液的化学方程式
(2)“84消毒液”中的有效氯来自次氯酸钠,次氯酸钠中氯元素的质量分数为
(3)现需要5 L有效氯浓度为500 mg/L 的稀溶液,选用有效氯浓度为50000 mg/L的某品牌“84消毒液”进行配制,需加水
(4)“84消毒液”不能与洁厕灵混合使用,因为“84消毒液”里的次氯酸钠与洁厕灵里的盐酸会发生化学反应:NaClO+2HCl=X+Cl2↑+H2O,产生的氯气对人体有害,不同浓度氯气对人体的影响如表所示。
| 浓度(mg/m3) | 对人体的影响 |
| 3000 | 可立即麻痹呼吸中枢,导致瞬间死亡 |
| 120~170 | 极为危险,会引起急性肺水肿及肺炎 |
| 40~60 | 在1小时内便可致人严重中毒 |
①X为
②通过计算分析,在10 m3密闭空间里,若将1.49 g 次氯酸钠与盐酸完全反应,产生的氯气会对人体造成怎样的影响?
您最近一年使用:0次
解题方法
5 . 欲测定某生铁 主要成分是铁,还含有少量的碳
主要成分是铁,还含有少量的碳 的组成,进行了如下实验:称取粉末状样品
的组成,进行了如下实验:称取粉末状样品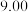 克,加入某浓度的盐酸100mL,充分反应后,收集到标准状况下气体
克,加入某浓度的盐酸100mL,充分反应后,收集到标准状况下气体 ;然后,继续往样品中加入同浓度的盐酸100mL,充分反应后又收集到标准状况下气体
;然后,继续往样品中加入同浓度的盐酸100mL,充分反应后又收集到标准状况下气体 。试求:
。试求: 写出具体计算过程
写出具体计算过程
(1)所取盐酸的物质的量浓度。________
(2)该生铁样品中铁的质量分数 保留3位有效数字
保留3位有效数字 。
。________
 主要成分是铁,还含有少量的碳
主要成分是铁,还含有少量的碳 的组成,进行了如下实验:称取粉末状样品
的组成,进行了如下实验:称取粉末状样品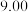 克,加入某浓度的盐酸100mL,充分反应后,收集到标准状况下气体
克,加入某浓度的盐酸100mL,充分反应后,收集到标准状况下气体 ;然后,继续往样品中加入同浓度的盐酸100mL,充分反应后又收集到标准状况下气体
;然后,继续往样品中加入同浓度的盐酸100mL,充分反应后又收集到标准状况下气体 。试求:
。试求: 写出具体计算过程
写出具体计算过程
(1)所取盐酸的物质的量浓度。
(2)该生铁样品中铁的质量分数
 保留3位有效数字
保留3位有效数字 。
。
您最近一年使用:0次
名校
解题方法
6 . 通过粮食发酵可获得某含氧有机化合物X,其相对分子质量为46,其中碳元素的质量分数为52.2%,氢元素的质量分数为13.0%。
(1)X的分子式是__________ 。
(2)X与金属钠反应放出氢气,反应的化学方程式是_______ 。(有机物用结构简式表示)。
(3)X与氧气在铜或银的催化作用下反应生成Y,Y的结构简式是__________ 。
(1)X的分子式是
(2)X与金属钠反应放出氢气,反应的化学方程式是
(3)X与氧气在铜或银的催化作用下反应生成Y,Y的结构简式是
您最近一年使用:0次
2020-09-25更新
|
1124次组卷
|
4卷引用:重庆市缙云教育联盟2021-2022学年高二9月月度质量检测化学试题
7 . 在容积为10L的密闭容器中,进行如下反应:A(g)+2B(g) C(g)+D(g),最初加入1.0mol A和2.2mol B,在不同温度下,D的物质的量n(D)和时间t的关系如图。
C(g)+D(g),最初加入1.0mol A和2.2mol B,在不同温度下,D的物质的量n(D)和时间t的关系如图。
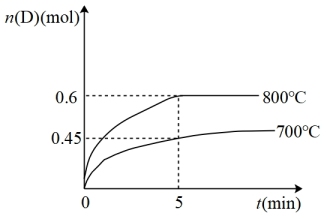
试回答下列问题:
(1)800℃时,0~5min内,以B表示的平均反应速率为_______ 。
(2)能判断反应达到化学平衡状态的依据是_______(填字母)。
(3)若最初加入1.0mol A和2.2mol B,利用图中数据计算800℃时的平衡常数K=_______ ,该反应为_______ 反应(填“吸热”或“放热”)。
(4)已知 2CH3OH(g) CH3OCH3(g)+H2O(g),在不同温度下的平衡常数:400℃,K=32;500℃,K=44。已知在密闭容器中,测得某时刻各组分的浓度如下:
CH3OCH3(g)+H2O(g),在不同温度下的平衡常数:400℃,K=32;500℃,K=44。已知在密闭容器中,测得某时刻各组分的浓度如下:
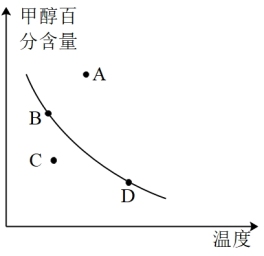
①判断该反应的∆H_______ 0(填“>”、“<”或“=”)。若此时系统温度400℃,比较正、逆反应速率的大小:υ正_______ υ逆(填“>”、“<”或“=”)。
②平衡时,若以甲醇百分含量为纵坐标,以温度为横坐标,此时反应点在图象的位置是图中_______ 点,比较图中B、D两点所对应的正反应速率B_______ D(填“>”、“<”或“=”)。
 C(g)+D(g),最初加入1.0mol A和2.2mol B,在不同温度下,D的物质的量n(D)和时间t的关系如图。
C(g)+D(g),最初加入1.0mol A和2.2mol B,在不同温度下,D的物质的量n(D)和时间t的关系如图。
试回答下列问题:
(1)800℃时,0~5min内,以B表示的平均反应速率为
(2)能判断反应达到化学平衡状态的依据是_______(填字母)。
| A.容器中压强不变 | B.混合气体中c(A)不变 |
| C.v正(B)=2v逆(D) | D.c(A)=c(C) |
(4)已知 2CH3OH(g)
 CH3OCH3(g)+H2O(g),在不同温度下的平衡常数:400℃,K=32;500℃,K=44。已知在密闭容器中,测得某时刻各组分的浓度如下:
CH3OCH3(g)+H2O(g),在不同温度下的平衡常数:400℃,K=32;500℃,K=44。已知在密闭容器中,测得某时刻各组分的浓度如下:| 物质 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
| 浓度/(mol·L-1) | 0.54 | 0 68 68 | 0.68 |
②平衡时,若以甲醇百分含量为纵坐标,以温度为横坐标,此时反应点在图象的位置是图中
您最近一年使用:0次
8 . (l)将2.78gFeSO4·7H2O样品隔绝空气加热脱水,其热重曲线(样品质量随温度变化的曲线)如下图所示.
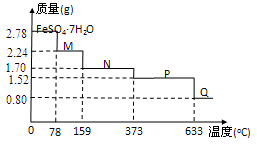
①100℃时,M的化学式为_______________
②FeSO4·H2O存在的最高温度为_______________
③380℃的P加热至650℃时反应的气体产物通入BaCl2溶液中,生成的沉淀的化学式为逸出的气体为,若通入Ba(NO3)2稀溶液中.逸出的气体则为.
(2)称取含有KBrO3、KBr 及惰性物质试样10.00g,溶解定容于100ml容量瓶中。移取25 .00ml 试液,在H2SO4介质中以Na2SO3还原BrO3-至Br-,调至中性,用0.10mol/LAgNO3滴定至终点,用去70.00ml。另取25.00ml试液,用硫酸酸化后,加热赶去Br2,再调至中性,滴定剩余的Br-,用去上述AgNO3的标准溶液10.00ml。
(已知KBrO3、KBr的摩尔质量分别为167.0g/mol,119.0g/mol)
①加入Na2SO3后发生反应的离子方程式为:;
②计算试样中KBr的质量分数为:(保留两位小数)

①100℃时,M的化学式为_______________
②FeSO4·H2O存在的最高温度为_______________
③380℃的P加热至650℃时反应的气体产物通入BaCl2溶液中,生成的沉淀的化学式为逸出的气体为,若通入Ba(NO3)2稀溶液中.逸出的气体则为.
(2)称取含有KBrO3、KBr 及惰性物质试样10.00g,溶解定容于100ml容量瓶中。移取25 .00ml 试液,在H2SO4介质中以Na2SO3还原BrO3-至Br-,调至中性,用0.10mol/LAgNO3滴定至终点,用去70.00ml。另取25.00ml试液,用硫酸酸化后,加热赶去Br2,再调至中性,滴定剩余的Br-,用去上述AgNO3的标准溶液10.00ml。
(已知KBrO3、KBr的摩尔质量分别为167.0g/mol,119.0g/mol)
①加入Na2SO3后发生反应的离子方程式为:;
②计算试样中KBr的质量分数为:(保留两位小数)
您最近一年使用:0次
名校
9 . 将硫酸钠和氯化钠的固体混合物17.5克放入烧杯中,加入80.8克水后,固体混合物完全溶解,再加入75克氯化钡溶液恰好完全反应,生成沉淀23.3克。计算:
(1)原固体混合物中硫酸钠的质量分数(精确到0.1%)。______________
(2)反应后所得溶液中溶质的质量分数。______________
(3)往上述反应后所得溶液中再加多少克水后,溶液中溶质质量分数变为7.5%?______________
(1)原固体混合物中硫酸钠的质量分数(精确到0.1%)。
(2)反应后所得溶液中溶质的质量分数。
(3)往上述反应后所得溶液中再加多少克水后,溶液中溶质质量分数变为7.5%?
您最近一年使用:0次
名校
10 . 将10.0g碳酸钙放入一定量稀盐酸中恰好完全反应,得到80mL密度为1.32g/mL的溶液。试计算:
(1)生成标准状况下的二氧化碳气体多少升?(不考虑CO2在水中的溶解)
(2)所得溶液中氯化钙的物质的量。
(3)所用稀盐酸的质量分数。
(1)生成标准状况下的二氧化碳气体多少升?(不考虑CO2在水中的溶解)
(2)所得溶液中氯化钙的物质的量。
(3)所用稀盐酸的质量分数。
您最近一年使用:0次



