1 . 草酸(H2C2O4)存在于自然界的植物中,是一种二元弱酸。草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以 上分解。
回答下列问题:
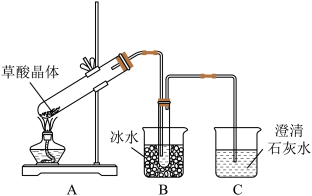
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物。
①装置A中试管口略向上倾斜的原因是____________________ ;
②装置C中可观察到有气泡冒出且澄清石灰水变浑浊,由此可知草酸晶体分解的产物中有____________________ ;
③装置B的主要作用是冷凝水蒸气、草酸等,防止草酸进入装置C发生_______ 反应(填化学方程式),从而干扰CO2的检验。
(2)乙组同学认为草酸晶体分解的产物中含有CO,为进行验证,选用甲组实验中的装置A、B和下图所示的部分装置(可以重复选用)进行实验。
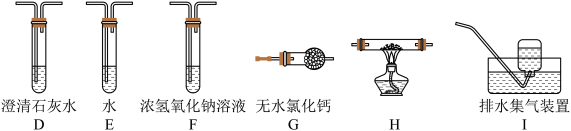
①乙组同学的实验装置中,依次连接的合理顺序为A→B→____ →D→G→_____ →D→______ 。装置H反应管中盛有的物质是_______ (填化学式)。
②能证明草酸晶体分解产物中有CO的现象是:__________________ ,___________ ,第二个D装置中澄清石灰水变浑浊。
③H装置中发生反应的化学方程式为______________________ 。

回答下列问题:
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物。
①装置A中试管口略向上倾斜的原因是
②装置C中可观察到有气泡冒出且澄清石灰水变浑浊,由此可知草酸晶体分解的产物中有
③装置B的主要作用是冷凝水蒸气、草酸等,防止草酸进入装置C发生
(2)乙组同学认为草酸晶体分解的产物中含有CO,为进行验证,选用甲组实验中的装置A、B和下图所示的部分装置(可以重复选用)进行实验。

①乙组同学的实验装置中,依次连接的合理顺序为A→B→
②能证明草酸晶体分解产物中有CO的现象是:
③H装置中发生反应的化学方程式为
您最近一年使用:0次
解题方法
2 . 完成下列各题:
(1)磷的一种化合物叫亚磷酸( )。已知:
)。已知:
(i)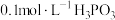 溶液的
溶液的 ;
;
(ii) 与NaOH反应只生成
与NaOH反应只生成 和
和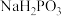 ;
;
(iii) 和碘水反应,碘水棕黄色褪去,再加
和碘水反应,碘水棕黄色褪去,再加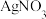 溶液有黄色沉淀生成。
溶液有黄色沉淀生成。
①关于 的说法:a.强酸;b.弱酸;c.二元酸;d.三元酸;e.氧化性酸;f.还原性酸,其中正确的是
的说法:a.强酸;b.弱酸;c.二元酸;d.三元酸;e.氧化性酸;f.还原性酸,其中正确的是______ 。(填序号)
A.bdf B.ade C.bcf D. bce
②Na2HPO3为__________ (填“正盐”或“酸式盐”)
(2)常温下,氨水的pH>7,用离子方程式解释其原因:_____________________________ 。
(3)25℃时, 溶液和盐酸的物质的量浓度相同。
溶液和盐酸的物质的量浓度相同。
①加水稀释至相同的倍数,此时 溶液的pH
溶液的pH______ (填“大于”“小于”或“等于”)盐酸的pH。
②加水稀释至相同的pH,此时加入 溶液中水的体积
溶液中水的体积______ (填“大于”“小于”或“等于”)加入盐酸中水的体积。
(4)常温下, 溶液中
溶液中
______ (用含 和
和 的代数式表示)。
的代数式表示)。
(5)25℃时,现有 的HCl溶液100mL,要使它的
的HCl溶液100mL,要使它的 ,如果加入蒸馏水,需加水
,如果加入蒸馏水,需加水______ mL;如果加入 的HCl溶液,需加入此HCl溶液
的HCl溶液,需加入此HCl溶液______ mL(假定溶液体积有加和性,下同)。
(6)某温度下,纯水中的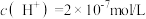 。若温度不变,滴入稀硫酸使
。若温度不变,滴入稀硫酸使 ,则由水电离出的
,则由水电离出的 为
为______ mol/L。
(1)磷的一种化合物叫亚磷酸(
 )。已知:
)。已知:(i)
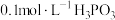 溶液的
溶液的 ;
;(ii)
 与NaOH反应只生成
与NaOH反应只生成 和
和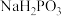 ;
;(iii)
 和碘水反应,碘水棕黄色褪去,再加
和碘水反应,碘水棕黄色褪去,再加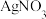 溶液有黄色沉淀生成。
溶液有黄色沉淀生成。①关于
 的说法:a.强酸;b.弱酸;c.二元酸;d.三元酸;e.氧化性酸;f.还原性酸,其中正确的是
的说法:a.强酸;b.弱酸;c.二元酸;d.三元酸;e.氧化性酸;f.还原性酸,其中正确的是A.bdf B.ade C.bcf D. bce
②Na2HPO3为
(2)常温下,氨水的pH>7,用离子方程式解释其原因:
(3)25℃时,
 溶液和盐酸的物质的量浓度相同。
溶液和盐酸的物质的量浓度相同。①加水稀释至相同的倍数,此时
 溶液的pH
溶液的pH②加水稀释至相同的pH,此时加入
 溶液中水的体积
溶液中水的体积(4)常温下,
 溶液中
溶液中
 和
和 的代数式表示)。
的代数式表示)。(5)25℃时,现有
 的HCl溶液100mL,要使它的
的HCl溶液100mL,要使它的 ,如果加入蒸馏水,需加水
,如果加入蒸馏水,需加水 的HCl溶液,需加入此HCl溶液
的HCl溶液,需加入此HCl溶液(6)某温度下,纯水中的
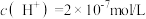 。若温度不变,滴入稀硫酸使
。若温度不变,滴入稀硫酸使 ,则由水电离出的
,则由水电离出的 为
为
您最近一年使用:0次
名校
3 . CH3OH是一种重要的化工原料,广泛应用于化工生产,根据所学回答下列问题:
(1)工业上制备甲醇的反应方程式为: ,某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:
,某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:
①写出该反应体系中CO2的电子式___________ 。
②用H2表示前2h的平均反应速率v(H2)=___________ 。
③该温度下,CO2的平衡转化率为___________ 。
④在一定条件下,下列说法能说明该可逆反应达到平衡状态的是___________ (填字母)。
A.容器中气体密度不变 B.容器中气体平均摩尔质量不变
C. D.形成2molC=O键同时断裂3molH-H键
D.形成2molC=O键同时断裂3molH-H键
⑤在温度为T,压强为P的条件下,将CO2和H2按物质的量之比1∶3通入一恒压密闭容器中发生上述反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为
___________ (用含P的表达式表示,其中用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)CH3OH制备丙烯的反应为: ,速率常数k与反应温度T的关系遵循Arrhenius方程,已知Arrhenius方程为:
,速率常数k与反应温度T的关系遵循Arrhenius方程,已知Arrhenius方程为: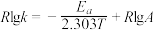 (其中k为速率常数,反应速率与其成正比;
(其中k为速率常数,反应速率与其成正比; 为活化能:
为活化能: ,A为常数)。
,A为常数)。

①在一定条件下,测得实验数据如上图曲线a所示。则该条件下,反应的活化能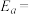
___________ 
②若实验时改变外界条件,测得实验数据为如上图曲线b所示,则可能改变的外界条件是___________ (填标号)
A.升高温度 B.增大压强 C.增大 D.更换适宜的催化剂
D.更换适宜的催化剂
(1)工业上制备甲醇的反应方程式为:
 ,某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:
,某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:| 时间/h | l | 2 | 3 | 4 | 5 | 6 |
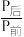 | 0.90 | 0.85 | 0.83 | 0.81 | 0.80 | 0.80 |
②用H2表示前2h的平均反应速率v(H2)=
③该温度下,CO2的平衡转化率为
④在一定条件下,下列说法能说明该可逆反应达到平衡状态的是
A.容器中气体密度不变 B.容器中气体平均摩尔质量不变
C.
 D.形成2molC=O键同时断裂3molH-H键
D.形成2molC=O键同时断裂3molH-H键⑤在温度为T,压强为P的条件下,将CO2和H2按物质的量之比1∶3通入一恒压密闭容器中发生上述反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为

(2)CH3OH制备丙烯的反应为:
 ,速率常数k与反应温度T的关系遵循Arrhenius方程,已知Arrhenius方程为:
,速率常数k与反应温度T的关系遵循Arrhenius方程,已知Arrhenius方程为: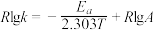 (其中k为速率常数,反应速率与其成正比;
(其中k为速率常数,反应速率与其成正比; 为活化能:
为活化能: ,A为常数)。
,A为常数)。
①在一定条件下,测得实验数据如上图曲线a所示。则该条件下,反应的活化能
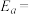

②若实验时改变外界条件,测得实验数据为如上图曲线b所示,则可能改变的外界条件是
A.升高温度 B.增大压强 C.增大
 D.更换适宜的催化剂
D.更换适宜的催化剂
您最近一年使用:0次
2023-06-30更新
|
475次组卷
|
2卷引用:重庆市西南大学附属中学2022-2023学年高一下学期期末考试化学试题
名校
解题方法
4 . 蚊虫、蚂蚁等叮咬人时,常向人体血液)中注入一种含有蚁酸(即甲酸,分子式为HCOOH)的液体。
(1)甲酸同乙酸一样是一种有机弱酸,则在溶液中的电离方程式为___ 。取10mL的甲酸溶液,加入等体积的水,甲酸的电离程度___ (填“增大”、“减小”或“不变”),若加入少量甲酸钠固体,待固体溶解后,溶液中 的值将
的值将___ (填“增大”、“减小”或“无法确定”),甲酸的电离平衡常数___ (填“增大”、“减小”或“不变”)
(2)已知25℃时,几种弱酸的电离平衡常数如下:HCOOH:K=1.77×10-4,HCN:K=4.9×10-10,H2CO3:Ka1=4.4×10-7,Ka2=4.7×10-11,则以下说法不正确的是( )
A.HCOOH+NaCN=HCOONa+HCN
B.Na2CO3+HCN=NaHCO3+NaCN
C.酸的强弱顺序:HCN>HCOOH
D.向碳酸钠溶液中加入甲酸溶液无气泡产生
(3)常温下,有pH=12的氢氧化钠溶液100mL,若将其pH变为11,用水稀释,则加入水的体积为___ mL;若用pH=10的氢氧化钠溶液,应加入___ mL。(均忽略混合后体积变化)
(4)95℃时,Kw=10-12将pH=9的NaOH溶液与pH=4的H2SO4溶液混合(忽略体积的变化),若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为___ 。
(1)甲酸同乙酸一样是一种有机弱酸,则在溶液中的电离方程式为
 的值将
的值将(2)已知25℃时,几种弱酸的电离平衡常数如下:HCOOH:K=1.77×10-4,HCN:K=4.9×10-10,H2CO3:Ka1=4.4×10-7,Ka2=4.7×10-11,则以下说法不正确的是
A.HCOOH+NaCN=HCOONa+HCN
B.Na2CO3+HCN=NaHCO3+NaCN
C.酸的强弱顺序:HCN>HCOOH
D.向碳酸钠溶液中加入甲酸溶液无气泡产生
(3)常温下,有pH=12的氢氧化钠溶液100mL,若将其pH变为11,用水稀释,则加入水的体积为
(4)95℃时,Kw=10-12将pH=9的NaOH溶液与pH=4的H2SO4溶液混合(忽略体积的变化),若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为
您最近一年使用:0次
5 . Ⅰ.某温度下,纯水中的c(H+)=2.0×10-7mol·L-1,则此时溶液的c(OH-)=____ mol·L-1,这种水显____ (填“酸”“碱”或“中”)性;若温度不变,滴入稀盐酸使c(H+)=5.0×10-6 mol·L-1,则c(OH-)=__ mol·L-1。
Ⅱ. (1)在2mL 0.1mol·L-1的NaCl溶液中,加入2mL 0.1mol·L-1的AgNO3溶液,可观察到____ ,此反应的离子方程式为______________ 。 将此混合液过滤,滤渣加入2mL 0.1mol·L-1的KI溶液,搅拌,可观察到_______________ , 反应的离子方程式为____________ 。
(2)下列说法不正确的是___ 。
A.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小
B.所有物质的溶解都是吸热的
C. 沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全
D.除去溶液中的Mg2+,用OH-沉淀Mg2+比 用效果好,说明 Mg(OH)2的溶解度比MgCO3大
用效果好,说明 Mg(OH)2的溶解度比MgCO3大
Ⅲ. 25 ℃,两种常见酸的电离常数如下表所示。
(1)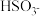 的电离常数表达式 K =
的电离常数表达式 K =_____________ 。
(2)H2SO3溶液和NaHCO3溶液反应的主要离子方程式为______________ 。
Ⅱ. (1)在2mL 0.1mol·L-1的NaCl溶液中,加入2mL 0.1mol·L-1的AgNO3溶液,可观察到
(2)下列说法不正确的是
A.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小
B.所有物质的溶解都是吸热的
C. 沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全
D.除去溶液中的Mg2+,用OH-沉淀Mg2+比
 用效果好,说明 Mg(OH)2的溶解度比MgCO3大
用效果好,说明 Mg(OH)2的溶解度比MgCO3大Ⅲ. 25 ℃,两种常见酸的电离常数如下表所示。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
(1)
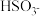 的电离常数表达式 K =
的电离常数表达式 K =(2)H2SO3溶液和NaHCO3溶液反应的主要离子方程式为
您最近一年使用:0次



