1 . 已知:常温下,部分弱电解质的电离平衡常数如下表所示,回答下列问题:
(1)常温下,物质的量浓度相等的下列溶液pH由大到小的顺序是_______ (填序号)。
① 溶液 ②
溶液 ② 溶液 ③
溶液 ③ 溶液 ④
溶液 ④ 溶液 ⑤
溶液 ⑤ 溶液
溶液
(2)常温下,将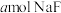 溶于水向该溶液中滴加
溶于水向该溶液中滴加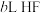 溶液后溶液呈中性,所滴加HF溶液的浓度为
溶液后溶液呈中性,所滴加HF溶液的浓度为_______  。
。
(3)下列离子方程式错误的是_______ (填序号)。
①向 溶液中加入过量
溶液中加入过量 溶液:
溶液:
②向 溶液中通入少量
溶液中通入少量 气体:
气体: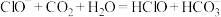
③向 溶液中通入过量
溶液中通入过量 气体:
气体: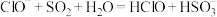
④向 溶液中加入少量
溶液中加入少量 溶液:
溶液:
(4)①下列能证明草酸为弱酸的实验是_______ (填标号)。
A.室温下,分别取等浓度 溶液和盐酸测 pH,
溶液和盐酸测 pH, 溶液 pH 大于盐酸
溶液 pH 大于盐酸
B.室温下,浓度为 c1的 溶液 pH=a,加入一定量的
溶液 pH=a,加入一定量的 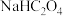 溶液,测得pH>a
溶液,测得pH>a
C.室温下,取pH=a(a<3)的 溶液稀释 100 倍后,测其pH<a +2
溶液稀释 100 倍后,测其pH<a +2
D.标准状况下,取0.10mol/L的 溶液100mL 与足量锌粉反应,收集到H2体积为224mL
溶液100mL 与足量锌粉反应,收集到H2体积为224mL
②用0.02000 mol/L的NaOH溶液滴定某未知浓度的草酸,若选择甲基橙为指示剂,到达滴定终点时主要溶质的化学式为_______ 。当pH为3时,溶液中
_______ 。
 | HF |  |  |  | |
 | 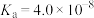 | 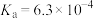 | 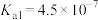 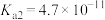 | 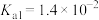 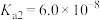 | 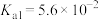 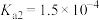 |
①
 溶液 ②
溶液 ② 溶液 ③
溶液 ③ 溶液 ④
溶液 ④ 溶液 ⑤
溶液 ⑤ 溶液
溶液(2)常温下,将
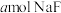 溶于水向该溶液中滴加
溶于水向该溶液中滴加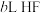 溶液后溶液呈中性,所滴加HF溶液的浓度为
溶液后溶液呈中性,所滴加HF溶液的浓度为 。
。(3)下列离子方程式错误的是
①向
 溶液中加入过量
溶液中加入过量 溶液:
溶液:
②向
 溶液中通入少量
溶液中通入少量 气体:
气体: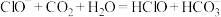
③向
 溶液中通入过量
溶液中通入过量 气体:
气体: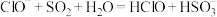
④向
 溶液中加入少量
溶液中加入少量 溶液:
溶液:
(4)①下列能证明草酸为弱酸的实验是
A.室温下,分别取等浓度
 溶液和盐酸测 pH,
溶液和盐酸测 pH, 溶液 pH 大于盐酸
溶液 pH 大于盐酸B.室温下,浓度为 c1的
 溶液 pH=a,加入一定量的
溶液 pH=a,加入一定量的 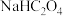 溶液,测得pH>a
溶液,测得pH>aC.室温下,取pH=a(a<3)的
 溶液稀释 100 倍后,测其pH<a +2
溶液稀释 100 倍后,测其pH<a +2D.标准状况下,取0.10mol/L的
 溶液100mL 与足量锌粉反应,收集到H2体积为224mL
溶液100mL 与足量锌粉反应,收集到H2体积为224mL②用0.02000 mol/L的NaOH溶液滴定某未知浓度的草酸,若选择甲基橙为指示剂,到达滴定终点时主要溶质的化学式为

您最近一年使用:0次
名校
解题方法
2 . 生活无处不化学,运用所学知识,回答下列问题。
(1)节日燃放的五彩缤纷的烟花,就是锂、钠、钾、锶、钡等金属化合物所呈现的各种艳丽色彩。 、
、 在无色火焰上灼烧时,其焰色
在无色火焰上灼烧时,其焰色___________ (填“相同”或“不相同”),该原理是___________ (填“物理”或“化学”)变化。
(2)电子工业用 溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出
溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出 溶液与铜反应的离子方程式:
溶液与铜反应的离子方程式:___________ 。
(3)高铁酸钠( )是一种新型的净水剂。其净水过程中发生的化学反应主要为
)是一种新型的净水剂。其净水过程中发生的化学反应主要为 ,证明有
,证明有 胶体生成的方法为:
胶体生成的方法为:___________ 。
(4)工业上常用绿矾( )做处理剂,处理废水中含有的重铬酸根离子(
)做处理剂,处理废水中含有的重铬酸根离子( ),反应的离子方程式如下:
),反应的离子方程式如下: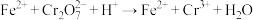 (未配平)。
(未配平)。
①在该反应中,氧化剂是___________ (填离子符号,下同),被氧化的是___________ 。
②该反应每消耗 离子,生成
离子,生成 的物质的量为
的物质的量为___________ mol,转移电子的物质的量为___________ mol。
(1)节日燃放的五彩缤纷的烟花,就是锂、钠、钾、锶、钡等金属化合物所呈现的各种艳丽色彩。
 、
、 在无色火焰上灼烧时,其焰色
在无色火焰上灼烧时,其焰色(2)电子工业用
 溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出
溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出 溶液与铜反应的离子方程式:
溶液与铜反应的离子方程式:(3)高铁酸钠(
 )是一种新型的净水剂。其净水过程中发生的化学反应主要为
)是一种新型的净水剂。其净水过程中发生的化学反应主要为 ,证明有
,证明有 胶体生成的方法为:
胶体生成的方法为:(4)工业上常用绿矾(
 )做处理剂,处理废水中含有的重铬酸根离子(
)做处理剂,处理废水中含有的重铬酸根离子( ),反应的离子方程式如下:
),反应的离子方程式如下: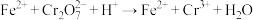 (未配平)。
(未配平)。①在该反应中,氧化剂是
②该反应每消耗
 离子,生成
离子,生成 的物质的量为
的物质的量为
您最近一年使用:0次
名校
解题方法
3 . 铝、氧化铝的性质与其他常见金属及氧化物相比,有一定的特殊性。
(1)可用NaOH溶液除去铁粉中的铝粉,反应原理是(用离子方程式表示)___________ ,将2.7gAl分别置于足量的NaOH溶液、稀硫酸中,生成H2的体积之比(同温同压)为___________ 。
(2)证明Al2O3是两性氧化物的常用试剂是___________ (填名称),将ag废铝片置于100mL盐酸中,测得反应过程中生成氢气体积(标准状况)与时间的关系如图所示:0~t1时间段无气体生成的原因是___________ ,若反应后所得溶液中n(Al3+)=0.102mol且盐酸恰好完全反应,则原溶液中c(HCl)=___________ 。
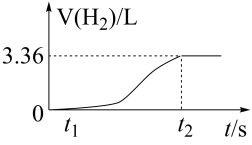
(1)可用NaOH溶液除去铁粉中的铝粉,反应原理是(用离子方程式表示)
(2)证明Al2O3是两性氧化物的常用试剂是

您最近一年使用:0次
2022-06-22更新
|
335次组卷
|
4卷引用:青海玉树州三校2021-2022学年高一上学期期末考试化学试题
名校
4 . Co2O3、Co3+是均属于极强的氧化剂,在生产中有着重要的应用。
(1)一定条件下,Co3+与足量Na2S2O3溶液反应后生成Co2+和SO ,写出该反应的离子方程式
,写出该反应的离子方程式___ 。设计实验证明反应后溶液中含有SO :
:___ 。(已知:S2O 与H+反应生成S、SO2,BaS2O3不溶于水)
与H+反应生成S、SO2,BaS2O3不溶于水)
(2)为测定某Co2O3样品中Co2O3的纯度(杂质不参与反应),现进行如下实验:
步骤1:称取样品2.000g于锥形瓶中,加入足量硫酸和50mL0.5000mol·L-1FeSO4溶液充分反应。
步骤2:向步骤1所得溶液中逐滴滴加0.0500mol·L-1KMnO4标准溶液至终点,消耗KMnO4标准溶液的体积为20.00mL。
已知步骤1、2中所涉及物质的转化分别为:Co2O3 Co3+
Co3+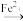 Co2+、MnO
Co2+、MnO
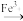 Mn2+
Mn2+
通过计算确定Co2O3样品中Co2O3的质量分数___ (写出计算过程)。
(1)一定条件下,Co3+与足量Na2S2O3溶液反应后生成Co2+和SO
 ,写出该反应的离子方程式
,写出该反应的离子方程式 :
: 与H+反应生成S、SO2,BaS2O3不溶于水)
与H+反应生成S、SO2,BaS2O3不溶于水)(2)为测定某Co2O3样品中Co2O3的纯度(杂质不参与反应),现进行如下实验:
步骤1:称取样品2.000g于锥形瓶中,加入足量硫酸和50mL0.5000mol·L-1FeSO4溶液充分反应。
步骤2:向步骤1所得溶液中逐滴滴加0.0500mol·L-1KMnO4标准溶液至终点,消耗KMnO4标准溶液的体积为20.00mL。
已知步骤1、2中所涉及物质的转化分别为:Co2O3
 Co3+
Co3+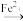 Co2+、MnO
Co2+、MnO
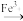 Mn2+
Mn2+通过计算确定Co2O3样品中Co2O3的质量分数
您最近一年使用:0次
名校
5 . 已知黄钠铁矾[NaxFey(SO4)m(OH)n]具有沉淀颗粒大、沉淀速率快、容易过滤等特点。某研究小组先将某废水中Fe2+氧化为Fe3+,再加入Na2SO4使其生成黄钠铁矾而除去。该小组为测定黄钠铁矾的组成,进行了如下实验:
①称取4.850 g样品,加盐酸完全溶解后,配成100.00 mL溶液A;
②量取25.00 mL溶液A,加入足量的KI,用0.2500 mol·L-1Na2S2O3溶液进行滴定(反应为I2+2Na2S2O3=2NaI+Na2S4O6),消耗30.00 mLNa2S2O3溶液至终点。
③另取25.00 mL溶液A,加足量BaCl2溶液充分反应后,过滤、洗涤、干燥后得沉淀1.165 g。
(1)如何证明步骤③中的沉淀已洗涤干净?___________ 。
(2)用Na2S2O3溶液进行滴定时,使用的指示剂为________ ,滴定到终点的颜色变化为_________ 。
(3)通过计算确定黄钠铁矾的化学式_________ (写出计算过程)。
①称取4.850 g样品,加盐酸完全溶解后,配成100.00 mL溶液A;
②量取25.00 mL溶液A,加入足量的KI,用0.2500 mol·L-1Na2S2O3溶液进行滴定(反应为I2+2Na2S2O3=2NaI+Na2S4O6),消耗30.00 mLNa2S2O3溶液至终点。
③另取25.00 mL溶液A,加足量BaCl2溶液充分反应后,过滤、洗涤、干燥后得沉淀1.165 g。
(1)如何证明步骤③中的沉淀已洗涤干净?
(2)用Na2S2O3溶液进行滴定时,使用的指示剂为
(3)通过计算确定黄钠铁矾的化学式
您最近一年使用:0次
6 . 草酸(H2C2O4)存在于自然界的植物中,是一种二元弱酸。草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以 上分解。
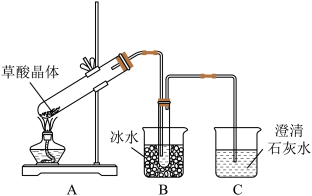
回答下列问题:
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物。
①装置A中试管口略向上倾斜的原因是____________________ ;
②装置C中可观察到有气泡冒出且澄清石灰水变浑浊,由此可知草酸晶体分解的产物中有____________________ ;
③装置B的主要作用是冷凝水蒸气、草酸等,防止草酸进入装置C发生_______ 反应(填化学方程式),从而干扰CO2的检验。
(2)乙组同学认为草酸晶体分解的产物中含有CO,为进行验证,选用甲组实验中的装置A、B和下图所示的部分装置(可以重复选用)进行实验。
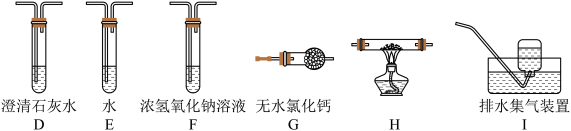
①乙组同学的实验装置中,依次连接的合理顺序为A→B→____ →D→G→_____ →D→______ 。装置H反应管中盛有的物质是_______ (填化学式)。
②能证明草酸晶体分解产物中有CO的现象是:__________________ ,___________ ,第二个D装置中澄清石灰水变浑浊。
③H装置中发生反应的化学方程式为______________________ 。

回答下列问题:
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物。
①装置A中试管口略向上倾斜的原因是
②装置C中可观察到有气泡冒出且澄清石灰水变浑浊,由此可知草酸晶体分解的产物中有
③装置B的主要作用是冷凝水蒸气、草酸等,防止草酸进入装置C发生
(2)乙组同学认为草酸晶体分解的产物中含有CO,为进行验证,选用甲组实验中的装置A、B和下图所示的部分装置(可以重复选用)进行实验。

①乙组同学的实验装置中,依次连接的合理顺序为A→B→
②能证明草酸晶体分解产物中有CO的现象是:
③H装置中发生反应的化学方程式为
您最近一年使用:0次
名校
解题方法
7 . 人教版高中化学选修4实验2-3中用到了硫代硫酸钠,某化学兴趣小组对这一物质展开了如下探究。
实验一.制备Na2S2O3·5H2O 通过查阅资料,该化学兴趣小组设计了如下的装置(略去部分夹持仪器)来制取Na2S2O3·5H2O晶体。
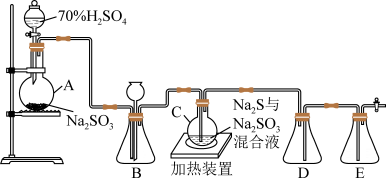
已知烧瓶C中发生如下三个反应:
Na2S(aq)+H2O(l)+SO2(g) = Na2SO3(aq)+H2S(aq)
2H2S(aq)+SO2(g) =3S(s)+2H2O(l) ; S(s)+Na2SO3(aq) Na2S2O3(aq)
Na2S2O3(aq)
(1)写出A中的化学反应方程式_________ 。
(2)装置B的作用之一是观察SO2的生成速率。控制SO2生成速率可以采取的措施有___________ (写一条)
(3)装置E的作用是__________ 。
(4)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为_______________ 。
实验二.性质探究
(5)常温下,用pH试纸测定0.1 mol·L-1 Na2S2O3溶液pH值约为8,测定时的具体操作是_____ 。
(6)向新制氯水中滴加少量Na2S2O3溶液,氯水颜色变浅,有硫酸根离子生成,写出该反应的离子化学方程式_________ 。 甲同学取反应后的溶液少量,滴加硝酸银溶液,观察到有白色沉淀并据此认为氯水可将Na2S2O3氧化。你认为该方案是否合理并说明理由_____________________ 。若方案不合理,请你设计一个实验方案,证明Na2S2O3被氯水氧化______________ 。
实验一.制备Na2S2O3·5H2O 通过查阅资料,该化学兴趣小组设计了如下的装置(略去部分夹持仪器)来制取Na2S2O3·5H2O晶体。

已知烧瓶C中发生如下三个反应:
Na2S(aq)+H2O(l)+SO2(g) = Na2SO3(aq)+H2S(aq)
2H2S(aq)+SO2(g) =3S(s)+2H2O(l) ; S(s)+Na2SO3(aq)
 Na2S2O3(aq)
Na2S2O3(aq)(1)写出A中的化学反应方程式
(2)装置B的作用之一是观察SO2的生成速率。控制SO2生成速率可以采取的措施有
(3)装置E的作用是
(4)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为
实验二.性质探究
(5)常温下,用pH试纸测定0.1 mol·L-1 Na2S2O3溶液pH值约为8,测定时的具体操作是
(6)向新制氯水中滴加少量Na2S2O3溶液,氯水颜色变浅,有硫酸根离子生成,写出该反应的离子化学方程式
您最近一年使用:0次
8 . 已知:硝酸铜受热易分解。170℃时,2Cu(NO3)2 2CuO+4NO2↑+O2↑开始分解,至250℃分解完全。(其中2NO2
2CuO+4NO2↑+O2↑开始分解,至250℃分解完全。(其中2NO2 N2O4,2NO2
N2O4,2NO2 2NO+O2等反应忽略不计)。
2NO+O2等反应忽略不计)。
800℃时,4CuO 2Cu2O+O2↑ 开始分解,至1000℃以上分解完全。
2Cu2O+O2↑ 开始分解,至1000℃以上分解完全。
(1)取5.64 g无水硝酸铜,加热至1000℃以上,将生成的气体导入足量的NaOH溶液充分吸收后,还有逸出的气体是____ (填分子式),体积(标准状况)为______ ;将吸收液加水稀释到100 mL,此溶液中NO3-的物质的量浓度为_____________ 。
(2)取5.64 g无水硝酸铜加热至某温度分解后的残留固体中含有1.60 g CuO,则残留固体的质量可能是_________ 。
(3)实验证明,当温度达到1800℃时,Cu2O也会发生分解:2Cu2O 4Cu+O2↑。取8.00 g CuO,加热到1800℃左右,冷却后称得质量为6.88 g,通过计算求出反应后剩余固体中各成分的物质的量之比________________ 。
(4)取8.00 g CuO,通入一定量H2并加热,使其部分还原为Cu和Cu2O,且其中n(Cu2O):n(Cu)=x。将此混合物溶于足量的稀硫酸中(Cu2O+2H+=Cu+Cu2++H2O),充分反应后过滤得到Cu y g,试求未被还原的CuO的物质的量(用含x、y的代数式表示)。_________
 2CuO+4NO2↑+O2↑开始分解,至250℃分解完全。(其中2NO2
2CuO+4NO2↑+O2↑开始分解,至250℃分解完全。(其中2NO2 N2O4,2NO2
N2O4,2NO2 2NO+O2等反应忽略不计)。
2NO+O2等反应忽略不计)。800℃时,4CuO
 2Cu2O+O2↑ 开始分解,至1000℃以上分解完全。
2Cu2O+O2↑ 开始分解,至1000℃以上分解完全。(1)取5.64 g无水硝酸铜,加热至1000℃以上,将生成的气体导入足量的NaOH溶液充分吸收后,还有逸出的气体是
(2)取5.64 g无水硝酸铜加热至某温度分解后的残留固体中含有1.60 g CuO,则残留固体的质量可能是
(3)实验证明,当温度达到1800℃时,Cu2O也会发生分解:2Cu2O 4Cu+O2↑。取8.00 g CuO,加热到1800℃左右,冷却后称得质量为6.88 g,通过计算求出反应后剩余固体中各成分的物质的量之比
(4)取8.00 g CuO,通入一定量H2并加热,使其部分还原为Cu和Cu2O,且其中n(Cu2O):n(Cu)=x。将此混合物溶于足量的稀硫酸中(Cu2O+2H+=Cu+Cu2++H2O),充分反应后过滤得到Cu y g,试求未被还原的CuO的物质的量(用含x、y的代数式表示)。
您最近一年使用:0次
19-20高一·全国·期末
解题方法
9 . 有一瓶澄清的溶液,其中可能含有H+、NH4+、Na+、Al3+、Fe3+、HCO3-、SO42-、I-,取该溶液进行以下实验:
①用pH试纸检验,溶液显强酸性;
②该溶液的焰色反应没有黄色;
③取溶液适量加入少量CCl4和数滴新制氯水振荡,CCl4层呈紫红色;
④当向该溶液中加入某浓度的NaOH溶液时,生成沉淀的物质的量变化如图
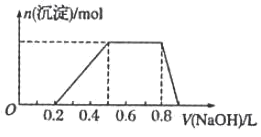
(1)该溶液中肯定含有的离子是_________ ,已确定阳离子的物质的量之比为_________
(2)肯定不含的离子是____________
(3)不能确定的离子是___________ ,如何证明该离子是否存在? __________________
(4)请写出第④步中沉淀溶解的离子方程式________________________
①用pH试纸检验,溶液显强酸性;
②该溶液的焰色反应没有黄色;
③取溶液适量加入少量CCl4和数滴新制氯水振荡,CCl4层呈紫红色;
④当向该溶液中加入某浓度的NaOH溶液时,生成沉淀的物质的量变化如图

(1)该溶液中肯定含有的离子是
(2)肯定不含的离子是
(3)不能确定的离子是
(4)请写出第④步中沉淀溶解的离子方程式
您最近一年使用:0次
名校
解题方法
10 . 三硝酸甘油酯[C3H5(ONO2)3]是一种炸药,可因撞击而爆炸,同时产生高温。爆炸按下式进行:4C3H5(ONO2)3→wN2+xCO2+yH2O+zO2(式中w,x,y,z为化学计量数)。科学实验证明:相同条件(温度、压力)下相同体积的不同气体所含分子数相等。当三硝酸甘油酯爆炸并恢复到常温时,所得气体的体积比为____ 。
您最近一年使用:0次



