名校
解题方法
1 . 铝、氧化铝的性质与其他常见金属及氧化物相比,有一定的特殊性。
(1)可用NaOH溶液除去铁粉中的铝粉,反应原理是(用离子方程式表示)___________ ,将2.7gAl分别置于足量的NaOH溶液、稀硫酸中,生成H2的体积之比(同温同压)为___________ 。
(2)证明Al2O3是两性氧化物的常用试剂是___________ (填名称),将ag废铝片置于100mL盐酸中,测得反应过程中生成氢气体积(标准状况)与时间的关系如图所示:0~t1时间段无气体生成的原因是___________ ,若反应后所得溶液中n(Al3+)=0.102mol且盐酸恰好完全反应,则原溶液中c(HCl)=___________ 。
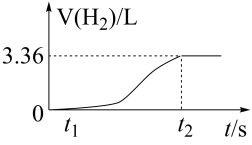
(1)可用NaOH溶液除去铁粉中的铝粉,反应原理是(用离子方程式表示)
(2)证明Al2O3是两性氧化物的常用试剂是

您最近一年使用:0次
2022-06-22更新
|
336次组卷
|
4卷引用:青海玉树州三校2021-2022学年高一上学期期末考试化学试题
名校
解题方法
2 . 某同学欲验证碳与浓硫酸反应产物的性质。现已将装置如图连接,请回答下列问题。
(1)烧瓶中发生反应的化学反应方程式是___________ 。
(2)实验中两次使用到品红溶液,其目的不同。A的使用目的是_____ ,通过洗气瓶C中无现象和___ 的现象,证明反应有_______ (填化学式)生成。
(3)洗气瓶B中溶液颜色变浅,说明碳与浓硫酸反应的产物之一______ (填名称)具有______ 的性质。
(4)实验完成后,取出洗气瓶A中的无色溶液于试管中,加热,可观察到__________ 。
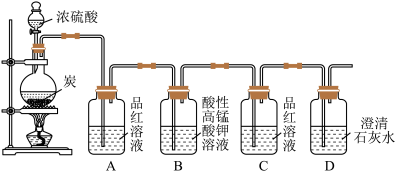
(1)烧瓶中发生反应的化学反应方程式是
(2)实验中两次使用到品红溶液,其目的不同。A的使用目的是
(3)洗气瓶B中溶液颜色变浅,说明碳与浓硫酸反应的产物之一
(4)实验完成后,取出洗气瓶A中的无色溶液于试管中,加热,可观察到
您最近一年使用:0次
2020-01-05更新
|
361次组卷
|
3卷引用:贵州省从江县第一民族中学2021-2022学年高一下学期第一次月考化学试题
名校
3 . 按要求回答下列问题:
(1)已知拆开 键、
键、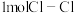 键、
键、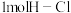 键分别需要吸收的能量为
键分别需要吸收的能量为 、
、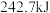 、
、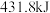 。则由
。则由 和
和 反应生成1molHCl需要
反应生成1molHCl需要_______  填“放出”或“吸收”
填“放出”或“吸收”
_________ 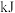 的热量。
的热量。
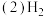 可以在
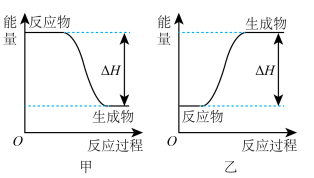
可以在 中安静地燃烧。甲、乙两图中,能表示该反应能量变化的是图
中安静地燃烧。甲、乙两图中,能表示该反应能量变化的是图_____  填“甲”或“乙”
填“甲”或“乙” 。
。
(3)将等物质的量的A和B,混合于2 L的密闭容器中,发生如下反应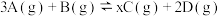 。2min后,测得D的浓度为
。2min后,测得D的浓度为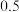 mol/L ,
mol/L ,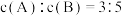 ,C的反应速率是
,C的反应速率是 mol/(L·min)。则:
mol/(L·min)。则:
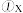 的值是
的值是__________ ;
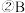 的平均反应速率是
的平均反应速率是____________ ;
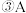 在2min末的浓度是
在2min末的浓度是________________ ;
④若此后各物质的量均不再变化,则证明此可逆反应达到了_______ 的程度。
A.反应彻底 反应终止
反应终止 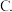 化学平衡
化学平衡  无法判断
无法判断
(1)已知拆开
 键、
键、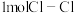 键、
键、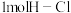 键分别需要吸收的能量为
键分别需要吸收的能量为 、
、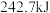 、
、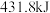 。则由
。则由 和
和 反应生成1molHCl需要
反应生成1molHCl需要 填“放出”或“吸收”
填“放出”或“吸收”
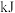 的热量。
的热量。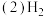 可以在
可以在 中安静地燃烧。甲、乙两图中,能表示该反应能量变化的是图
中安静地燃烧。甲、乙两图中,能表示该反应能量变化的是图 填“甲”或“乙”
填“甲”或“乙” 。
。
(3)将等物质的量的A和B,混合于2 L的密闭容器中,发生如下反应
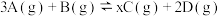 。2min后,测得D的浓度为
。2min后,测得D的浓度为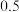 mol/L ,
mol/L ,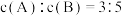 ,C的反应速率是
,C的反应速率是 mol/(L·min)。则:
mol/(L·min)。则: 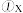 的值是
的值是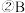 的平均反应速率是
的平均反应速率是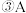 在2min末的浓度是
在2min末的浓度是④若此后各物质的量均不再变化,则证明此可逆反应达到了
A.反应彻底
 反应终止
反应终止  化学平衡
化学平衡  无法判断
无法判断
您最近一年使用:0次
2019-07-20更新
|
661次组卷
|
3卷引用:江西省丰城市东煌学校2021-2022学年高一下学期5月月考化学试题
名校
4 . “84消毒液”能有效杀灭甲型H1N1病毒,某同学购买了一瓶84消毒液,该消毒液通常稀释到100倍(体积比)使用。查阅相关资料和消毒液包装说明得到如图信息:
(1)该84消毒液NaClO物质的量浓度约为_______ (保留1位小数)。
(2)该同学参阅该84消毒液的配方,欲用NaClO固体配制480mL该种84消毒液。下列说法不正确的是_______ (填字母)。
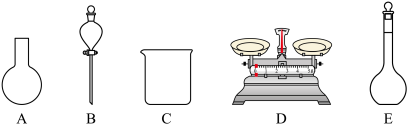
A.如图所示的仪器中,有三种是不需要的,还另需要一种玻璃仪器
B.使用前要检查容量瓶是否漏液
C.容量瓶上标有容积、温度和浓度
D.需要称量NaClO固体的质量为149.0g
E.容量瓶用蒸馏水洗净后,须烘干后再使用
(3)一瓶上述84消毒液理论上能吸收空气中_______ L的CO2(标准状况下)而变质。(已知:CO2+NaClO+H2O=NaHCO3+HClO)
(4)84消毒液与稀硫酸混合使用可增强消毒能力,请用化学方程式解释其原因_______ ,某消毒小组人员用18.4mol·L-1的浓硫酸配制500mL2.3mol·L-1的稀硫酸用于增强84消毒液的消毒能力,需取用浓硫酸的体积为_______ mL。
(5)在配制过程中,下列操作中能使所配溶液的浓度偏高的有_______ (填代号)。
①用量筒量取98%的硫酸时俯视
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③转移前,容量瓶中含有少量蒸馏水
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤定容时,俯视刻度线
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
| 84消毒液 (有效成分)NaClO (规格)1000mL (质量分数)25% (密度)1.19g/cm3 |
(1)该84消毒液NaClO物质的量浓度约为
(2)该同学参阅该84消毒液的配方,欲用NaClO固体配制480mL该种84消毒液。下列说法不正确的是

A.如图所示的仪器中,有三种是不需要的,还另需要一种玻璃仪器
B.使用前要检查容量瓶是否漏液
C.容量瓶上标有容积、温度和浓度
D.需要称量NaClO固体的质量为149.0g
E.容量瓶用蒸馏水洗净后,须烘干后再使用
(3)一瓶上述84消毒液理论上能吸收空气中
(4)84消毒液与稀硫酸混合使用可增强消毒能力,请用化学方程式解释其原因
(5)在配制过程中,下列操作中能使所配溶液的浓度偏高的有
①用量筒量取98%的硫酸时俯视
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③转移前,容量瓶中含有少量蒸馏水
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤定容时,俯视刻度线
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
您最近一年使用:0次
2023-08-26更新
|
284次组卷
|
2卷引用:辽宁省大连市第八中学2022-2023学年高一上学期12月月考化学试题
名校
5 . 某小组设计如下实验研究实验室中的甲酸。已知:25℃时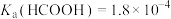
(1)配制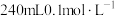 的HCOOH溶液,需
的HCOOH溶液,需 的HCOOH溶液的体积为
的HCOOH溶液的体积为_______ mL。
(2)为确定甲酸溶液的准确浓度,取20mL甲酸溶液于锥形瓶中,加入2滴_______ 溶液,用 的NaOH溶液滴定至终点,消耗NaOH溶液的体积为22.04mL,滴定实验中所使用的锥形瓶的容积最恰当的是
的NaOH溶液滴定至终点,消耗NaOH溶液的体积为22.04mL,滴定实验中所使用的锥形瓶的容积最恰当的是_______ (填字母)。
A.50mL B.100mL C.200mL D.250mL
(3)下列关于滴定操作的说法正确的_______
(4)小组同学用_______ 测出25℃时该甲酸溶液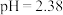 ,则水电离产生的
,则水电离产生的 数量级为
数量级为_______ 。
(5)25℃时甲酸与醋酸钠溶液反应: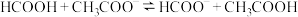 ,该反应的平衡常数为10,则该温度下醋酸的电离常数
,该反应的平衡常数为10,则该温度下醋酸的电离常数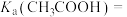
_______ 。
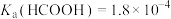
(1)配制
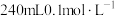 的HCOOH溶液,需
的HCOOH溶液,需 的HCOOH溶液的体积为
的HCOOH溶液的体积为(2)为确定甲酸溶液的准确浓度,取20mL甲酸溶液于锥形瓶中,加入2滴
 的NaOH溶液滴定至终点,消耗NaOH溶液的体积为22.04mL,滴定实验中所使用的锥形瓶的容积最恰当的是
的NaOH溶液滴定至终点,消耗NaOH溶液的体积为22.04mL,滴定实验中所使用的锥形瓶的容积最恰当的是A.50mL B.100mL C.200mL D.250mL
(3)下列关于滴定操作的说法正确的_______
| A.滴定前应检查滴定管是否漏水,进行洗涤、润洗 |
| B.将标准溶液装入滴定管时,应借助玻璃棒或漏斗等玻璃仪器转移 |
| C.进行滴定操作时,眼睛要始终注视着滴定管内液面的变化 |
| D.滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁 |
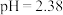 ,则水电离产生的
,则水电离产生的 数量级为
数量级为(5)25℃时甲酸与醋酸钠溶液反应:
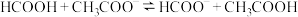 ,该反应的平衡常数为10,则该温度下醋酸的电离常数
,该反应的平衡常数为10,则该温度下醋酸的电离常数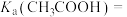
您最近一年使用:0次
2022-11-12更新
|
232次组卷
|
2卷引用:湖北省荆、荆、襄、宜四地七校考试联盟2022-2023学年高二上学期期中联考化学试题
解题方法
6 . 回答下列问题:
(1)合成气(CO、H2)是一种重要的化工原料,在化工生产中具有十分广泛的用途。工业上用CO和H2合成CH3OH: △H。则该反应的平衡常数表达式为
△H。则该反应的平衡常数表达式为_______ ;
(2)测得不同温度下反应的平衡常数 如下表:
如下表:
下列说法错误的是_______。
(3)工业上,利用水煤气法制取合成气,其中发生的一步反应为:CO(g)+H2O(g) CO2(g)+H2(g) △H=-41.2kJ·mol-1。已知
CO2(g)+H2(g) △H=-41.2kJ·mol-1。已知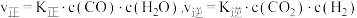 (k正、k逆为化学反应速率常数,只与温度有关,与浓度、压强无关)。830℃时,体积为2L的恒容密闭容器中,投入2molCO(g)和2molH2O(g)。5min达到平衡,测得H2的平均生成速率为0.1mol∙L-1∙min-1,则反应达到平衡后,速率常数
(k正、k逆为化学反应速率常数,只与温度有关,与浓度、压强无关)。830℃时,体积为2L的恒容密闭容器中,投入2molCO(g)和2molH2O(g)。5min达到平衡,测得H2的平均生成速率为0.1mol∙L-1∙min-1,则反应达到平衡后,速率常数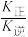 =
=_______ 。
(4)以天然气为原料生产合成气也有多种方法,其中Sparg工艺的原理为CH4(g)+CO2(g) 2CO(g)+2H2(g) △H1。T℃下,向容积可变的密闭容器中充入一定量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如表所示:
2CO(g)+2H2(g) △H1。T℃下,向容积可变的密闭容器中充入一定量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如表所示:
①T℃下,该反应的平衡常数K=_______ 。
②实验1中,CO的平衡体积分数为_______ %(保留三位有效数字)。
③V1:V2=_______ 。
(1)合成气(CO、H2)是一种重要的化工原料,在化工生产中具有十分广泛的用途。工业上用CO和H2合成CH3OH:
 △H。则该反应的平衡常数表达式为
△H。则该反应的平衡常数表达式为(2)测得不同温度下反应的平衡常数
 如下表:
如下表:| 温度/℃ | T1 | 100 | T2 | 200 | 300 |
| 平衡常数K | 100 | 13 | 1 | 1.9×10-2 | 2.4×10-4 |
| A.△H<0 |
| B.该反应的ΔS<0 |
| C.T2时,某时刻1L容器中含0.1mol CO、0.2mol H2和0.3mol CH3OH,此时v正>v逆 |
| D.T1时,向1L密闭容器中投入0.1mol CO和0.2mol H2,平衡时CO转化率为50% |
 CO2(g)+H2(g) △H=-41.2kJ·mol-1。已知
CO2(g)+H2(g) △H=-41.2kJ·mol-1。已知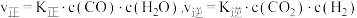 (k正、k逆为化学反应速率常数,只与温度有关,与浓度、压强无关)。830℃时,体积为2L的恒容密闭容器中,投入2molCO(g)和2molH2O(g)。5min达到平衡,测得H2的平均生成速率为0.1mol∙L-1∙min-1,则反应达到平衡后,速率常数
(k正、k逆为化学反应速率常数,只与温度有关,与浓度、压强无关)。830℃时,体积为2L的恒容密闭容器中,投入2molCO(g)和2molH2O(g)。5min达到平衡,测得H2的平均生成速率为0.1mol∙L-1∙min-1,则反应达到平衡后,速率常数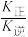 =
=(4)以天然气为原料生产合成气也有多种方法,其中Sparg工艺的原理为CH4(g)+CO2(g)
 2CO(g)+2H2(g) △H1。T℃下,向容积可变的密闭容器中充入一定量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如表所示:
2CO(g)+2H2(g) △H1。T℃下,向容积可变的密闭容器中充入一定量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如表所示:| 实验编号 | 容器体积 | 物质浓度/mol·L-1 | ||
| CH4 | CO2 | CO | ||
| 1 | V1 | 0.02 | 0.02 | 0.10 |
| 2 | V2 | x | x | 0.05 |
②实验1中,CO的平衡体积分数为
③V1:V2=
您最近一年使用:0次
名校
7 . 某温度下,在2L容器中3种物质间进行反应, X、Y、Z的物质的量随时间的变化曲线如图。反应在 t1min 时到达平衡,如图所示:

⑴①该反应的化学方程式是____________ 。
②该反应的平衡常数是___________ 。
③ 在t1min时,该反应达到了__________ 状态,下列可作为判断反应已达到该状态的是________ (填序号)。
A.X、Y、Z的反应速率相等 B.X、Y的物质的量浓度不再改变
C.生成 3mol Y 的同时生成 1mol Z D.生成 1mol Z 的同时生成 2mol X
⑵ ①若上述反应中X、Y、Z分别为 NH3 、H2 、N2 ,且已知1mol氨气分解成氮气和氢气要吸收46 kJ的热量,则由H2、N2 合成NH3 反应的热化学反应方程式为:____________________ 。
②甲、乙两位同学讨论放热反应和吸热反应:甲说加热后才能发生的化学反应是吸热反应;乙说反应中要持续加热才能进行的反应是吸热反应。你认为他们说法正确的是__________ 同学。

⑴①该反应的化学方程式是
②该反应的平衡常数是
③ 在t1min时,该反应达到了
A.X、Y、Z的反应速率相等 B.X、Y的物质的量浓度不再改变
C.生成 3mol Y 的同时生成 1mol Z D.生成 1mol Z 的同时生成 2mol X
⑵ ①若上述反应中X、Y、Z分别为 NH3 、H2 、N2 ,且已知1mol氨气分解成氮气和氢气要吸收46 kJ的热量,则由H2、N2 合成NH3 反应的热化学反应方程式为:
②甲、乙两位同学讨论放热反应和吸热反应:甲说加热后才能发生的化学反应是吸热反应;乙说反应中要持续加热才能进行的反应是吸热反应。你认为他们说法正确的是
您最近一年使用:0次
2018-09-26更新
|
154次组卷
|
2卷引用:黑龙江省绥化市第一中学2021-2022学年高二上学期期末考试化学试题



