解题方法
1 . 回答下列问题:
(1)合成气(CO、H2)是一种重要的化工原料,在化工生产中具有十分广泛的用途。工业上用CO和H2合成CH3OH: △H。则该反应的平衡常数表达式为
△H。则该反应的平衡常数表达式为_______ ;
(2)测得不同温度下反应的平衡常数 如下表:
如下表:
下列说法错误的是_______。
(3)工业上,利用水煤气法制取合成气,其中发生的一步反应为:CO(g)+H2O(g) CO2(g)+H2(g) △H=-41.2kJ·mol-1。已知
CO2(g)+H2(g) △H=-41.2kJ·mol-1。已知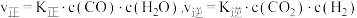 (k正、k逆为化学反应速率常数,只与温度有关,与浓度、压强无关)。830℃时,体积为2L的恒容密闭容器中,投入2molCO(g)和2molH2O(g)。5min达到平衡,测得H2的平均生成速率为0.1mol∙L-1∙min-1,则反应达到平衡后,速率常数
(k正、k逆为化学反应速率常数,只与温度有关,与浓度、压强无关)。830℃时,体积为2L的恒容密闭容器中,投入2molCO(g)和2molH2O(g)。5min达到平衡,测得H2的平均生成速率为0.1mol∙L-1∙min-1,则反应达到平衡后,速率常数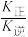 =
=_______ 。
(4)以天然气为原料生产合成气也有多种方法,其中Sparg工艺的原理为CH4(g)+CO2(g) 2CO(g)+2H2(g) △H1。T℃下,向容积可变的密闭容器中充入一定量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如表所示:
2CO(g)+2H2(g) △H1。T℃下,向容积可变的密闭容器中充入一定量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如表所示:
①T℃下,该反应的平衡常数K=_______ 。
②实验1中,CO的平衡体积分数为_______ %(保留三位有效数字)。
③V1:V2=_______ 。
(1)合成气(CO、H2)是一种重要的化工原料,在化工生产中具有十分广泛的用途。工业上用CO和H2合成CH3OH:
 △H。则该反应的平衡常数表达式为
△H。则该反应的平衡常数表达式为(2)测得不同温度下反应的平衡常数
 如下表:
如下表:| 温度/℃ | T1 | 100 | T2 | 200 | 300 |
| 平衡常数K | 100 | 13 | 1 | 1.9×10-2 | 2.4×10-4 |
| A.△H<0 |
| B.该反应的ΔS<0 |
| C.T2时,某时刻1L容器中含0.1mol CO、0.2mol H2和0.3mol CH3OH,此时v正>v逆 |
| D.T1时,向1L密闭容器中投入0.1mol CO和0.2mol H2,平衡时CO转化率为50% |
 CO2(g)+H2(g) △H=-41.2kJ·mol-1。已知
CO2(g)+H2(g) △H=-41.2kJ·mol-1。已知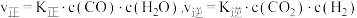 (k正、k逆为化学反应速率常数,只与温度有关,与浓度、压强无关)。830℃时,体积为2L的恒容密闭容器中,投入2molCO(g)和2molH2O(g)。5min达到平衡,测得H2的平均生成速率为0.1mol∙L-1∙min-1,则反应达到平衡后,速率常数
(k正、k逆为化学反应速率常数,只与温度有关,与浓度、压强无关)。830℃时,体积为2L的恒容密闭容器中,投入2molCO(g)和2molH2O(g)。5min达到平衡,测得H2的平均生成速率为0.1mol∙L-1∙min-1,则反应达到平衡后,速率常数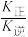 =
=(4)以天然气为原料生产合成气也有多种方法,其中Sparg工艺的原理为CH4(g)+CO2(g)
 2CO(g)+2H2(g) △H1。T℃下,向容积可变的密闭容器中充入一定量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如表所示:
2CO(g)+2H2(g) △H1。T℃下,向容积可变的密闭容器中充入一定量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如表所示:| 实验编号 | 容器体积 | 物质浓度/mol·L-1 | ||
| CH4 | CO2 | CO | ||
| 1 | V1 | 0.02 | 0.02 | 0.10 |
| 2 | V2 | x | x | 0.05 |
②实验1中,CO的平衡体积分数为
③V1:V2=
您最近一年使用:0次
名校
解题方法
2 . 化学平衡常数和化学平衡计算
(1)已知在448℃时,反应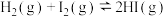 的平衡常数K为49,则该温度下反应
的平衡常数K为49,则该温度下反应 的平衡常数K′为
的平衡常数K′为_______ 。(用分数表示)
(2)某温度下,若把10mol 与30mol
与30mol 置于体积为10L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的
置于体积为10L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的
_______ 。(用分数表示)
(3)恒温恒压下,在一容积可变的容器中, 达到平衡状态时,
达到平衡状态时, 、
、 、
、 各1mol,若此时再充入3mol
各1mol,若此时再充入3mol ,则平衡
,则平衡_______ 移动(填“正向”、“逆向”或“不”)
(4)以水煤气为原料合成甲醇: ,容器为恒温、恒压
,容器为恒温、恒压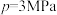 ,充入1mol
,充入1mol 和2mol
和2mol 达到平衡时
达到平衡时 的转化率为75%,平衡常数Kp=
的转化率为75%,平衡常数Kp=_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(5)在1L真空密闭容器中加入amol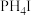 固体,t℃时发生如下反应:
固体,t℃时发生如下反应:
 ①
①
 ②
②
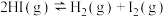 ③
③
达平衡时,体系中 ,
, ,
, ,则t°C时反应①的平衡常数K值为
,则t°C时反应①的平衡常数K值为_______ (用字母表示)
(6)查阅资料知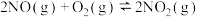 的反应历程分两步:
的反应历程分两步:
Ⅰ.
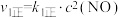 ;
;
Ⅱ.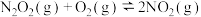 ;
; ;
;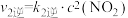
一定温度下,反应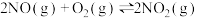 达到平衡状态,请写出用
达到平衡状态,请写出用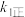 、
、 、
、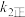 、
、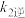 表示的平衡常数表达式
表示的平衡常数表达式
_______ 。
(1)已知在448℃时,反应
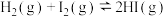 的平衡常数K为49,则该温度下反应
的平衡常数K为49,则该温度下反应 的平衡常数K′为
的平衡常数K′为(2)某温度下,若把10mol
 与30mol
与30mol 置于体积为10L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的
置于体积为10L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的
(3)恒温恒压下,在一容积可变的容器中,
 达到平衡状态时,
达到平衡状态时, 、
、 、
、 各1mol,若此时再充入3mol
各1mol,若此时再充入3mol ,则平衡
,则平衡(4)以水煤气为原料合成甲醇:
 ,容器为恒温、恒压
,容器为恒温、恒压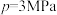 ,充入1mol
,充入1mol 和2mol
和2mol 达到平衡时
达到平衡时 的转化率为75%,平衡常数Kp=
的转化率为75%,平衡常数Kp=(5)在1L真空密闭容器中加入amol
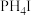 固体,t℃时发生如下反应:
固体,t℃时发生如下反应: ①
① ②
②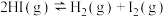 ③
③达平衡时,体系中
 ,
, ,
, ,则t°C时反应①的平衡常数K值为
,则t°C时反应①的平衡常数K值为(6)查阅资料知
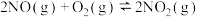 的反应历程分两步:
的反应历程分两步:Ⅰ.

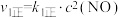 ;
;
Ⅱ.
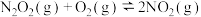 ;
; ;
;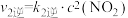
一定温度下,反应
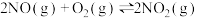 达到平衡状态,请写出用
达到平衡状态,请写出用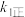 、
、 、
、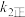 、
、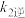 表示的平衡常数表达式
表示的平衡常数表达式
您最近一年使用:0次
3 . 随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。
(1)把煤作为燃料可通过下列两种途径:

途径Ⅰ:C(s)+O2(g)=CO2(g)ΔH1<0①
途径Ⅱ:先制成水煤气:C(s)+H2O(g)=CO(g)+H2(g)ΔH2>0②
再燃烧水煤气:2CO(g)+O2(g)=2CO2(g)ΔH3<0③
2H2(g)+O2(g)=2H2O(g)ΔH4<0④
则途径Ⅰ放出的热量___ (填“大于”“等于”或“小于”)途径Ⅱ放出的热量;ΔH1、ΔH2、ΔH3、ΔH4的数学关系式是___ 。
(2)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用如下方法合成甲醇:
方法一CO(g)+2H2(g)⇌CH3OH(g)
方法二CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)
在25℃、101kPa下,1克甲醇完全燃料放热22.68kJ,写出甲醇燃烧热的热化学方程式:___ 。
(3)金属钛冶炼过程中其中一步反应是将原料金红石转化:TiO2(金红石)+2C+2Cl2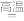 TiCl4+2CO
TiCl4+2CO
已知:
C(s)+O2(g)=CO2(g)ΔH=-393.5kJ•mol-1
2CO(g)+O2(g)=2CO2(g)ΔH=-566kJ•mol-1
TiO2(s)+2Cl2(g)=TiCl(s)+O2(g)ΔH=+141kJ•mol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=___ 。
(4)臭氧可用于净化空气、饮用水消毒,处理工业废物和作为漂白剂。臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:6Ag(s)+O3(g)=3Ag2O(s)ΔH=-235.8kJ•mol-1
已知:2Ag2O(s)=4Ag(s)+O2(g)ΔH=+62.2kJ•mol-1则O3转化为O2的热化学方程式为___ 。
(1)把煤作为燃料可通过下列两种途径:

途径Ⅰ:C(s)+O2(g)=CO2(g)ΔH1<0①
途径Ⅱ:先制成水煤气:C(s)+H2O(g)=CO(g)+H2(g)ΔH2>0②
再燃烧水煤气:2CO(g)+O2(g)=2CO2(g)ΔH3<0③
2H2(g)+O2(g)=2H2O(g)ΔH4<0④
则途径Ⅰ放出的热量
(2)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用如下方法合成甲醇:
方法一CO(g)+2H2(g)⇌CH3OH(g)
方法二CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)
在25℃、101kPa下,1克甲醇完全燃料放热22.68kJ,写出甲醇燃烧热的热化学方程式:
(3)金属钛冶炼过程中其中一步反应是将原料金红石转化:TiO2(金红石)+2C+2Cl2
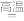 TiCl4+2CO
TiCl4+2CO已知:
C(s)+O2(g)=CO2(g)ΔH=-393.5kJ•mol-1
2CO(g)+O2(g)=2CO2(g)ΔH=-566kJ•mol-1
TiO2(s)+2Cl2(g)=TiCl(s)+O2(g)ΔH=+141kJ•mol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=
(4)臭氧可用于净化空气、饮用水消毒,处理工业废物和作为漂白剂。臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:6Ag(s)+O3(g)=3Ag2O(s)ΔH=-235.8kJ•mol-1
已知:2Ag2O(s)=4Ag(s)+O2(g)ΔH=+62.2kJ•mol-1则O3转化为O2的热化学方程式为
您最近一年使用:0次
2020-11-06更新
|
293次组卷
|
2卷引用:贵州省黔西南州金成实验学校2022-2023学年高二上学期9月月考化学试题



