名校
解题方法
1 . 人教版高中化学选修4实验2-3中用到了硫代硫酸钠,某化学兴趣小组对这一物质展开了如下探究。
实验一.制备Na2S2O3·5H2O 通过查阅资料,该化学兴趣小组设计了如下的装置(略去部分夹持仪器)来制取Na2S2O3·5H2O晶体。
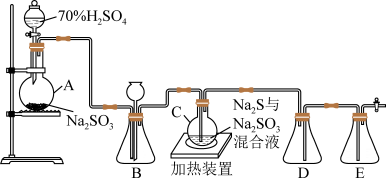
已知烧瓶C中发生如下三个反应:
Na2S(aq)+H2O(l)+SO2(g) = Na2SO3(aq)+H2S(aq)
2H2S(aq)+SO2(g) =3S(s)+2H2O(l) ; S(s)+Na2SO3(aq) Na2S2O3(aq)
Na2S2O3(aq)
(1)写出A中的化学反应方程式_________ 。
(2)装置B的作用之一是观察SO2的生成速率。控制SO2生成速率可以采取的措施有___________ (写一条)
(3)装置E的作用是__________ 。
(4)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为_______________ 。
实验二.性质探究
(5)常温下,用pH试纸测定0.1 mol·L-1 Na2S2O3溶液pH值约为8,测定时的具体操作是_____ 。
(6)向新制氯水中滴加少量Na2S2O3溶液,氯水颜色变浅,有硫酸根离子生成,写出该反应的离子化学方程式_________ 。 甲同学取反应后的溶液少量,滴加硝酸银溶液,观察到有白色沉淀并据此认为氯水可将Na2S2O3氧化。你认为该方案是否合理并说明理由_____________________ 。若方案不合理,请你设计一个实验方案,证明Na2S2O3被氯水氧化______________ 。
实验一.制备Na2S2O3·5H2O 通过查阅资料,该化学兴趣小组设计了如下的装置(略去部分夹持仪器)来制取Na2S2O3·5H2O晶体。

已知烧瓶C中发生如下三个反应:
Na2S(aq)+H2O(l)+SO2(g) = Na2SO3(aq)+H2S(aq)
2H2S(aq)+SO2(g) =3S(s)+2H2O(l) ; S(s)+Na2SO3(aq)
 Na2S2O3(aq)
Na2S2O3(aq)(1)写出A中的化学反应方程式
(2)装置B的作用之一是观察SO2的生成速率。控制SO2生成速率可以采取的措施有
(3)装置E的作用是
(4)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为
实验二.性质探究
(5)常温下,用pH试纸测定0.1 mol·L-1 Na2S2O3溶液pH值约为8,测定时的具体操作是
(6)向新制氯水中滴加少量Na2S2O3溶液,氯水颜色变浅,有硫酸根离子生成,写出该反应的离子化学方程式
您最近一年使用:0次
2 . 草酸(H2C2O4)存在于自然界的植物中,是一种二元弱酸。草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以 上分解。
回答下列问题:
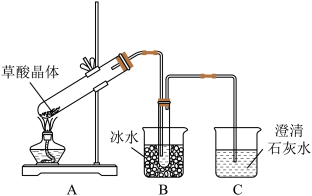
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物。
①装置A中试管口略向上倾斜的原因是____________________ ;
②装置C中可观察到有气泡冒出且澄清石灰水变浑浊,由此可知草酸晶体分解的产物中有____________________ ;
③装置B的主要作用是冷凝水蒸气、草酸等,防止草酸进入装置C发生_______ 反应(填化学方程式),从而干扰CO2的检验。
(2)乙组同学认为草酸晶体分解的产物中含有CO,为进行验证,选用甲组实验中的装置A、B和下图所示的部分装置(可以重复选用)进行实验。
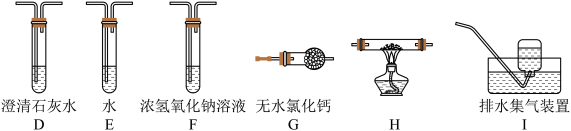
①乙组同学的实验装置中,依次连接的合理顺序为A→B→____ →D→G→_____ →D→______ 。装置H反应管中盛有的物质是_______ (填化学式)。
②能证明草酸晶体分解产物中有CO的现象是:__________________ ,___________ ,第二个D装置中澄清石灰水变浑浊。
③H装置中发生反应的化学方程式为______________________ 。

回答下列问题:
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物。
①装置A中试管口略向上倾斜的原因是
②装置C中可观察到有气泡冒出且澄清石灰水变浑浊,由此可知草酸晶体分解的产物中有
③装置B的主要作用是冷凝水蒸气、草酸等,防止草酸进入装置C发生
(2)乙组同学认为草酸晶体分解的产物中含有CO,为进行验证,选用甲组实验中的装置A、B和下图所示的部分装置(可以重复选用)进行实验。

①乙组同学的实验装置中,依次连接的合理顺序为A→B→
②能证明草酸晶体分解产物中有CO的现象是:
③H装置中发生反应的化学方程式为
您最近一年使用:0次
3 . 已知:硝酸铜受热易分解。170℃时,2Cu(NO3)2 2CuO+4NO2↑+O2↑开始分解,至250℃分解完全。(其中2NO2
2CuO+4NO2↑+O2↑开始分解,至250℃分解完全。(其中2NO2 N2O4,2NO2
N2O4,2NO2 2NO+O2等反应忽略不计)。
2NO+O2等反应忽略不计)。
800℃时,4CuO 2Cu2O+O2↑ 开始分解,至1000℃以上分解完全。
2Cu2O+O2↑ 开始分解,至1000℃以上分解完全。
(1)取5.64 g无水硝酸铜,加热至1000℃以上,将生成的气体导入足量的NaOH溶液充分吸收后,还有逸出的气体是____ (填分子式),体积(标准状况)为______ ;将吸收液加水稀释到100 mL,此溶液中NO3-的物质的量浓度为_____________ 。
(2)取5.64 g无水硝酸铜加热至某温度分解后的残留固体中含有1.60 g CuO,则残留固体的质量可能是_________ 。
(3)实验证明,当温度达到1800℃时,Cu2O也会发生分解:2Cu2O 4Cu+O2↑。取8.00 g CuO,加热到1800℃左右,冷却后称得质量为6.88 g,通过计算求出反应后剩余固体中各成分的物质的量之比________________ 。
(4)取8.00 g CuO,通入一定量H2并加热,使其部分还原为Cu和Cu2O,且其中n(Cu2O):n(Cu)=x。将此混合物溶于足量的稀硫酸中(Cu2O+2H+=Cu+Cu2++H2O),充分反应后过滤得到Cu y g,试求未被还原的CuO的物质的量(用含x、y的代数式表示)。_________
 2CuO+4NO2↑+O2↑开始分解,至250℃分解完全。(其中2NO2
2CuO+4NO2↑+O2↑开始分解,至250℃分解完全。(其中2NO2 N2O4,2NO2
N2O4,2NO2 2NO+O2等反应忽略不计)。
2NO+O2等反应忽略不计)。800℃时,4CuO
 2Cu2O+O2↑ 开始分解,至1000℃以上分解完全。
2Cu2O+O2↑ 开始分解,至1000℃以上分解完全。(1)取5.64 g无水硝酸铜,加热至1000℃以上,将生成的气体导入足量的NaOH溶液充分吸收后,还有逸出的气体是
(2)取5.64 g无水硝酸铜加热至某温度分解后的残留固体中含有1.60 g CuO,则残留固体的质量可能是
(3)实验证明,当温度达到1800℃时,Cu2O也会发生分解:2Cu2O 4Cu+O2↑。取8.00 g CuO,加热到1800℃左右,冷却后称得质量为6.88 g,通过计算求出反应后剩余固体中各成分的物质的量之比
(4)取8.00 g CuO,通入一定量H2并加热,使其部分还原为Cu和Cu2O,且其中n(Cu2O):n(Cu)=x。将此混合物溶于足量的稀硫酸中(Cu2O+2H+=Cu+Cu2++H2O),充分反应后过滤得到Cu y g,试求未被还原的CuO的物质的量(用含x、y的代数式表示)。
您最近一年使用:0次
19-20高一·全国·期末
解题方法
4 . 有一瓶澄清的溶液,其中可能含有H+、NH4+、Na+、Al3+、Fe3+、HCO3-、SO42-、I-,取该溶液进行以下实验:
①用pH试纸检验,溶液显强酸性;
②该溶液的焰色反应没有黄色;
③取溶液适量加入少量CCl4和数滴新制氯水振荡,CCl4层呈紫红色;
④当向该溶液中加入某浓度的NaOH溶液时,生成沉淀的物质的量变化如图
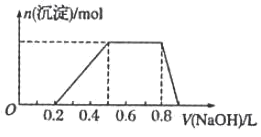
(1)该溶液中肯定含有的离子是_________ ,已确定阳离子的物质的量之比为_________
(2)肯定不含的离子是____________
(3)不能确定的离子是___________ ,如何证明该离子是否存在? __________________
(4)请写出第④步中沉淀溶解的离子方程式________________________
①用pH试纸检验,溶液显强酸性;
②该溶液的焰色反应没有黄色;
③取溶液适量加入少量CCl4和数滴新制氯水振荡,CCl4层呈紫红色;
④当向该溶液中加入某浓度的NaOH溶液时,生成沉淀的物质的量变化如图

(1)该溶液中肯定含有的离子是
(2)肯定不含的离子是
(3)不能确定的离子是
(4)请写出第④步中沉淀溶解的离子方程式
您最近一年使用:0次
名校
解题方法
5 . 三硝酸甘油酯[C3H5(ONO2)3]是一种炸药,可因撞击而爆炸,同时产生高温。爆炸按下式进行:4C3H5(ONO2)3→wN2+xCO2+yH2O+zO2(式中w,x,y,z为化学计量数)。科学实验证明:相同条件(温度、压力)下相同体积的不同气体所含分子数相等。当三硝酸甘油酯爆炸并恢复到常温时,所得气体的体积比为____ 。
您最近一年使用:0次
名校
解题方法
6 . 某同学欲验证碳与浓硫酸反应产物的性质。现已将装置如图连接,请回答下列问题。
(1)烧瓶中发生反应的化学反应方程式是___________ 。
(2)实验中两次使用到品红溶液,其目的不同。A的使用目的是_____ ,通过洗气瓶C中无现象和___ 的现象,证明反应有_______ (填化学式)生成。
(3)洗气瓶B中溶液颜色变浅,说明碳与浓硫酸反应的产物之一______ (填名称)具有______ 的性质。
(4)实验完成后,取出洗气瓶A中的无色溶液于试管中,加热,可观察到__________ 。
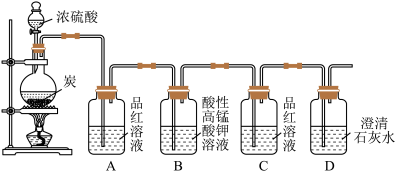
(1)烧瓶中发生反应的化学反应方程式是
(2)实验中两次使用到品红溶液,其目的不同。A的使用目的是
(3)洗气瓶B中溶液颜色变浅,说明碳与浓硫酸反应的产物之一
(4)实验完成后,取出洗气瓶A中的无色溶液于试管中,加热,可观察到
您最近一年使用:0次
2020-01-05更新
|
361次组卷
|
3卷引用:河北省唐山市丰润车轴山中学2019—2020学年高一上学期12月月考化学试题
7 . 甲、乙都是二元固体化合物,将32g的粉末加入足量浓硝酸并加热,完全溶解得蓝色溶液,向该溶液中加入足量 溶液,过滤、洗涤、干燥得沉淀
溶液,过滤、洗涤、干燥得沉淀 ;滤液中再滴加NaOH溶液,又出现蓝色沉淀。
;滤液中再滴加NaOH溶液,又出现蓝色沉淀。
含乙的矿石自然界中储量较多,称取一定量的乙,加入稀盐酸使其完全溶解,溶液分为A、B两等分,向A中加入足量NaOH溶液,过滤、洗涤、灼烧得到红棕色固体28g,经分析乙与红棕色固体组成元素相同,向B中加入 铜粉充分反应后过滤、洗涤、干燥得固体
铜粉充分反应后过滤、洗涤、干燥得固体 。
。
 写出构成甲的阴离子的结构示意图
写出构成甲的阴离子的结构示意图______ ,32g甲在足量浓硝酸中反应转移的电子数为______ 。
 乙的化学式
乙的化学式______ ;稀硫酸溶解乙的化学方程式______ 。
 将甲在足量氧气中充分灼烧的气体产物通入一定量A溶液中,该反应的离子方程式为
将甲在足量氧气中充分灼烧的气体产物通入一定量A溶液中,该反应的离子方程式为______ ,设计实验证明此步反应后的溶液中金属元素的化合价______ 。
 溶液,过滤、洗涤、干燥得沉淀
溶液,过滤、洗涤、干燥得沉淀 ;滤液中再滴加NaOH溶液,又出现蓝色沉淀。
;滤液中再滴加NaOH溶液,又出现蓝色沉淀。含乙的矿石自然界中储量较多,称取一定量的乙,加入稀盐酸使其完全溶解,溶液分为A、B两等分,向A中加入足量NaOH溶液,过滤、洗涤、灼烧得到红棕色固体28g,经分析乙与红棕色固体组成元素相同,向B中加入
 铜粉充分反应后过滤、洗涤、干燥得固体
铜粉充分反应后过滤、洗涤、干燥得固体 。
。 写出构成甲的阴离子的结构示意图
写出构成甲的阴离子的结构示意图 乙的化学式
乙的化学式 将甲在足量氧气中充分灼烧的气体产物通入一定量A溶液中,该反应的离子方程式为
将甲在足量氧气中充分灼烧的气体产物通入一定量A溶液中,该反应的离子方程式为
您最近一年使用:0次
2019-12-26更新
|
188次组卷
|
2卷引用:2019年秋高三化学复习强化练习——离子反应
8 . “84”消毒液是生活中常用的消毒剂,可与硫酸溶液反应制取氯气,反应原理为NaClO+NaCl+H2SO4 Na2SO4+Cl2↑+H2O。为探究氯气的性质,某同学利用此原理制氯气并设计了如图所示的实验装置。
Na2SO4+Cl2↑+H2O。为探究氯气的性质,某同学利用此原理制氯气并设计了如图所示的实验装置。
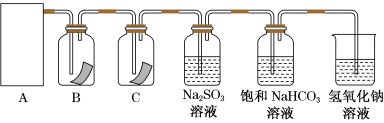
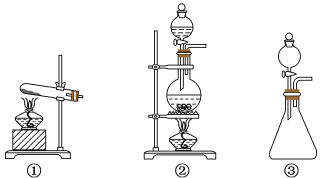
(1)从①、②、③装置中选择合适的制氯气装置(A处)____ (填标号)。
(2)装置B、C中依次放的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,其原因可能是___ ;说明该装置存在明显的缺陷,请提出合理的改进的方法_____ 。
(3)为了验证氯气的氧化性,将氯气通入Na2SO3溶液中,然后检验反应后溶液中是否含有SO42-,写出氯气与Na2SO3溶液反应的离子方程式:____ 。检验SO42-的方法是取少量反应后溶液于试管中,先加入足量的___ 至无明显现象,然后再加入少量___ 溶液,有白色沉淀生成,说明含有SO42-。
(4)氯气通入饱和NaHCO3溶液能产生无色气体,已知酸性:盐酸>碳酸>次氯酸,该实验证明氯气与水反应的生成物中含有____ (填“盐酸”或“次氯酸”)。
 Na2SO4+Cl2↑+H2O。为探究氯气的性质,某同学利用此原理制氯气并设计了如图所示的实验装置。
Na2SO4+Cl2↑+H2O。为探究氯气的性质,某同学利用此原理制氯气并设计了如图所示的实验装置。
(1)从①、②、③装置中选择合适的制氯气装置(A处)

(2)装置B、C中依次放的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,其原因可能是
(3)为了验证氯气的氧化性,将氯气通入Na2SO3溶液中,然后检验反应后溶液中是否含有SO42-,写出氯气与Na2SO3溶液反应的离子方程式:
(4)氯气通入饱和NaHCO3溶液能产生无色气体,已知酸性:盐酸>碳酸>次氯酸,该实验证明氯气与水反应的生成物中含有
您最近一年使用:0次
名校
9 . 按要求回答下列问题:
(1)已知拆开 键、
键、 键、
键、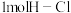 键分别需要吸收的能量为
键分别需要吸收的能量为 、
、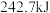 、
、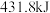 。则由
。则由 和
和 反应生成1molHCl需要
反应生成1molHCl需要_______  填“放出”或“吸收”
填“放出”或“吸收”
_________ 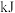 的热量。
的热量。
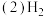 可以在
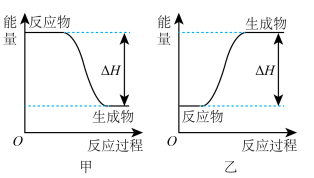
可以在 中安静地燃烧。甲、乙两图中,能表示该反应能量变化的是图
中安静地燃烧。甲、乙两图中,能表示该反应能量变化的是图_____  填“甲”或“乙”
填“甲”或“乙” 。
。
(3)将等物质的量的A和B,混合于2 L的密闭容器中,发生如下反应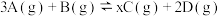 。2min后,测得D的浓度为
。2min后,测得D的浓度为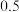 mol/L ,
mol/L ,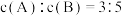 ,C的反应速率是
,C的反应速率是 mol/(L·min)。则:
mol/(L·min)。则:
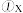 的值是
的值是__________ ;
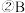 的平均反应速率是
的平均反应速率是____________ ;
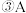 在2min末的浓度是
在2min末的浓度是________________ ;
④若此后各物质的量均不再变化,则证明此可逆反应达到了_______ 的程度。
A.反应彻底 反应终止
反应终止  化学平衡
化学平衡  无法判断
无法判断
(1)已知拆开
 键、
键、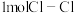 键、
键、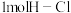 键分别需要吸收的能量为
键分别需要吸收的能量为 、
、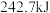 、
、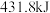 。则由
。则由 和
和 反应生成1molHCl需要
反应生成1molHCl需要 填“放出”或“吸收”
填“放出”或“吸收”
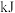 的热量。
的热量。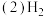 可以在
可以在 中安静地燃烧。甲、乙两图中,能表示该反应能量变化的是图
中安静地燃烧。甲、乙两图中,能表示该反应能量变化的是图 填“甲”或“乙”
填“甲”或“乙” 。
。
(3)将等物质的量的A和B,混合于2 L的密闭容器中,发生如下反应
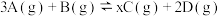 。2min后,测得D的浓度为
。2min后,测得D的浓度为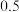 mol/L ,
mol/L ,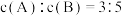 ,C的反应速率是
,C的反应速率是 mol/(L·min)。则:
mol/(L·min)。则: 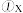 的值是
的值是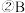 的平均反应速率是
的平均反应速率是 在2min末的浓度是
在2min末的浓度是④若此后各物质的量均不再变化,则证明此可逆反应达到了
A.反应彻底
 反应终止
反应终止  化学平衡
化学平衡  无法判断
无法判断
您最近一年使用:0次
2019-07-20更新
|
661次组卷
|
3卷引用:黑龙江省大庆中学2018-2019学年高一下学期期末考试化学试题
解题方法
10 . 某研究性学习小组对铝热反应实验展开研究。现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如下:
Ⅰ.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?________ (填“合理”或“不合理”)。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是________ ,反应的离子方程式为__________________________________________________ 。
(3)实验室溶解该熔融物,在下列试剂中最适宜的试剂是________ (填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4 mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
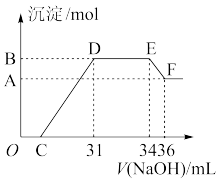
(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为_________________________ 。
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为___________ ;上述现象说明溶液中________ 结合OH-的能力比________ 强(填离子符号)。
(3)B与A的差值为________ mol。
(4)B点对应的沉淀的物质的量为________ mol,C点对应的氢氧化钠溶液的体积为________ mL。
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2 054 | 1 535 | 1 462 |
| 沸点/℃ | 2 467 | 2 980 | 2 750 | - |
Ⅰ.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是
(3)实验室溶解该熔融物,在下列试剂中最适宜的试剂是
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4 mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:

(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为
(3)B与A的差值为
(4)B点对应的沉淀的物质的量为
您最近一年使用:0次



