1 . 已知:常温下,部分弱电解质的电离平衡常数如下表所示,回答下列问题:
(1)常温下,物质的量浓度相等的下列溶液pH由大到小的顺序是_______ (填序号)。
① 溶液 ②
溶液 ② 溶液 ③
溶液 ③ 溶液 ④
溶液 ④ 溶液 ⑤
溶液 ⑤ 溶液
溶液
(2)常温下,将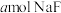 溶于水向该溶液中滴加
溶于水向该溶液中滴加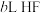 溶液后溶液呈中性,所滴加HF溶液的浓度为
溶液后溶液呈中性,所滴加HF溶液的浓度为_______  。
。
(3)下列离子方程式错误的是_______ (填序号)。
①向 溶液中加入过量
溶液中加入过量 溶液:
溶液:
②向 溶液中通入少量
溶液中通入少量 气体:
气体: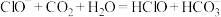
③向 溶液中通入过量
溶液中通入过量 气体:
气体: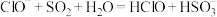
④向 溶液中加入少量
溶液中加入少量 溶液:
溶液:
(4)①下列能证明草酸为弱酸的实验是_______ (填标号)。
A.室温下,分别取等浓度 溶液和盐酸测 pH,
溶液和盐酸测 pH, 溶液 pH 大于盐酸
溶液 pH 大于盐酸
B.室温下,浓度为 c1的 溶液 pH=a,加入一定量的
溶液 pH=a,加入一定量的 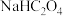 溶液,测得pH>a
溶液,测得pH>a
C.室温下,取pH=a(a<3)的 溶液稀释 100 倍后,测其pH<a +2
溶液稀释 100 倍后,测其pH<a +2
D.标准状况下,取0.10mol/L的 溶液100mL 与足量锌粉反应,收集到H2体积为224mL
溶液100mL 与足量锌粉反应,收集到H2体积为224mL
②用0.02000 mol/L的NaOH溶液滴定某未知浓度的草酸,若选择甲基橙为指示剂,到达滴定终点时主要溶质的化学式为_______ 。当pH为3时,溶液中
_______ 。
 | HF |  |  |  | |
 | 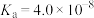 | 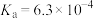 | 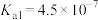 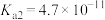 | 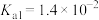 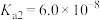 | 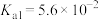 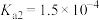 |
①
 溶液 ②
溶液 ② 溶液 ③
溶液 ③ 溶液 ④
溶液 ④ 溶液 ⑤
溶液 ⑤ 溶液
溶液(2)常温下,将
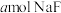 溶于水向该溶液中滴加
溶于水向该溶液中滴加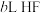 溶液后溶液呈中性,所滴加HF溶液的浓度为
溶液后溶液呈中性,所滴加HF溶液的浓度为 。
。(3)下列离子方程式错误的是
①向
 溶液中加入过量
溶液中加入过量 溶液:
溶液:
②向
 溶液中通入少量
溶液中通入少量 气体:
气体: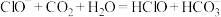
③向
 溶液中通入过量
溶液中通入过量 气体:
气体: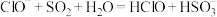
④向
 溶液中加入少量
溶液中加入少量 溶液:
溶液:
(4)①下列能证明草酸为弱酸的实验是
A.室温下,分别取等浓度
 溶液和盐酸测 pH,
溶液和盐酸测 pH, 溶液 pH 大于盐酸
溶液 pH 大于盐酸B.室温下,浓度为 c1的
 溶液 pH=a,加入一定量的
溶液 pH=a,加入一定量的 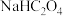 溶液,测得pH>a
溶液,测得pH>aC.室温下,取pH=a(a<3)的
 溶液稀释 100 倍后,测其pH<a +2
溶液稀释 100 倍后,测其pH<a +2D.标准状况下,取0.10mol/L的
 溶液100mL 与足量锌粉反应,收集到H2体积为224mL
溶液100mL 与足量锌粉反应,收集到H2体积为224mL②用0.02000 mol/L的NaOH溶液滴定某未知浓度的草酸,若选择甲基橙为指示剂,到达滴定终点时主要溶质的化学式为

您最近一年使用:0次
名校
解题方法
2 . 生活无处不化学,运用所学知识,回答下列问题。
(1)节日燃放的五彩缤纷的烟花,就是锂、钠、钾、锶、钡等金属化合物所呈现的各种艳丽色彩。 、
、 在无色火焰上灼烧时,其焰色
在无色火焰上灼烧时,其焰色___________ (填“相同”或“不相同”),该原理是___________ (填“物理”或“化学”)变化。
(2)电子工业用 溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出
溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出 溶液与铜反应的离子方程式:
溶液与铜反应的离子方程式:___________ 。
(3)高铁酸钠( )是一种新型的净水剂。其净水过程中发生的化学反应主要为
)是一种新型的净水剂。其净水过程中发生的化学反应主要为 ,证明有
,证明有 胶体生成的方法为:
胶体生成的方法为:___________ 。
(4)工业上常用绿矾( )做处理剂,处理废水中含有的重铬酸根离子(
)做处理剂,处理废水中含有的重铬酸根离子( ),反应的离子方程式如下:
),反应的离子方程式如下: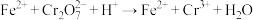 (未配平)。
(未配平)。
①在该反应中,氧化剂是___________ (填离子符号,下同),被氧化的是___________ 。
②该反应每消耗 离子,生成
离子,生成 的物质的量为
的物质的量为___________ mol,转移电子的物质的量为___________ mol。
(1)节日燃放的五彩缤纷的烟花,就是锂、钠、钾、锶、钡等金属化合物所呈现的各种艳丽色彩。
 、
、 在无色火焰上灼烧时,其焰色
在无色火焰上灼烧时,其焰色(2)电子工业用
 溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出
溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出 溶液与铜反应的离子方程式:
溶液与铜反应的离子方程式:(3)高铁酸钠(
 )是一种新型的净水剂。其净水过程中发生的化学反应主要为
)是一种新型的净水剂。其净水过程中发生的化学反应主要为 ,证明有
,证明有 胶体生成的方法为:
胶体生成的方法为:(4)工业上常用绿矾(
 )做处理剂,处理废水中含有的重铬酸根离子(
)做处理剂,处理废水中含有的重铬酸根离子( ),反应的离子方程式如下:
),反应的离子方程式如下: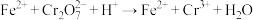 (未配平)。
(未配平)。①在该反应中,氧化剂是
②该反应每消耗
 离子,生成
离子,生成 的物质的量为
的物质的量为
您最近一年使用:0次
名校
解题方法
3 . 铝、氧化铝的性质与其他常见金属及氧化物相比,有一定的特殊性。
(1)可用NaOH溶液除去铁粉中的铝粉,反应原理是(用离子方程式表示)___________ ,将2.7gAl分别置于足量的NaOH溶液、稀硫酸中,生成H2的体积之比(同温同压)为___________ 。
(2)证明Al2O3是两性氧化物的常用试剂是___________ (填名称),将ag废铝片置于100mL盐酸中,测得反应过程中生成氢气体积(标准状况)与时间的关系如图所示:0~t1时间段无气体生成的原因是___________ ,若反应后所得溶液中n(Al3+)=0.102mol且盐酸恰好完全反应,则原溶液中c(HCl)=___________ 。
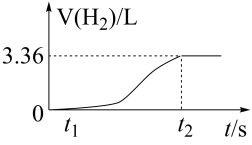
(1)可用NaOH溶液除去铁粉中的铝粉,反应原理是(用离子方程式表示)
(2)证明Al2O3是两性氧化物的常用试剂是

您最近一年使用:0次
2022-06-22更新
|
336次组卷
|
4卷引用:天津市第四十二中学2023-2024学年高一上学期第二次月考化学试题
名校
4 . 某兴趣小组在化学实验室找到了敞口放置较长时间的市售漂白粉,包装袋上标明其成分为CaCl2和Ca(ClO)2,有效成分含量为40%。已知Ca(ClO)2在空气中易变质为CaCO3,为探究漂白粉的变质情况,小组成员小昕用电子天平称取了1.887g的固体,向其中加入足量稀硝酸,把生成的气体全部通入:250mL 的澄清石灰水中使之充分反应,将所得沉淀过滤,洗涤,烘干之后,称量得到其质量为0.400g。小昕通过计算得出结论,此时的漂白粉中必定存在部分未变质的Ca(ClO)2。
的澄清石灰水中使之充分反应,将所得沉淀过滤,洗涤,烘干之后,称量得到其质量为0.400g。小昕通过计算得出结论,此时的漂白粉中必定存在部分未变质的Ca(ClO)2。
(1)你认为小昕的说法正确吗?___________ 。并说明理由___________ 。
(2)书写S原子的结构示意图:___________ 。
(3)乔同学和樊同学想用84消毒液杀死真菌,为了提高效果,乔同学向“84”中加入了洁厕灵(主要成分为HCl),结果导致两人双双中毒紧急送进医院,请写出相关方程式___________ 。
(4)在石灰窑中烧制生石灰,lmolCaCO3完全分解所需要的能量,可燃烧0.453mol碳来提供。设空气中O2体积分数为0.21,N2为0.79,则石灰窑产生的气体中CO2的体积分数最大值是___________ 。
(5)某固体仅由一种元素组成,其密度为: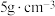 ,用X射线研究该固体的结果表明:在边长为
,用X射线研究该固体的结果表明:在边长为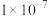 cm的立方体中含有20个原子,则此元素的相对原子质量约为
cm的立方体中含有20个原子,则此元素的相对原子质量约为___________ (取整数)。
 的澄清石灰水中使之充分反应,将所得沉淀过滤,洗涤,烘干之后,称量得到其质量为0.400g。小昕通过计算得出结论,此时的漂白粉中必定存在部分未变质的Ca(ClO)2。
的澄清石灰水中使之充分反应,将所得沉淀过滤,洗涤,烘干之后,称量得到其质量为0.400g。小昕通过计算得出结论,此时的漂白粉中必定存在部分未变质的Ca(ClO)2。(1)你认为小昕的说法正确吗?
(2)书写S原子的结构示意图:
(3)乔同学和樊同学想用84消毒液杀死真菌,为了提高效果,乔同学向“84”中加入了洁厕灵(主要成分为HCl),结果导致两人双双中毒紧急送进医院,请写出相关方程式
(4)在石灰窑中烧制生石灰,lmolCaCO3完全分解所需要的能量,可燃烧0.453mol碳来提供。设空气中O2体积分数为0.21,N2为0.79,则石灰窑产生的气体中CO2的体积分数最大值是
(5)某固体仅由一种元素组成,其密度为:
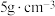 ,用X射线研究该固体的结果表明:在边长为
,用X射线研究该固体的结果表明:在边长为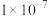 cm的立方体中含有20个原子,则此元素的相对原子质量约为
cm的立方体中含有20个原子,则此元素的相对原子质量约为
您最近一年使用:0次
名校
解题方法
5 . 已知:25℃时,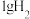 燃烧生成液态水放出142.9kJ的热量,
燃烧生成液态水放出142.9kJ的热量,
(1)写出表示 燃烧热的热化学反应方程式
燃烧热的热化学反应方程式___________ 。
(2)关于热化学方程式:
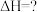 的说法正确的是
的说法正确的是
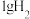 燃烧生成液态水放出142.9kJ的热量,
燃烧生成液态水放出142.9kJ的热量,(1)写出表示
 燃烧热的热化学反应方程式
燃烧热的热化学反应方程式(2)关于热化学方程式:

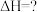 的说法正确的是
的说法正确的是| A.热化学方程式中化学计量数表示分子数 | B.该反应 大于零 大于零 |
C.该反应的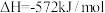 | D.该反应可表示36g水分解时的热效应 |
您最近一年使用:0次
名校
解题方法
6 . 物质的量是将微观粒子数与宏观可称量物理量联系起来的桥梁,极大地促进了化学学科的发展。
(1)下列关于气体说法正确的是_________。
(2)下列示意图中,白球代表氢原子,黑球代表氮原子;方框代表容器,容器中间有一个可以左右滑动的隔板。其中能表示等质量的氢气与氮气的是_________。
(3)现有 的硫酸500mL,则含有
的硫酸500mL,则含有 的物质的量为
的物质的量为___________ mol,其中氢离子的浓度为___________ 。取出100mL该溶液,需要___________ mol的NaOH才可将此100mL溶液完全反应。对于 的硫酸,若其密度为
的硫酸,若其密度为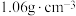 ,则其质量分数为
,则其质量分数为___________ (结果保留三位有效数字)。
(1)下列关于气体说法正确的是_________。
A.同温同压下,2g  的体积为22.4L 的体积为22.4L |
| B.同温同压下,气体物质的量越大,其体积也越大 |
C.标准状况下,18g  的体积为22.4L 的体积为22.4L |
D.标准状况下,1L HClI与1L  所含原子数不同 所含原子数不同 |
(2)下列示意图中,白球代表氢原子,黑球代表氮原子;方框代表容器,容器中间有一个可以左右滑动的隔板。其中能表示等质量的氢气与氮气的是_________。
A. | B.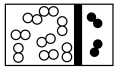 | C.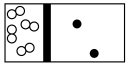 | D.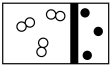 |
(3)现有
 的硫酸500mL,则含有
的硫酸500mL,则含有 的物质的量为
的物质的量为 的硫酸,若其密度为
的硫酸,若其密度为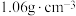 ,则其质量分数为
,则其质量分数为
您最近一年使用:0次
名校
7 . CH3OH是一种重要的化工原料,广泛应用于化工生产,根据所学回答下列问题:
(1)工业上制备甲醇的反应方程式为: ,某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:
,某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:
①写出该反应体系中CO2的电子式___________ 。
②用H2表示前2h的平均反应速率v(H2)=___________ 。
③该温度下,CO2的平衡转化率为___________ 。
④在一定条件下,下列说法能说明该可逆反应达到平衡状态的是___________ (填字母)。
A.容器中气体密度不变 B.容器中气体平均摩尔质量不变
C. D.形成2molC=O键同时断裂3molH-H键
D.形成2molC=O键同时断裂3molH-H键
⑤在温度为T,压强为P的条件下,将CO2和H2按物质的量之比1∶3通入一恒压密闭容器中发生上述反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为
___________ (用含P的表达式表示,其中用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)CH3OH制备丙烯的反应为: ,速率常数k与反应温度T的关系遵循Arrhenius方程,已知Arrhenius方程为:
,速率常数k与反应温度T的关系遵循Arrhenius方程,已知Arrhenius方程为: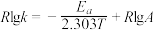 (其中k为速率常数,反应速率与其成正比;
(其中k为速率常数,反应速率与其成正比;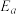 为活化能:
为活化能: ,A为常数)。
,A为常数)。

①在一定条件下,测得实验数据如上图曲线a所示。则该条件下,反应的活化能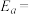
___________ 
②若实验时改变外界条件,测得实验数据为如上图曲线b所示,则可能改变的外界条件是___________ (填标号)
A.升高温度 B.增大压强 C.增大 D.更换适宜的催化剂
D.更换适宜的催化剂
(1)工业上制备甲醇的反应方程式为:
 ,某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:
,某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:| 时间/h | l | 2 | 3 | 4 | 5 | 6 |
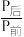 | 0.90 | 0.85 | 0.83 | 0.81 | 0.80 | 0.80 |
②用H2表示前2h的平均反应速率v(H2)=
③该温度下,CO2的平衡转化率为
④在一定条件下,下列说法能说明该可逆反应达到平衡状态的是
A.容器中气体密度不变 B.容器中气体平均摩尔质量不变
C.
 D.形成2molC=O键同时断裂3molH-H键
D.形成2molC=O键同时断裂3molH-H键⑤在温度为T,压强为P的条件下,将CO2和H2按物质的量之比1∶3通入一恒压密闭容器中发生上述反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为

(2)CH3OH制备丙烯的反应为:
 ,速率常数k与反应温度T的关系遵循Arrhenius方程,已知Arrhenius方程为:
,速率常数k与反应温度T的关系遵循Arrhenius方程,已知Arrhenius方程为: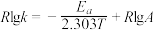 (其中k为速率常数,反应速率与其成正比;
(其中k为速率常数,反应速率与其成正比;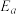 为活化能:
为活化能: ,A为常数)。
,A为常数)。
①在一定条件下,测得实验数据如上图曲线a所示。则该条件下,反应的活化能
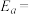

②若实验时改变外界条件,测得实验数据为如上图曲线b所示,则可能改变的外界条件是
A.升高温度 B.增大压强 C.增大
 D.更换适宜的催化剂
D.更换适宜的催化剂
您最近一年使用:0次
2023-06-30更新
|
475次组卷
|
2卷引用:重庆市西南大学附属中学2022-2023学年高一下学期期末考试化学试题
名校
8 . 某小组设计如下实验研究实验室中的甲酸。已知:25℃时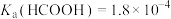
(1)配制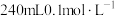 的HCOOH溶液,需
的HCOOH溶液,需 的HCOOH溶液的体积为
的HCOOH溶液的体积为_______ mL。
(2)为确定甲酸溶液的准确浓度,取20mL甲酸溶液于锥形瓶中,加入2滴_______ 溶液,用 的NaOH溶液滴定至终点,消耗NaOH溶液的体积为22.04mL,滴定实验中所使用的锥形瓶的容积最恰当的是
的NaOH溶液滴定至终点,消耗NaOH溶液的体积为22.04mL,滴定实验中所使用的锥形瓶的容积最恰当的是_______ (填字母)。
A.50mL B.100mL C.200mL D.250mL
(3)下列关于滴定操作的说法正确的_______
(4)小组同学用_______ 测出25℃时该甲酸溶液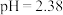 ,则水电离产生的
,则水电离产生的 数量级为
数量级为_______ 。
(5)25℃时甲酸与醋酸钠溶液反应: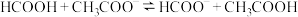 ,该反应的平衡常数为10,则该温度下醋酸的电离常数
,该反应的平衡常数为10,则该温度下醋酸的电离常数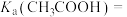
_______ 。
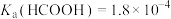
(1)配制
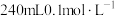 的HCOOH溶液,需
的HCOOH溶液,需 的HCOOH溶液的体积为
的HCOOH溶液的体积为(2)为确定甲酸溶液的准确浓度,取20mL甲酸溶液于锥形瓶中,加入2滴
 的NaOH溶液滴定至终点,消耗NaOH溶液的体积为22.04mL,滴定实验中所使用的锥形瓶的容积最恰当的是
的NaOH溶液滴定至终点,消耗NaOH溶液的体积为22.04mL,滴定实验中所使用的锥形瓶的容积最恰当的是A.50mL B.100mL C.200mL D.250mL
(3)下列关于滴定操作的说法正确的_______
| A.滴定前应检查滴定管是否漏水,进行洗涤、润洗 |
| B.将标准溶液装入滴定管时,应借助玻璃棒或漏斗等玻璃仪器转移 |
| C.进行滴定操作时,眼睛要始终注视着滴定管内液面的变化 |
| D.滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁 |
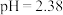 ,则水电离产生的
,则水电离产生的 数量级为
数量级为(5)25℃时甲酸与醋酸钠溶液反应:
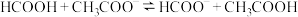 ,该反应的平衡常数为10,则该温度下醋酸的电离常数
,该反应的平衡常数为10,则该温度下醋酸的电离常数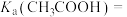
您最近一年使用:0次
2022-11-12更新
|
232次组卷
|
2卷引用:湖北省咸宁高级中学2023-2024学年高二上学期9月月考化学试题



