名校
解题方法
1 . 在恒温的2L密闭容器中进行反应,气体X、Y,Z的物质的量随时间的变化曲线如图所示,反应在t时刻达到平衡。

(1)该反应的化学方程式是___ 。
(2)反应起始至t时刻,Y的平均反应速率是___ 。
(3)关于该反应的说法正确的是___ 。
a. 到达t时刻该反应已停止
b. 在t时刻正反应速率等于逆反应速率
c. 混合气体的密度不再改变说明该反应达到平衡
d. 达到化学平衡时,3v正(X)=2v逆(Y)
(4)tmin后,体系内的压强与反应前的压强之比为:___ 。

(1)该反应的化学方程式是
(2)反应起始至t时刻,Y的平均反应速率是
(3)关于该反应的说法正确的是
a. 到达t时刻该反应已停止
b. 在t时刻正反应速率等于逆反应速率
c. 混合气体的密度不再改变说明该反应达到平衡
d. 达到化学平衡时,3v正(X)=2v逆(Y)
(4)tmin后,体系内的压强与反应前的压强之比为:
您最近一年使用:0次
2 . 如图表示一定温度下,在容积固定的密闭容器中,A、B、C三种气体的物质的量浓度随时间变化的情况。回答下列问题:

(1)该反应的化学方程式为_________ 。
(2)0~t1s内,B气体的平均反应速率为____ 。
(3)(t1+10)s时,A气体的转化率为__________ ,此时v正(A)_____ v逆(B)(填“>”“<”或“=")。
(4)下列关于该反应的说法正确的是__________ (填标号)。
a.t1时刻,该反应的正反应和逆反应均已停止
b.t1时刻之前,B气体的消耗速率大于它的生成速率
c.t1时刻,C气体的正反应速率等于它的逆反应速率
(5)容器中,(t1+10)s时的压强与起始时的压强之比为____

(1)该反应的化学方程式为
(2)0~t1s内,B气体的平均反应速率为
(3)(t1+10)s时,A气体的转化率为
(4)下列关于该反应的说法正确的是
a.t1时刻,该反应的正反应和逆反应均已停止
b.t1时刻之前,B气体的消耗速率大于它的生成速率
c.t1时刻,C气体的正反应速率等于它的逆反应速率
(5)容器中,(t1+10)s时的压强与起始时的压强之比为
您最近一年使用:0次
名校
解题方法
3 . 钠及其化合物有非常重要的用途。
(1)钠的化学性质非常活泼。画出钠的原子结构示意图________ 。
钠与水反应的实验过程如图①、②、③所示。
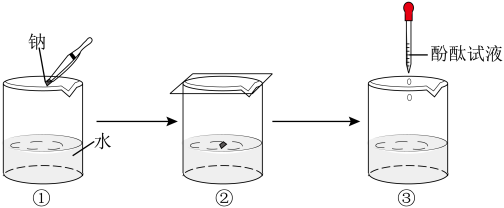
①将图②中的现象与解释用直线连接起来。_________
实验现象 解释
钠熔成小球 产生了气体
钠四处游动,嘶嘶作响 钠的密度比水小
钠浮在水面上 钠与水反应放热且钠的熔点低
②在③中酚酞变红,说明溶液呈_______ (填“酸”或“碱”或“中”)性。
③钠与水反应的化学方程式是_________ 。
(2)过氧化钠可在潜水艇中作为氧气的来源。写出过氧化钠与水反应的化学方程式___ ,与二氧化碳反应的化学方程式___ 。
(3)为探究Na2CO3和NaHCO3的热稳定性,某同学设计了如下实验:
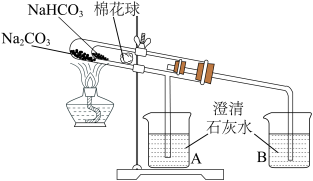
加热一段时间后,________ (填“A”或“B”)中澄清石灰水变浑浊,写出澄清石灰水变浑浊的离子方程式:________ 。写出试管中发生反应的化学方程式________ 。
(4)我国化学家侯德榜发明了联合制碱法,对世界制碱工业做出了巨大贡献。联合制碱法的主要过程如图所示(部分物质已略去)。含有氮元素、钾元素、磷元素的某些盐可以作为化肥。
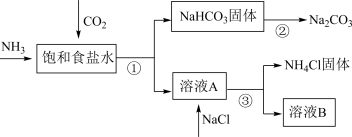
①联合制碱法所制得的“碱”是指_______ (填化学式)。
②在①-③所涉及的操作方法中,包含过滤的是_______ (填序号)。
③根据图,将化学方程式补充完整:NH3+CO2+___ +___ =NaHCO3↓+NH4Cl
④NaHCO3溶于水电离的方程式___ 。
⑤下列说法中,正确的是___ (填字母)
a.CO2可循环使用
b.副产物NH4Cl可用作肥料
c.溶液B中一定含有Na+、NH4+、Cl-
(1)钠的化学性质非常活泼。画出钠的原子结构示意图
钠与水反应的实验过程如图①、②、③所示。

①将图②中的现象与解释用直线连接起来。
实验现象 解释
钠熔成小球 产生了气体
钠四处游动,嘶嘶作响 钠的密度比水小
钠浮在水面上 钠与水反应放热且钠的熔点低
②在③中酚酞变红,说明溶液呈
③钠与水反应的化学方程式是
(2)过氧化钠可在潜水艇中作为氧气的来源。写出过氧化钠与水反应的化学方程式
(3)为探究Na2CO3和NaHCO3的热稳定性,某同学设计了如下实验:

加热一段时间后,
(4)我国化学家侯德榜发明了联合制碱法,对世界制碱工业做出了巨大贡献。联合制碱法的主要过程如图所示(部分物质已略去)。含有氮元素、钾元素、磷元素的某些盐可以作为化肥。

①联合制碱法所制得的“碱”是指
②在①-③所涉及的操作方法中,包含过滤的是
③根据图,将化学方程式补充完整:NH3+CO2+
④NaHCO3溶于水电离的方程式
⑤下列说法中,正确的是
a.CO2可循环使用
b.副产物NH4Cl可用作肥料
c.溶液B中一定含有Na+、NH4+、Cl-
您最近一年使用:0次
解题方法
4 . 人们认识最早的盐是食盐, 尚书
尚书 说命
说命 记载:“若作和羹,尔惟盐梅”,说明劳动人民在商代就已经知道用盐配制美味的羹汤。而现代化学定义的盐,具有更广范围和更深的涵义,探索它们的奥秘可以使我们更科学的利用它们。今对
记载:“若作和羹,尔惟盐梅”,说明劳动人民在商代就已经知道用盐配制美味的羹汤。而现代化学定义的盐,具有更广范围和更深的涵义,探索它们的奥秘可以使我们更科学的利用它们。今对 、
、 、
、 、
、 四种常见的盐进行探究。回答下列问题:
四种常见的盐进行探究。回答下列问题:
⑴已知 时,AgCl的溶度积为
时,AgCl的溶度积为 ,则AgCl在
,则AgCl在 溶液中的
溶液中的 为
为________  。
。
⑵ 时,
时,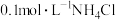 溶液的
溶液的 ,则关于该溶液中
,则关于该溶液中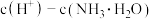 的说法正确的是
的说法正确的是________ 。
A.与m无关的定值 与m有关的定值
与m有关的定值 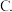 与
与 有关的不定值
有关的不定值
⑶ 时,将
时,将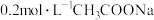 溶液和
溶液和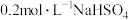 溶液各
溶液各 混合,此时混合溶液的
混合,此时混合溶液的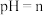 ,则
,则 的电离平衡常数
的电离平衡常数
________  用含n的表达式表示
用含n的表达式表示 。
。
⑷将 、生石灰和水按一定比例混合可得杀菌剂波尔多液,其有效成分为难溶的碱式硫酸铜
、生石灰和水按一定比例混合可得杀菌剂波尔多液,其有效成分为难溶的碱式硫酸铜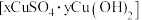 ,为测定其中x与y的比值,进行了如下实验:取等质量的碱式硫酸铜样品两份,一份滴加稀硫酸至恰好完全溶解,消耗的硫酸为
,为测定其中x与y的比值,进行了如下实验:取等质量的碱式硫酸铜样品两份,一份滴加稀硫酸至恰好完全溶解,消耗的硫酸为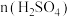 ,另一份高温灼烧后只得到
,另一份高温灼烧后只得到 固体。所得数据显示
固体。所得数据显示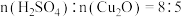 ,则该碱式硫酸铜的化学式中
,则该碱式硫酸铜的化学式中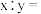
________ 。
⑸ 时,向
时,向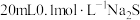 溶液中逐滴加入
溶液中逐滴加入 的盐酸
的盐酸 ,溶液的pH逐渐降低,此时溶液中含硫元素的微粒物质的量浓度的百分含量
,溶液的pH逐渐降低,此时溶液中含硫元素的微粒物质的量浓度的百分含量 纵轴
纵轴 也发生变化,如图所示:
也发生变化,如图所示:
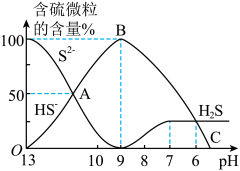
 反应到A点时,溶液中的离子浓度大小的关系为
反应到A点时,溶液中的离子浓度大小的关系为________ 。
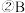 点对应的溶液中大量存在的溶质是
点对应的溶液中大量存在的溶质是________ 。
 混合溶液的
混合溶液的
________ 时,溶液中开始有 气体放出。
气体放出。
 尚书
尚书 说命
说命 记载:“若作和羹,尔惟盐梅”,说明劳动人民在商代就已经知道用盐配制美味的羹汤。而现代化学定义的盐,具有更广范围和更深的涵义,探索它们的奥秘可以使我们更科学的利用它们。今对
记载:“若作和羹,尔惟盐梅”,说明劳动人民在商代就已经知道用盐配制美味的羹汤。而现代化学定义的盐,具有更广范围和更深的涵义,探索它们的奥秘可以使我们更科学的利用它们。今对 、
、 、
、 、
、 四种常见的盐进行探究。回答下列问题:
四种常见的盐进行探究。回答下列问题:⑴已知
 时,AgCl的溶度积为
时,AgCl的溶度积为 ,则AgCl在
,则AgCl在 溶液中的
溶液中的 为
为 。
。⑵
 时,
时,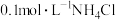 溶液的
溶液的 ,则关于该溶液中
,则关于该溶液中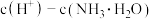 的说法正确的是
的说法正确的是A.与m无关的定值
 与m有关的定值
与m有关的定值 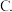 与
与 有关的不定值
有关的不定值⑶
 时,将
时,将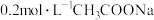 溶液和
溶液和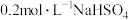 溶液各
溶液各 混合,此时混合溶液的
混合,此时混合溶液的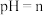 ,则
,则 的电离平衡常数
的电离平衡常数
 用含n的表达式表示
用含n的表达式表示 。
。⑷将
 、生石灰和水按一定比例混合可得杀菌剂波尔多液,其有效成分为难溶的碱式硫酸铜
、生石灰和水按一定比例混合可得杀菌剂波尔多液,其有效成分为难溶的碱式硫酸铜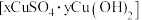 ,为测定其中x与y的比值,进行了如下实验:取等质量的碱式硫酸铜样品两份,一份滴加稀硫酸至恰好完全溶解,消耗的硫酸为
,为测定其中x与y的比值,进行了如下实验:取等质量的碱式硫酸铜样品两份,一份滴加稀硫酸至恰好完全溶解,消耗的硫酸为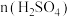 ,另一份高温灼烧后只得到
,另一份高温灼烧后只得到 固体。所得数据显示
固体。所得数据显示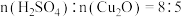 ,则该碱式硫酸铜的化学式中
,则该碱式硫酸铜的化学式中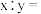
⑸
 时,向
时,向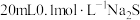 溶液中逐滴加入
溶液中逐滴加入 的盐酸
的盐酸 ,溶液的pH逐渐降低,此时溶液中含硫元素的微粒物质的量浓度的百分含量
,溶液的pH逐渐降低,此时溶液中含硫元素的微粒物质的量浓度的百分含量 纵轴
纵轴 也发生变化,如图所示:
也发生变化,如图所示:
 反应到A点时,溶液中的离子浓度大小的关系为
反应到A点时,溶液中的离子浓度大小的关系为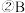 点对应的溶液中大量存在的溶质是
点对应的溶液中大量存在的溶质是 混合溶液的
混合溶液的
 气体放出。
气体放出。
您最近一年使用:0次
5 . 有一镁铝合金共51 g,把其加入到1 L 5 mol·L-1的盐酸中,恰好反应完。
(1)关于合金的下列说法正确的有________ 。
A.合金只能由两种或两种以上的金属组成
B.合金的硬度一般比其组成成分金属的硬度大
C.镁铝熔成合金的过程是一个化学过程
D.合金的熔点一般比其组成成分的熔点低
E.合金具备金属的特性
(2) 该合金中镁铝的质量分别为________ g、________ g。
(3) 反应中共收集到标况下的氢气的体积为___________ L。
(4)向反应后的溶液中逐滴加入5 mol·L-1的NaOH溶液,若要使沉淀恰好达到最大值,需要加入NaOH________ L。
(1)关于合金的下列说法正确的有
A.合金只能由两种或两种以上的金属组成
B.合金的硬度一般比其组成成分金属的硬度大
C.镁铝熔成合金的过程是一个化学过程
D.合金的熔点一般比其组成成分的熔点低
E.合金具备金属的特性
(2) 该合金中镁铝的质量分别为
(3) 反应中共收集到标况下的氢气的体积为
(4)向反应后的溶液中逐滴加入5 mol·L-1的NaOH溶液,若要使沉淀恰好达到最大值,需要加入NaOH
您最近一年使用:0次
6 . Ⅰ.某温度下,纯水中的c(H+)=2.0×10-7mol·L-1,则此时溶液的c(OH-)=____ mol·L-1,这种水显____ (填“酸”“碱”或“中”)性;若温度不变,滴入稀盐酸使c(H+)=5.0×10-6 mol·L-1,则c(OH-)=__ mol·L-1。
Ⅱ. (1)在2mL 0.1mol·L-1的NaCl溶液中,加入2mL 0.1mol·L-1的AgNO3溶液,可观察到____ ,此反应的离子方程式为______________ 。 将此混合液过滤,滤渣加入2mL 0.1mol·L-1的KI溶液,搅拌,可观察到_______________ , 反应的离子方程式为____________ 。
(2)下列说法不正确的是___ 。
A.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小
B.所有物质的溶解都是吸热的
C. 沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全
D.除去溶液中的Mg2+,用OH-沉淀Mg2+比 用效果好,说明 Mg(OH)2的溶解度比MgCO3大
用效果好,说明 Mg(OH)2的溶解度比MgCO3大
Ⅲ. 25 ℃,两种常见酸的电离常数如下表所示。
(1)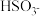 的电离常数表达式 K =
的电离常数表达式 K =_____________ 。
(2)H2SO3溶液和NaHCO3溶液反应的主要离子方程式为______________ 。
Ⅱ. (1)在2mL 0.1mol·L-1的NaCl溶液中,加入2mL 0.1mol·L-1的AgNO3溶液,可观察到
(2)下列说法不正确的是
A.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小
B.所有物质的溶解都是吸热的
C. 沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全
D.除去溶液中的Mg2+,用OH-沉淀Mg2+比
 用效果好,说明 Mg(OH)2的溶解度比MgCO3大
用效果好,说明 Mg(OH)2的溶解度比MgCO3大Ⅲ. 25 ℃,两种常见酸的电离常数如下表所示。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
(1)
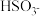 的电离常数表达式 K =
的电离常数表达式 K =(2)H2SO3溶液和NaHCO3溶液反应的主要离子方程式为
您最近一年使用:0次
7 . t℃时,将3mol A和2mol B气体通入体积为2L的密闭容器中(容积不变),发生反应:3A(g) + xB(g) C(g),4min时反应达到平衡状态(温度不变),剩余0.4 mol B,并测得C的浓度为0.4mol/L。请填写下列空白:
C(g),4min时反应达到平衡状态(温度不变),剩余0.4 mol B,并测得C的浓度为0.4mol/L。请填写下列空白:
(1)x=_________ 。
(2)用A表示该反应的速率为____________________ mol/(L·min)。
(3)若继续向平衡混合物的容器中通入少量氦气(氦气和A、B、C都不反应)后,下列说法中正确的是______________________ (填写下列选项字母符号)。
A.化学平衡向正反应方向移动
B.化学平衡向逆反应方向移动
C.化学平衡不会发生移动
D.正、逆反应的化学反应速率将发生同等程度的改变
 C(g),4min时反应达到平衡状态(温度不变),剩余0.4 mol B,并测得C的浓度为0.4mol/L。请填写下列空白:
C(g),4min时反应达到平衡状态(温度不变),剩余0.4 mol B,并测得C的浓度为0.4mol/L。请填写下列空白:(1)x=
(2)用A表示该反应的速率为
(3)若继续向平衡混合物的容器中通入少量氦气(氦气和A、B、C都不反应)后,下列说法中正确的是
A.化学平衡向正反应方向移动
B.化学平衡向逆反应方向移动
C.化学平衡不会发生移动
D.正、逆反应的化学反应速率将发生同等程度的改变
您最近一年使用:0次
名校
8 . 某温度下,在2L容器中3种物质间进行反应, X、Y、Z的物质的量随时间的变化曲线如图。反应在 t1min 时到达平衡,如图所示:

⑴①该反应的化学方程式是____________ 。
②该反应的平衡常数是___________ 。
③ 在t1min时,该反应达到了__________ 状态,下列可作为判断反应已达到该状态的是________ (填序号)。
A.X、Y、Z的反应速率相等 B.X、Y的物质的量浓度不再改变
C.生成 3mol Y 的同时生成 1mol Z D.生成 1mol Z 的同时生成 2mol X
⑵ ①若上述反应中X、Y、Z分别为 NH3 、H2 、N2 ,且已知1mol氨气分解成氮气和氢气要吸收46 kJ的热量,则由H2、N2 合成NH3 反应的热化学反应方程式为:____________________ 。
②甲、乙两位同学讨论放热反应和吸热反应:甲说加热后才能发生的化学反应是吸热反应;乙说反应中要持续加热才能进行的反应是吸热反应。你认为他们说法正确的是__________ 同学。

⑴①该反应的化学方程式是
②该反应的平衡常数是
③ 在t1min时,该反应达到了
A.X、Y、Z的反应速率相等 B.X、Y的物质的量浓度不再改变
C.生成 3mol Y 的同时生成 1mol Z D.生成 1mol Z 的同时生成 2mol X
⑵ ①若上述反应中X、Y、Z分别为 NH3 、H2 、N2 ,且已知1mol氨气分解成氮气和氢气要吸收46 kJ的热量,则由H2、N2 合成NH3 反应的热化学反应方程式为:
②甲、乙两位同学讨论放热反应和吸热反应:甲说加热后才能发生的化学反应是吸热反应;乙说反应中要持续加热才能进行的反应是吸热反应。你认为他们说法正确的是
您最近一年使用:0次
2018-09-26更新
|
154次组卷
|
2卷引用:【全国百强校】西藏自治区拉萨中学2018-2019学年高二第一次月考化学试题
名校
9 . 在2 L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图。反应在t时刻达到平衡,依图所示:
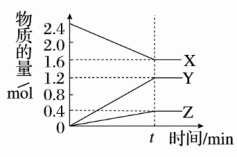
(1)该反应的化学方程式是________________________________________________ 。
(2)反应起始至t,Y的平均反应速率是____________ 。
(3)X的转化率是________ 。
(4)关于该反应的说法正确的是________ 。
A.到达t时刻该反应已停止
B.在t时刻之前X的消耗速率大于它的生成速率
C.在t时刻正反应速率等于逆反应速率
D.在t时刻达到平衡是因为此时反应物总物质的量与生成物总物质的量相等
(5)将10 mol A和5 mol B放入容积为10 L的密闭容器中,某温度下发生反应:3A(g)+B(g) 2C(g),在最初2 s内,消耗A的平均速率为0.06 mol·L-1·s-1,则在2 s时,容器中有
2C(g),在最初2 s内,消耗A的平均速率为0.06 mol·L-1·s-1,则在2 s时,容器中有________ mol A,此时C的物质的量浓度为________________ 。

(1)该反应的化学方程式是
(2)反应起始至t,Y的平均反应速率是
(3)X的转化率是
(4)关于该反应的说法正确的是
A.到达t时刻该反应已停止
B.在t时刻之前X的消耗速率大于它的生成速率
C.在t时刻正反应速率等于逆反应速率
D.在t时刻达到平衡是因为此时反应物总物质的量与生成物总物质的量相等
(5)将10 mol A和5 mol B放入容积为10 L的密闭容器中,某温度下发生反应:3A(g)+B(g)
 2C(g),在最初2 s内,消耗A的平均速率为0.06 mol·L-1·s-1,则在2 s时,容器中有
2C(g),在最初2 s内,消耗A的平均速率为0.06 mol·L-1·s-1,则在2 s时,容器中有
您最近一年使用:0次
10 . (1)可逆反应:N2O4⇌2NO2,在体积不变的密闭容器中反应,下列说法中可判断该反应达到平衡状态的是____________ (选填序号)
①单位时间内生成2n molNO2的同时生成n mol N2O4
②单位时间内消耗n mol N2O4的同时生成2n mol NO2
③容器中的压强不再改变的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
(2)373k时把0.12 mol无色的N2O4气体通入体积500 mL的密闭容器中,发生反应:N2O4⇌2NO2,容器中立即出现红棕色。反应进行到2s时,测得生成NO2的物质的量为0.01 mol;反应进行到60 s时达到平衡,此时容器内N2O4与NO2的物质的量相等。请计算:(本小题要求写出解过程)
①开始2 s内以N2O4表示的化学反应速率_________ ;
②达到平衡时体系的压强与开始时体系的压强之比_________ ;
③达到平衡时,体系中NO2的物质的量浓度_________ ;
④N2O4的平衡转化率_________ 。
①单位时间内生成2n molNO2的同时生成n mol N2O4
②单位时间内消耗n mol N2O4的同时生成2n mol NO2
③容器中的压强不再改变的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
(2)373k时把0.12 mol无色的N2O4气体通入体积500 mL的密闭容器中,发生反应:N2O4⇌2NO2,容器中立即出现红棕色。反应进行到2s时,测得生成NO2的物质的量为0.01 mol;反应进行到60 s时达到平衡,此时容器内N2O4与NO2的物质的量相等。请计算:(本小题要求写出解过程)
①开始2 s内以N2O4表示的化学反应速率
②达到平衡时体系的压强与开始时体系的压强之比
③达到平衡时,体系中NO2的物质的量浓度
④N2O4的平衡转化率
您最近一年使用:0次
2017-05-03更新
|
637次组卷
|
3卷引用:江苏省宿迁市名校2016-2017学年高一下学期期中考试化学试题



