名校
1 . Ⅰ.某温度(t℃)时,水的Kw=10-13,则该温度(填 “大于”“小于”或“等于”)______ 25℃,理由是_________ ,将此温度下pH =11的NaOH溶液aL与pH=1的H2SO4溶液bL混合,
(1)若所得混合液为中性,则a∶b=_________ ;
(2)若所得混合液的pH=2,则a∶b=_________ 。
Ⅱ.25℃时,0.1mol·L-1的某一元酸HA在水中有0.1%发生电离,下列说法不正确的是___________
A.该溶液pH=4 B.由HA电离出的c(H+)约为水电离出的c(H+)的106倍
C.此酸的电离平衡常数约为1×10-7 D.升高温度,溶液的pH增大
(1)若所得混合液为中性,则a∶b=
(2)若所得混合液的pH=2,则a∶b=
Ⅱ.25℃时,0.1mol·L-1的某一元酸HA在水中有0.1%发生电离,下列说法不正确的是
A.该溶液pH=4 B.由HA电离出的c(H+)约为水电离出的c(H+)的106倍
C.此酸的电离平衡常数约为1×10-7 D.升高温度,溶液的pH增大
您最近一年使用:0次
2017-10-24更新
|
683次组卷
|
3卷引用:河南省中原名校(即豫南九校)2017-2018学年高二上学期第一次联考化学试题
9-10高二下·福建龙岩·期末
解题方法
2 .
(1)在25℃、101KPa时,1g甲醇完全燃烧生成CO2和液态水时放热22.68kJ,则能表示甲醇燃烧的热化学方程式为:_______________________ 。
(2)已知:C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)=CO2(g); △H=-394kJ/mol;
2CO(g)+O2(g)=2CO2(g); △H=-566kJ/mol;
2H2(g)+O2(g)=2H2O(g); △H=-484 kJ/mol;
①在25℃、101kPa时,1 g甲醇不完全燃烧生成1∶1的CO、CO2和液态水,写出此甲醇燃烧的热化学方程式:___________________________________ 。
②工业上可由CO和H2合成甲醇。试写出由C(s)与水蒸气在高温条件下反应生成氢气和一氧化碳的热化学方程式_______________________ 。
(3)利用甲醇可设计燃料电池。
①如用氢氧化钾溶液做电解质溶液,用多孔石墨做电极,在电极上分别充入甲醇和氧气。写出负极的电极反应式___________________ 。
②下列有关甲醇燃料电池的说法中,错误的是_________ 。
A.甲醇燃料电池的负极发生氧化反应
B.甲醇燃料电池的电子由负极、经外电路流入正极
C.甲醇燃料电池在负极区产生CO
D.甲醇燃料电池中使用的氢氧化钾浓度保持不变
(1)在25℃、101KPa时,1g甲醇完全燃烧生成CO2和液态水时放热22.68kJ,则能表示甲醇燃烧的热化学方程式为:
(2)已知:C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)=CO2(g); △H=-394kJ/mol;
2CO(g)+O2(g)=2CO2(g); △H=-566kJ/mol;
2H2(g)+O2(g)=2H2O(g); △H=-484 kJ/mol;
①在25℃、101kPa时,1 g甲醇不完全燃烧生成1∶1的CO、CO2和液态水,写出此甲醇燃烧的热化学方程式:
②工业上可由CO和H2合成甲醇。试写出由C(s)与水蒸气在高温条件下反应生成氢气和一氧化碳的热化学方程式
(3)利用甲醇可设计燃料电池。
①如用氢氧化钾溶液做电解质溶液,用多孔石墨做电极,在电极上分别充入甲醇和氧气。写出负极的电极反应式
②下列有关甲醇燃料电池的说法中,错误的是
A.甲醇燃料电池的负极发生氧化反应
B.甲醇燃料电池的电子由负极、经外电路流入正极
C.甲醇燃料电池在负极区产生CO

D.甲醇燃料电池中使用的氢氧化钾浓度保持不变
您最近一年使用:0次
名校
3 . 在某一容积为2 L的密闭容器内,加入0.8 mol的H2和0.6 mol的I2,在一定的条件下发生如下反应:H2(g)+I2(g)  2HI(g)+9.4 kJ
2HI(g)+9.4 kJ
反应中各物质的浓度随时间变化情况如图1:
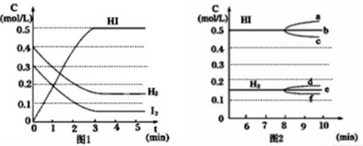
(1)在反应趋向平衡状态的过程中,下列说法正确的是_________ 。
A.HI的生产速率等于分解速率 B.HI的生产速率小于分解速率
C.HI的生产速率大于分解速率 D.无法判断HI的生产速率和分解速率的相对大小
(2)下列说法能说明该反应一定达到平衡的是__________ 。
A.混合气体的密度不再发生变化 B.混合气体的颜色不再发生变化
C.反应放出的热量恰好为9.4 kJ D.混合气体的压强不再发生变化
(3)根据图1数据,反应开始至达到平衡(第3 min)时,平衡速率v(HI)为____________ (用小数表示)。
(4)反应达到平衡后,第8分钟时:
①若升高温度,HI浓度的变化正确的是_________ ;
②若加入I2,H2浓度的变化正确的是____________ 。(用图2中相应编号回答)
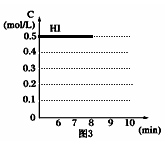
(5)反应达到平衡后,第8分钟时,若把容器的容积扩大一倍,请在图3中画出8分钟后HI浓度的变化情况。________
 2HI(g)+9.4 kJ
2HI(g)+9.4 kJ反应中各物质的浓度随时间变化情况如图1:


(1)在反应趋向平衡状态的过程中,下列说法正确的是
A.HI的生产速率等于分解速率 B.HI的生产速率小于分解速率
C.HI的生产速率大于分解速率 D.无法判断HI的生产速率和分解速率的相对大小
(2)下列说法能说明该反应一定达到平衡的是
A.混合气体的密度不再发生变化 B.混合气体的颜色不再发生变化
C.反应放出的热量恰好为9.4 kJ D.混合气体的压强不再发生变化
(3)根据图1数据,反应开始至达到平衡(第3 min)时,平衡速率v(HI)为
(4)反应达到平衡后,第8分钟时:
①若升高温度,HI浓度的变化正确的是
②若加入I2,H2浓度的变化正确的是
(5)反应达到平衡后,第8分钟时,若把容器的容积扩大一倍,请在图3中画出8分钟后HI浓度的变化情况。
您最近一年使用:0次
4 . (1)可逆反应:N2O4⇌2NO2,在体积不变的密闭容器中反应,下列说法中可判断该反应达到平衡状态的是____________ (选填序号)
①单位时间内生成2n molNO2的同时生成n mol N2O4
②单位时间内消耗n mol N2O4的同时生成2n mol NO2
③容器中的压强不再改变的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
(2)373k时把0.12 mol无色的N2O4气体通入体积500 mL的密闭容器中,发生反应:N2O4⇌2NO2,容器中立即出现红棕色。反应进行到2s时,测得生成NO2的物质的量为0.01 mol;反应进行到60 s时达到平衡,此时容器内N2O4与NO2的物质的量相等。请计算:(本小题要求写出解过程)
①开始2 s内以N2O4表示的化学反应速率_________ ;
②达到平衡时体系的压强与开始时体系的压强之比_________ ;
③达到平衡时,体系中NO2的物质的量浓度_________ ;
④N2O4的平衡转化率_________ 。
①单位时间内生成2n molNO2的同时生成n mol N2O4
②单位时间内消耗n mol N2O4的同时生成2n mol NO2
③容器中的压强不再改变的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
(2)373k时把0.12 mol无色的N2O4气体通入体积500 mL的密闭容器中,发生反应:N2O4⇌2NO2,容器中立即出现红棕色。反应进行到2s时,测得生成NO2的物质的量为0.01 mol;反应进行到60 s时达到平衡,此时容器内N2O4与NO2的物质的量相等。请计算:(本小题要求写出解过程)
①开始2 s内以N2O4表示的化学反应速率
②达到平衡时体系的压强与开始时体系的压强之比
③达到平衡时,体系中NO2的物质的量浓度
④N2O4的平衡转化率
您最近一年使用:0次
2017-05-03更新
|
637次组卷
|
3卷引用:江苏省宿迁市名校2016-2017学年高一下学期期中考试化学试题
11-12高一上·浙江宁波·期中
5 . 某兴趣小组同学取用80.00 g的MgCl2溶液(含镁元素质量分数为15.00%),将其小心蒸干得49.25 g固体(其成分表示为Mgx(OH)yClz•nH2O),为研究其组成进行了如下两实验:
实验一:将所得固体全部溶于100 mL 1.50 mol·L-1的硝酸中,再加水稀释至500 mL,测得溶液的c(H+)=0.1mol·L-1;
实验二:取实验一稀释后的溶液50 mL向其中加入足量的AgNO3溶液得沉淀12.915 g。
①对于上述两个实验的安排,说法正确的是 ;(填字母序号)
A.均要做,否则无法计算 B.均不要做,数据已经足够 C.只要做实验一即可
②试通过计算确定固体的化学式。(要求有计算过程)
实验一:将所得固体全部溶于100 mL 1.50 mol·L-1的硝酸中,再加水稀释至500 mL,测得溶液的c(H+)=0.1mol·L-1;
实验二:取实验一稀释后的溶液50 mL向其中加入足量的AgNO3溶液得沉淀12.915 g。
①对于上述两个实验的安排,说法正确的是 ;(填字母序号)
A.均要做,否则无法计算 B.均不要做,数据已经足够 C.只要做实验一即可
②试通过计算确定固体的化学式。(要求有计算过程)
您最近一年使用:0次
9-10高二下·吉林·期末
6 . 为了比较温室效应气体对目前全球增温现象的影响, 科学家通常引用“温室效应指数”,以二氧化碳为相对标准。表1有(A)至(I)共九种气体在大气中的体积百分比及其温室效应指数。
结合表中列出的九种气体,试参与回答下列各题:
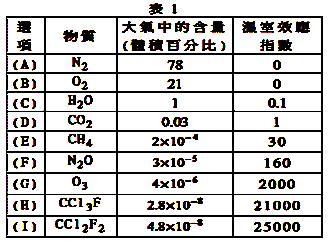
(1)下列由极性键形成的极性分子是____________ 。
A.N2B.O2C.H2O D.CO2 E.CH4
(2)下列说法不正确的是________ 。
A.N2O与CO2, CCl3F与CCl2F2互为等电子体
B.CCl2F2无同分异构体,说明其中碳原子采用sp3方式杂化
C.CH4是目前引起温室效应的主要原因
D.H2O沸点是九种物质中最高的,是因为水分子间能形成氢键
(3)在半导体生产或灭火剂的使用中,会向空气逸散气体如:NF3、CHClFCF3、C3F8,它们虽是微量的,有些确是强温室气体,下列推测不正确的是_____________ 。
A.由价层电子对互斥理论可确定NF3分子呈三角锥形
B.C3F8在CCl4中的溶解度比水中大
C.CHClFCF3存在手性异构
D.第一电离能:N<O<F
(4)甲烷晶体的晶胞结构如右图,下列有关说法正确的_______ 。
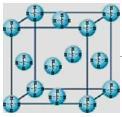
A.甲烷在常温下呈气态,说明甲烷晶体属于分子晶体
B.晶体中1个CH4分子有12个紧邻的甲烷分子
C.CH4晶体熔化时需克服共价键
D.可燃冰(8CH4·46H2O)是在低温高压下形成的晶体
(5)水能与多种过渡金属离子形成络合物,已知某红紫色络合物的组成为CoCl3·5NH3·H2O。其水溶液显弱酸性,加入强碱并加热至沸腾有氨放出,同时产生Co2O3沉淀;加AgNO3于该化合物溶液中,有AgCl沉淀生成,过滤后再加AgNO3溶液于滤液中无变化,但加热至沸腾有AgCl沉淀生成,且其质量为第一次沉淀量的二分之一。则该配合物的化学式最可能为_________________ 。
A.[ CoCl2(NH3)4]Cl·NH3·H2O B.[ Co(NH3)5(H2O)]Cl3
C.[ CoCl2(NH3)3(H2O)]Cl·2NH3 D.[ CoCl(NH3)5]Cl2·H2O
(6)题(5)中钴离子在基态时核外电子排布式为:___________________________ 。
结合表中列出的九种气体,试参与回答下列各题:

(1)下列由极性键形成的极性分子是
A.N2B.O2C.H2O D.CO2 E.CH4
(2)下列说法不正确的是
A.N2O与CO2, CCl3F与CCl2F2互为等电子体
B.CCl2F2无同分异构体,说明其中碳原子采用sp3方式杂化
C.CH4是目前引起温室效应的主要原因
D.H2O沸点是九种物质中最高的,是因为水分子间能形成氢键
(3)在半导体生产或灭火剂的使用中,会向空气逸散气体如:NF3、CHClFCF3、C3F8,它们虽是微量的,有些确是强温室气体,下列推测不正确的是
A.由价层电子对互斥理论可确定NF3分子呈三角锥形
B.C3F8在CCl4中的溶解度比水中大
C.CHClFCF3存在手性异构
D.第一电离能:N<O<F
(4)甲烷晶体的晶胞结构如右图,下列有关说法正确的

A.甲烷在常温下呈气态,说明甲烷晶体属于分子晶体
B.晶体中1个CH4分子有12个紧邻的甲烷分子
C.CH4晶体熔化时需克服共价键
D.可燃冰(8CH4·46H2O)是在低温高压下形成的晶体
(5)水能与多种过渡金属离子形成络合物,已知某红紫色络合物的组成为CoCl3·5NH3·H2O。其水溶液显弱酸性,加入强碱并加热至沸腾有氨放出,同时产生Co2O3沉淀;加AgNO3于该化合物溶液中,有AgCl沉淀生成,过滤后再加AgNO3溶液于滤液中无变化,但加热至沸腾有AgCl沉淀生成,且其质量为第一次沉淀量的二分之一。则该配合物的化学式最可能为
A.[ CoCl2(NH3)4]Cl·NH3·H2O B.[ Co(NH3)5(H2O)]Cl3
C.[ CoCl2(NH3)3(H2O)]Cl·2NH3 D.[ CoCl(NH3)5]Cl2·H2O
(6)题(5)中钴离子在基态时核外电子排布式为:
您最近一年使用:0次



