2011高三·全国·竞赛
1 . NO2和N2O4混合气体的针管实验是高中化学的经典素材。理论估算和实测发现,混合气体体积由V压缩为V/2,温度由298K升至311K。已知这两个温度下N2O4(g) 2NO2(g)的压力平衡常数Kp分别为0.141和0.363。
2NO2(g)的压力平衡常数Kp分别为0.141和0.363。
(1)通过计算回答,混合气体经上述压缩后,NO2的浓度比压缩前增加了_______ 倍。
(2)动力学实验证明,上述混合气体几微秒内即可达成化学平衡。压缩后的混合气体在室温下放置,颜色如何变化?____________ 为什么?_______________
 2NO2(g)的压力平衡常数Kp分别为0.141和0.363。
2NO2(g)的压力平衡常数Kp分别为0.141和0.363。(1)通过计算回答,混合气体经上述压缩后,NO2的浓度比压缩前增加了
(2)动力学实验证明,上述混合气体几微秒内即可达成化学平衡。压缩后的混合气体在室温下放置,颜色如何变化?
您最近一年使用:0次
10-11高一下·辽宁·阶段练习
名校
2 . 某元素最高价氧化物的化学式是RO2,已知其气态氢化物中含氢25%。
(1)计算R的相对原子质量_____ ;
(2)写出R最高价氧化物对应的水化物的化学式_____ ,并设计一个实验方案证明其酸性比盐酸弱_____ 。
(1)计算R的相对原子质量
(2)写出R最高价氧化物对应的水化物的化学式
您最近一年使用:0次
名校
解题方法
3 . 天然气的主要成分为 ,一般还含有
,一般还含有 、
、 等烃类,是重要的燃料和化工原料。
等烃类,是重要的燃料和化工原料。
(1)乙烷在一定条件可发生如下反应:
 ,相关物质的摩尔燃烧焓数据如表所示:
,相关物质的摩尔燃烧焓数据如表所示:
则
_____ 
(2)甲烷是常见的燃料, 加氢可制备甲烷,其反应为
加氢可制备甲烷,其反应为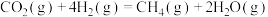
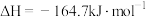 。
。
①
_____ 。
②对于 加氢制备甲烷的反应,有关说法错误的是
加氢制备甲烷的反应,有关说法错误的是_____ 。
A.该反应理论上可以设计成原电池
B.该反应过程中有旧键断裂吸收的能量大于新键形成释放的能量
C.反应结束,体系中物质的总能量降低
D.此反应可以变废为宝,有利于碳中和和碳达峰的实现
③已知:标准摩尔生成焓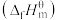 是指标况下,由元素最稳定的单质生成1mol纯净物时的反应焓变。298K时,几种气态物质标准摩尔生成焓如表:
是指标况下,由元素最稳定的单质生成1mol纯净物时的反应焓变。298K时,几种气态物质标准摩尔生成焓如表:
则
_____ 。
(3)丙烷燃烧可以通过以下两种途径:
途径I:
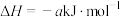
途径Ⅱ: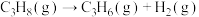
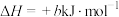

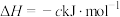
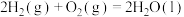
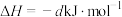 (a、b、c、d均为正值)
(a、b、c、d均为正值)
按途径Ⅱ反应,常温下,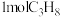 完全燃烧时放出的热量为
完全燃烧时放出的热量为_____ kJ(用含b、c、d的代数式表示);相同条件下,等量的丙烷通过两种途径完全燃烧时,途径I放出的热量_____ (填“大于”、“小于”或“等于”)途径Ⅱ放出的热量。
 ,一般还含有
,一般还含有 、
、 等烃类,是重要的燃料和化工原料。
等烃类,是重要的燃料和化工原料。(1)乙烷在一定条件可发生如下反应:

 ,相关物质的摩尔燃烧焓数据如表所示:
,相关物质的摩尔燃烧焓数据如表所示:| 物质 | 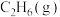 | 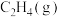 |  |
摩尔燃烧焓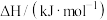 | -1560 | -1411 | -286 |


(2)甲烷是常见的燃料,
 加氢可制备甲烷,其反应为
加氢可制备甲烷,其反应为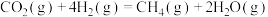
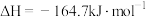 。
。| 物质 |  |  |  |  |
| 键能:1mol化学键断裂时需要吸收的能量/kJ | 436 | 465 | 413 | a |

②对于
 加氢制备甲烷的反应,有关说法错误的是
加氢制备甲烷的反应,有关说法错误的是A.该反应理论上可以设计成原电池
B.该反应过程中有旧键断裂吸收的能量大于新键形成释放的能量
C.反应结束,体系中物质的总能量降低
D.此反应可以变废为宝,有利于碳中和和碳达峰的实现
③已知:标准摩尔生成焓
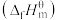 是指标况下,由元素最稳定的单质生成1mol纯净物时的反应焓变。298K时,几种气态物质标准摩尔生成焓如表:
是指标况下,由元素最稳定的单质生成1mol纯净物时的反应焓变。298K时,几种气态物质标准摩尔生成焓如表:| 物质 |  |  |  |  |
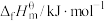 | -393.5 | -241.5 | x | 0 |

(3)丙烷燃烧可以通过以下两种途径:
途径I:

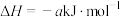
途径Ⅱ:
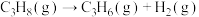
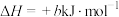

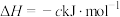
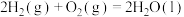
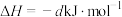 (a、b、c、d均为正值)
(a、b、c、d均为正值)按途径Ⅱ反应,常温下,
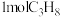 完全燃烧时放出的热量为
完全燃烧时放出的热量为
您最近一年使用:0次
名校
4 . 某兴趣小组在化学实验室找到了敞口放置较长时间的市售漂白粉,包装袋上标明其成分为CaCl2和Ca(ClO)2,有效成分含量为40%。已知Ca(ClO)2在空气中易变质为CaCO3,为探究漂白粉的变质情况,小组成员小昕用电子天平称取了1.887g的固体,向其中加入足量稀硝酸,把生成的气体全部通入:250mL 的澄清石灰水中使之充分反应,将所得沉淀过滤,洗涤,烘干之后,称量得到其质量为0.400g。小昕通过计算得出结论,此时的漂白粉中必定存在部分未变质的Ca(ClO)2。
的澄清石灰水中使之充分反应,将所得沉淀过滤,洗涤,烘干之后,称量得到其质量为0.400g。小昕通过计算得出结论,此时的漂白粉中必定存在部分未变质的Ca(ClO)2。
(1)你认为小昕的说法正确吗?___________ 。并说明理由___________ 。
(2)书写S原子的结构示意图:___________ 。
(3)乔同学和樊同学想用84消毒液杀死真菌,为了提高效果,乔同学向“84”中加入了洁厕灵(主要成分为HCl),结果导致两人双双中毒紧急送进医院,请写出相关方程式___________ 。
(4)在石灰窑中烧制生石灰,lmolCaCO3完全分解所需要的能量,可燃烧0.453mol碳来提供。设空气中O2体积分数为0.21,N2为0.79,则石灰窑产生的气体中CO2的体积分数最大值是___________ 。
(5)某固体仅由一种元素组成,其密度为: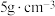 ,用X射线研究该固体的结果表明:在边长为
,用X射线研究该固体的结果表明:在边长为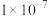 cm的立方体中含有20个原子,则此元素的相对原子质量约为
cm的立方体中含有20个原子,则此元素的相对原子质量约为___________ (取整数)。
 的澄清石灰水中使之充分反应,将所得沉淀过滤,洗涤,烘干之后,称量得到其质量为0.400g。小昕通过计算得出结论,此时的漂白粉中必定存在部分未变质的Ca(ClO)2。
的澄清石灰水中使之充分反应,将所得沉淀过滤,洗涤,烘干之后,称量得到其质量为0.400g。小昕通过计算得出结论,此时的漂白粉中必定存在部分未变质的Ca(ClO)2。(1)你认为小昕的说法正确吗?
(2)书写S原子的结构示意图:
(3)乔同学和樊同学想用84消毒液杀死真菌,为了提高效果,乔同学向“84”中加入了洁厕灵(主要成分为HCl),结果导致两人双双中毒紧急送进医院,请写出相关方程式
(4)在石灰窑中烧制生石灰,lmolCaCO3完全分解所需要的能量,可燃烧0.453mol碳来提供。设空气中O2体积分数为0.21,N2为0.79,则石灰窑产生的气体中CO2的体积分数最大值是
(5)某固体仅由一种元素组成,其密度为:
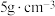 ,用X射线研究该固体的结果表明:在边长为
,用X射线研究该固体的结果表明:在边长为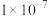 cm的立方体中含有20个原子,则此元素的相对原子质量约为
cm的立方体中含有20个原子,则此元素的相对原子质量约为
您最近一年使用:0次
名校
解题方法
5 . 已知:25℃时,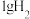 燃烧生成液态水放出142.9kJ的热量,
燃烧生成液态水放出142.9kJ的热量,
(1)写出表示 燃烧热的热化学反应方程式
燃烧热的热化学反应方程式___________ 。
(2)关于热化学方程式:
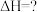 的说法正确的是
的说法正确的是
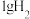 燃烧生成液态水放出142.9kJ的热量,
燃烧生成液态水放出142.9kJ的热量,(1)写出表示
 燃烧热的热化学反应方程式
燃烧热的热化学反应方程式(2)关于热化学方程式:

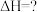 的说法正确的是
的说法正确的是| A.热化学方程式中化学计量数表示分子数 | B.该反应 大于零 大于零 |
C.该反应的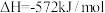 | D.该反应可表示36g水分解时的热效应 |
您最近一年使用:0次
名校
6 . “84消毒液”能有效杀灭甲型H1N1病毒,某同学购买了一瓶84消毒液,该消毒液通常稀释到100倍(体积比)使用。查阅相关资料和消毒液包装说明得到如图信息:
(1)该84消毒液NaClO物质的量浓度约为_______ (保留1位小数)。
(2)该同学参阅该84消毒液的配方,欲用NaClO固体配制480mL该种84消毒液。下列说法不正确的是_______ (填字母)。
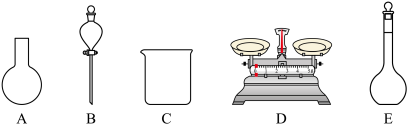
A.如图所示的仪器中,有三种是不需要的,还另需要一种玻璃仪器
B.使用前要检查容量瓶是否漏液
C.容量瓶上标有容积、温度和浓度
D.需要称量NaClO固体的质量为149.0g
E.容量瓶用蒸馏水洗净后,须烘干后再使用
(3)一瓶上述84消毒液理论上能吸收空气中_______ L的CO2(标准状况下)而变质。(已知:CO2+NaClO+H2O=NaHCO3+HClO)
(4)84消毒液与稀硫酸混合使用可增强消毒能力,请用化学方程式解释其原因_______ ,某消毒小组人员用18.4mol·L-1的浓硫酸配制500mL2.3mol·L-1的稀硫酸用于增强84消毒液的消毒能力,需取用浓硫酸的体积为_______ mL。
(5)在配制过程中,下列操作中能使所配溶液的浓度偏高的有_______ (填代号)。
①用量筒量取98%的硫酸时俯视
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③转移前,容量瓶中含有少量蒸馏水
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤定容时,俯视刻度线
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
| 84消毒液 (有效成分)NaClO (规格)1000mL (质量分数)25% (密度)1.19g/cm3 |
(1)该84消毒液NaClO物质的量浓度约为
(2)该同学参阅该84消毒液的配方,欲用NaClO固体配制480mL该种84消毒液。下列说法不正确的是

A.如图所示的仪器中,有三种是不需要的,还另需要一种玻璃仪器
B.使用前要检查容量瓶是否漏液
C.容量瓶上标有容积、温度和浓度
D.需要称量NaClO固体的质量为149.0g
E.容量瓶用蒸馏水洗净后,须烘干后再使用
(3)一瓶上述84消毒液理论上能吸收空气中
(4)84消毒液与稀硫酸混合使用可增强消毒能力,请用化学方程式解释其原因
(5)在配制过程中,下列操作中能使所配溶液的浓度偏高的有
①用量筒量取98%的硫酸时俯视
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③转移前,容量瓶中含有少量蒸馏水
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤定容时,俯视刻度线
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
您最近一年使用:0次
2023-08-26更新
|
284次组卷
|
2卷引用:辽宁省大连市第八中学2022-2023学年高一上学期12月月考化学试题
名校
解题方法
7 . 物质的量是将微观粒子数与宏观可称量物理量联系起来的桥梁,极大地促进了化学学科的发展。
(1)下列关于气体说法正确的是_________。
(2)下列示意图中,白球代表氢原子,黑球代表氮原子;方框代表容器,容器中间有一个可以左右滑动的隔板。其中能表示等质量的氢气与氮气的是_________。
(3)现有 的硫酸500mL,则含有
的硫酸500mL,则含有 的物质的量为
的物质的量为___________ mol,其中氢离子的浓度为___________ 。取出100mL该溶液,需要___________ mol的NaOH才可将此100mL溶液完全反应。对于 的硫酸,若其密度为
的硫酸,若其密度为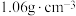 ,则其质量分数为
,则其质量分数为___________ (结果保留三位有效数字)。
(1)下列关于气体说法正确的是_________。
A.同温同压下,2g  的体积为22.4L 的体积为22.4L |
| B.同温同压下,气体物质的量越大,其体积也越大 |
C.标准状况下,18g  的体积为22.4L 的体积为22.4L |
D.标准状况下,1L HClI与1L  所含原子数不同 所含原子数不同 |
(2)下列示意图中,白球代表氢原子,黑球代表氮原子;方框代表容器,容器中间有一个可以左右滑动的隔板。其中能表示等质量的氢气与氮气的是_________。
A. | B.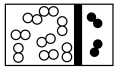 | C.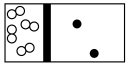 | D.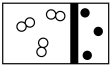 |
(3)现有
 的硫酸500mL,则含有
的硫酸500mL,则含有 的物质的量为
的物质的量为 的硫酸,若其密度为
的硫酸,若其密度为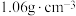 ,则其质量分数为
,则其质量分数为
您最近一年使用:0次
名校
8 . 某小组设计如下实验研究实验室中的甲酸。已知:25℃时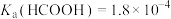
(1)配制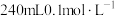 的HCOOH溶液,需
的HCOOH溶液,需 的HCOOH溶液的体积为
的HCOOH溶液的体积为_______ mL。
(2)为确定甲酸溶液的准确浓度,取20mL甲酸溶液于锥形瓶中,加入2滴_______ 溶液,用 的NaOH溶液滴定至终点,消耗NaOH溶液的体积为22.04mL,滴定实验中所使用的锥形瓶的容积最恰当的是
的NaOH溶液滴定至终点,消耗NaOH溶液的体积为22.04mL,滴定实验中所使用的锥形瓶的容积最恰当的是_______ (填字母)。
A.50mL B.100mL C.200mL D.250mL
(3)下列关于滴定操作的说法正确的_______
(4)小组同学用_______ 测出25℃时该甲酸溶液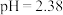 ,则水电离产生的
,则水电离产生的 数量级为
数量级为_______ 。
(5)25℃时甲酸与醋酸钠溶液反应: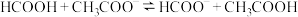 ,该反应的平衡常数为10,则该温度下醋酸的电离常数
,该反应的平衡常数为10,则该温度下醋酸的电离常数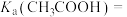
_______ 。
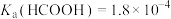
(1)配制
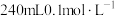 的HCOOH溶液,需
的HCOOH溶液,需 的HCOOH溶液的体积为
的HCOOH溶液的体积为(2)为确定甲酸溶液的准确浓度,取20mL甲酸溶液于锥形瓶中,加入2滴
 的NaOH溶液滴定至终点,消耗NaOH溶液的体积为22.04mL,滴定实验中所使用的锥形瓶的容积最恰当的是
的NaOH溶液滴定至终点,消耗NaOH溶液的体积为22.04mL,滴定实验中所使用的锥形瓶的容积最恰当的是A.50mL B.100mL C.200mL D.250mL
(3)下列关于滴定操作的说法正确的_______
| A.滴定前应检查滴定管是否漏水,进行洗涤、润洗 |
| B.将标准溶液装入滴定管时,应借助玻璃棒或漏斗等玻璃仪器转移 |
| C.进行滴定操作时,眼睛要始终注视着滴定管内液面的变化 |
| D.滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁 |
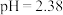 ,则水电离产生的
,则水电离产生的 数量级为
数量级为(5)25℃时甲酸与醋酸钠溶液反应:
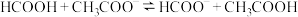 ,该反应的平衡常数为10,则该温度下醋酸的电离常数
,该反应的平衡常数为10,则该温度下醋酸的电离常数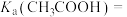
您最近一年使用:0次
2022-11-12更新
|
232次组卷
|
2卷引用:湖北省荆、荆、襄、宜四地七校考试联盟2022-2023学年高二上学期期中联考化学试题
解题方法
9 . 完成下列各题:
(1)磷的一种化合物叫亚磷酸( )。已知:
)。已知:
(i)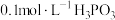 溶液的
溶液的 ;
;
(ii) 与NaOH反应只生成
与NaOH反应只生成 和
和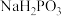 ;
;
(iii) 和碘水反应,碘水棕黄色褪去,再加
和碘水反应,碘水棕黄色褪去,再加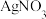 溶液有黄色沉淀生成。
溶液有黄色沉淀生成。
①关于 的说法:a.强酸;b.弱酸;c.二元酸;d.三元酸;e.氧化性酸;f.还原性酸,其中正确的是
的说法:a.强酸;b.弱酸;c.二元酸;d.三元酸;e.氧化性酸;f.还原性酸,其中正确的是______ 。(填序号)
A.bdf B.ade C.bcf D. bce
②Na2HPO3为__________ (填“正盐”或“酸式盐”)
(2)常温下,氨水的pH>7,用离子方程式解释其原因:_____________________________ 。
(3)25℃时, 溶液和盐酸的物质的量浓度相同。
溶液和盐酸的物质的量浓度相同。
①加水稀释至相同的倍数,此时 溶液的pH
溶液的pH______ (填“大于”“小于”或“等于”)盐酸的pH。
②加水稀释至相同的pH,此时加入 溶液中水的体积
溶液中水的体积______ (填“大于”“小于”或“等于”)加入盐酸中水的体积。
(4)常温下, 溶液中
溶液中
______ (用含 和
和 的代数式表示)。
的代数式表示)。
(5)25℃时,现有 的HCl溶液100mL,要使它的
的HCl溶液100mL,要使它的 ,如果加入蒸馏水,需加水
,如果加入蒸馏水,需加水______ mL;如果加入 的HCl溶液,需加入此HCl溶液
的HCl溶液,需加入此HCl溶液______ mL(假定溶液体积有加和性,下同)。
(6)某温度下,纯水中的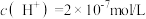 。若温度不变,滴入稀硫酸使
。若温度不变,滴入稀硫酸使 ,则由水电离出的
,则由水电离出的 为
为______ mol/L。
(1)磷的一种化合物叫亚磷酸(
 )。已知:
)。已知:(i)
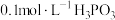 溶液的
溶液的 ;
;(ii)
 与NaOH反应只生成
与NaOH反应只生成 和
和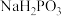 ;
;(iii)
 和碘水反应,碘水棕黄色褪去,再加
和碘水反应,碘水棕黄色褪去,再加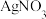 溶液有黄色沉淀生成。
溶液有黄色沉淀生成。①关于
 的说法:a.强酸;b.弱酸;c.二元酸;d.三元酸;e.氧化性酸;f.还原性酸,其中正确的是
的说法:a.强酸;b.弱酸;c.二元酸;d.三元酸;e.氧化性酸;f.还原性酸,其中正确的是A.bdf B.ade C.bcf D. bce
②Na2HPO3为
(2)常温下,氨水的pH>7,用离子方程式解释其原因:
(3)25℃时,
 溶液和盐酸的物质的量浓度相同。
溶液和盐酸的物质的量浓度相同。①加水稀释至相同的倍数,此时
 溶液的pH
溶液的pH②加水稀释至相同的pH,此时加入
 溶液中水的体积
溶液中水的体积(4)常温下,
 溶液中
溶液中
 和
和 的代数式表示)。
的代数式表示)。(5)25℃时,现有
 的HCl溶液100mL,要使它的
的HCl溶液100mL,要使它的 ,如果加入蒸馏水,需加水
,如果加入蒸馏水,需加水 的HCl溶液,需加入此HCl溶液
的HCl溶液,需加入此HCl溶液(6)某温度下,纯水中的
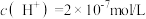 。若温度不变,滴入稀硫酸使
。若温度不变,滴入稀硫酸使 ,则由水电离出的
,则由水电离出的 为
为
您最近一年使用:0次
名校
10 . CH3OH是一种重要的化工原料,广泛应用于化工生产,根据所学回答下列问题:
(1)工业上制备甲醇的反应方程式为: ,某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:
,某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:
①写出该反应体系中CO2的电子式___________ 。
②用H2表示前2h的平均反应速率v(H2)=___________ 。
③该温度下,CO2的平衡转化率为___________ 。
④在一定条件下,下列说法能说明该可逆反应达到平衡状态的是___________ (填字母)。
A.容器中气体密度不变 B.容器中气体平均摩尔质量不变
C. D.形成2molC=O键同时断裂3molH-H键
D.形成2molC=O键同时断裂3molH-H键
⑤在温度为T,压强为P的条件下,将CO2和H2按物质的量之比1∶3通入一恒压密闭容器中发生上述反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为
___________ (用含P的表达式表示,其中用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)CH3OH制备丙烯的反应为: ,速率常数k与反应温度T的关系遵循Arrhenius方程,已知Arrhenius方程为:
,速率常数k与反应温度T的关系遵循Arrhenius方程,已知Arrhenius方程为: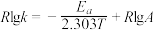 (其中k为速率常数,反应速率与其成正比;
(其中k为速率常数,反应速率与其成正比;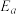 为活化能:
为活化能: ,A为常数)。
,A为常数)。

①在一定条件下,测得实验数据如上图曲线a所示。则该条件下,反应的活化能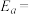
___________ 
②若实验时改变外界条件,测得实验数据为如上图曲线b所示,则可能改变的外界条件是___________ (填标号)
A.升高温度 B.增大压强 C.增大 D.更换适宜的催化剂
D.更换适宜的催化剂
(1)工业上制备甲醇的反应方程式为:
 ,某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:
,某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:| 时间/h | l | 2 | 3 | 4 | 5 | 6 |
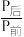 | 0.90 | 0.85 | 0.83 | 0.81 | 0.80 | 0.80 |
②用H2表示前2h的平均反应速率v(H2)=
③该温度下,CO2的平衡转化率为
④在一定条件下,下列说法能说明该可逆反应达到平衡状态的是
A.容器中气体密度不变 B.容器中气体平均摩尔质量不变
C.
 D.形成2molC=O键同时断裂3molH-H键
D.形成2molC=O键同时断裂3molH-H键⑤在温度为T,压强为P的条件下,将CO2和H2按物质的量之比1∶3通入一恒压密闭容器中发生上述反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为

(2)CH3OH制备丙烯的反应为:
 ,速率常数k与反应温度T的关系遵循Arrhenius方程,已知Arrhenius方程为:
,速率常数k与反应温度T的关系遵循Arrhenius方程,已知Arrhenius方程为: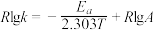 (其中k为速率常数,反应速率与其成正比;
(其中k为速率常数,反应速率与其成正比;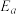 为活化能:
为活化能: ,A为常数)。
,A为常数)。
①在一定条件下,测得实验数据如上图曲线a所示。则该条件下,反应的活化能
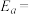

②若实验时改变外界条件,测得实验数据为如上图曲线b所示,则可能改变的外界条件是
A.升高温度 B.增大压强 C.增大
 D.更换适宜的催化剂
D.更换适宜的催化剂
您最近一年使用:0次
2023-06-30更新
|
475次组卷
|
2卷引用:重庆市西南大学附属中学2022-2023学年高一下学期期末考试化学试题



