1 . “84”消毒液是生活中常用的消毒剂,可与硫酸溶液反应制取氯气,反应原理为NaClO+NaCl+H2SO4 Na2SO4+Cl2↑+H2O。为探究氯气的性质,某同学利用此原理制氯气并设计了如图所示的实验装置。
Na2SO4+Cl2↑+H2O。为探究氯气的性质,某同学利用此原理制氯气并设计了如图所示的实验装置。
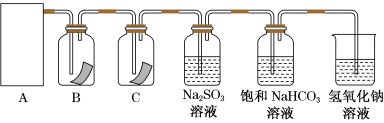
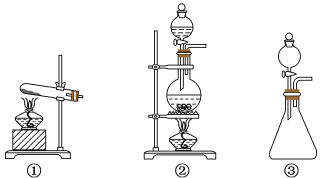
(1)从①、②、③装置中选择合适的制氯气装置(A处)____ (填标号)。
(2)装置B、C中依次放的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,其原因可能是___ ;说明该装置存在明显的缺陷,请提出合理的改进的方法_____ 。
(3)为了验证氯气的氧化性,将氯气通入Na2SO3溶液中,然后检验反应后溶液中是否含有SO42-,写出氯气与Na2SO3溶液反应的离子方程式:____ 。检验SO42-的方法是取少量反应后溶液于试管中,先加入足量的___ 至无明显现象,然后再加入少量___ 溶液,有白色沉淀生成,说明含有SO42-。
(4)氯气通入饱和NaHCO3溶液能产生无色气体,已知酸性:盐酸>碳酸>次氯酸,该实验证明氯气与水反应的生成物中含有____ (填“盐酸”或“次氯酸”)。
 Na2SO4+Cl2↑+H2O。为探究氯气的性质,某同学利用此原理制氯气并设计了如图所示的实验装置。
Na2SO4+Cl2↑+H2O。为探究氯气的性质,某同学利用此原理制氯气并设计了如图所示的实验装置。
(1)从①、②、③装置中选择合适的制氯气装置(A处)

(2)装置B、C中依次放的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,其原因可能是
(3)为了验证氯气的氧化性,将氯气通入Na2SO3溶液中,然后检验反应后溶液中是否含有SO42-,写出氯气与Na2SO3溶液反应的离子方程式:
(4)氯气通入饱和NaHCO3溶液能产生无色气体,已知酸性:盐酸>碳酸>次氯酸,该实验证明氯气与水反应的生成物中含有
您最近一年使用:0次
名校
解题方法
2 . 某同学欲验证碳与浓硫酸反应产物的性质。现已将装置如图连接,请回答下列问题。
(1)烧瓶中发生反应的化学反应方程式是___________ 。
(2)实验中两次使用到品红溶液,其目的不同。A的使用目的是_____ ,通过洗气瓶C中无现象和___ 的现象,证明反应有_______ (填化学式)生成。
(3)洗气瓶B中溶液颜色变浅,说明碳与浓硫酸反应的产物之一______ (填名称)具有______ 的性质。
(4)实验完成后,取出洗气瓶A中的无色溶液于试管中,加热,可观察到__________ 。
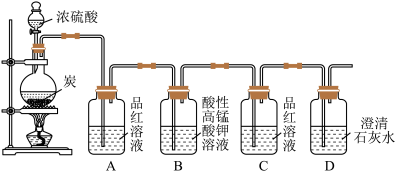
(1)烧瓶中发生反应的化学反应方程式是
(2)实验中两次使用到品红溶液,其目的不同。A的使用目的是
(3)洗气瓶B中溶液颜色变浅,说明碳与浓硫酸反应的产物之一
(4)实验完成后,取出洗气瓶A中的无色溶液于试管中,加热,可观察到
您最近一年使用:0次
2020-01-05更新
|
361次组卷
|
3卷引用:河北省唐山市丰润车轴山中学2019—2020学年高一上学期12月月考化学试题
3 . 甲、乙都是二元固体化合物,将32g的粉末加入足量浓硝酸并加热,完全溶解得蓝色溶液,向该溶液中加入足量 溶液,过滤、洗涤、干燥得沉淀
溶液,过滤、洗涤、干燥得沉淀 ;滤液中再滴加NaOH溶液,又出现蓝色沉淀。
;滤液中再滴加NaOH溶液,又出现蓝色沉淀。
含乙的矿石自然界中储量较多,称取一定量的乙,加入稀盐酸使其完全溶解,溶液分为A、B两等分,向A中加入足量NaOH溶液,过滤、洗涤、灼烧得到红棕色固体28g,经分析乙与红棕色固体组成元素相同,向B中加入 铜粉充分反应后过滤、洗涤、干燥得固体
铜粉充分反应后过滤、洗涤、干燥得固体 。
。
 写出构成甲的阴离子的结构示意图
写出构成甲的阴离子的结构示意图______ ,32g甲在足量浓硝酸中反应转移的电子数为______ 。
 乙的化学式
乙的化学式______ ;稀硫酸溶解乙的化学方程式______ 。
 将甲在足量氧气中充分灼烧的气体产物通入一定量A溶液中,该反应的离子方程式为
将甲在足量氧气中充分灼烧的气体产物通入一定量A溶液中,该反应的离子方程式为______ ,设计实验证明此步反应后的溶液中金属元素的化合价______ 。
 溶液,过滤、洗涤、干燥得沉淀
溶液,过滤、洗涤、干燥得沉淀 ;滤液中再滴加NaOH溶液,又出现蓝色沉淀。
;滤液中再滴加NaOH溶液,又出现蓝色沉淀。含乙的矿石自然界中储量较多,称取一定量的乙,加入稀盐酸使其完全溶解,溶液分为A、B两等分,向A中加入足量NaOH溶液,过滤、洗涤、灼烧得到红棕色固体28g,经分析乙与红棕色固体组成元素相同,向B中加入
 铜粉充分反应后过滤、洗涤、干燥得固体
铜粉充分反应后过滤、洗涤、干燥得固体 。
。 写出构成甲的阴离子的结构示意图
写出构成甲的阴离子的结构示意图 乙的化学式
乙的化学式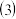 将甲在足量氧气中充分灼烧的气体产物通入一定量A溶液中,该反应的离子方程式为
将甲在足量氧气中充分灼烧的气体产物通入一定量A溶液中,该反应的离子方程式为
您最近一年使用:0次
2019-12-26更新
|
188次组卷
|
2卷引用:2019年秋高三化学复习强化练习——离子反应
名校
4 . 按要求回答下列问题:
(1)已知拆开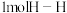 键、
键、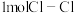 键、
键、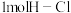 键分别需要吸收的能量为
键分别需要吸收的能量为 、
、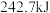 、
、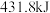 。则由
。则由 和
和 反应生成1molHCl需要
反应生成1molHCl需要_______  填“放出”或“吸收”
填“放出”或“吸收”
_________ 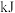 的热量。
的热量。
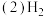 可以在
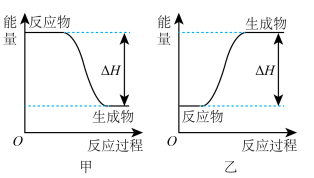
可以在 中安静地燃烧。甲、乙两图中,能表示该反应能量变化的是图
中安静地燃烧。甲、乙两图中,能表示该反应能量变化的是图_____  填“甲”或“乙”
填“甲”或“乙” 。
。
(3)将等物质的量的A和B,混合于2 L的密闭容器中,发生如下反应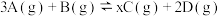 。2min后,测得D的浓度为
。2min后,测得D的浓度为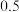 mol/L ,
mol/L ,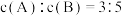 ,C的反应速率是
,C的反应速率是 mol/(L·min)。则:
mol/(L·min)。则:
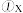 的值是
的值是__________ ;
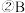 的平均反应速率是
的平均反应速率是____________ ;
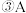 在2min末的浓度是
在2min末的浓度是________________ ;
④若此后各物质的量均不再变化,则证明此可逆反应达到了_______ 的程度。
A.反应彻底 反应终止
反应终止 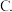 化学平衡
化学平衡 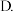 无法判断
无法判断
(1)已知拆开
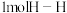 键、
键、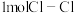 键、
键、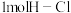 键分别需要吸收的能量为
键分别需要吸收的能量为 、
、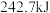 、
、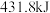 。则由
。则由 和
和 反应生成1molHCl需要
反应生成1molHCl需要 填“放出”或“吸收”
填“放出”或“吸收”
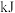 的热量。
的热量。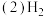 可以在
可以在 中安静地燃烧。甲、乙两图中,能表示该反应能量变化的是图
中安静地燃烧。甲、乙两图中,能表示该反应能量变化的是图 填“甲”或“乙”
填“甲”或“乙” 。
。
(3)将等物质的量的A和B,混合于2 L的密闭容器中,发生如下反应
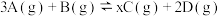 。2min后,测得D的浓度为
。2min后,测得D的浓度为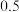 mol/L ,
mol/L ,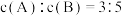 ,C的反应速率是
,C的反应速率是 mol/(L·min)。则:
mol/(L·min)。则: 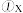 的值是
的值是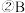 的平均反应速率是
的平均反应速率是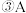 在2min末的浓度是
在2min末的浓度是④若此后各物质的量均不再变化,则证明此可逆反应达到了
A.反应彻底
 反应终止
反应终止  化学平衡
化学平衡  无法判断
无法判断
您最近一年使用:0次
2019-07-20更新
|
661次组卷
|
3卷引用:黑龙江省大庆中学2018-2019学年高一下学期期末考试化学试题
解题方法
5 . 某研究性学习小组对铝热反应实验展开研究。现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如下:
Ⅰ.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?________ (填“合理”或“不合理”)。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是________ ,反应的离子方程式为__________________________________________________ 。
(3)实验室溶解该熔融物,在下列试剂中最适宜的试剂是________ (填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4 mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
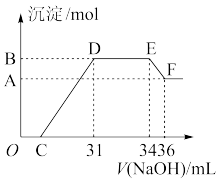
(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为_________________________ 。
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为___________ ;上述现象说明溶液中________ 结合OH-的能力比________ 强(填离子符号)。
(3)B与A的差值为________ mol。
(4)B点对应的沉淀的物质的量为________ mol,C点对应的氢氧化钠溶液的体积为________ mL。
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2 054 | 1 535 | 1 462 |
| 沸点/℃ | 2 467 | 2 980 | 2 750 | - |
Ⅰ.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是
(3)实验室溶解该熔融物,在下列试剂中最适宜的试剂是
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4 mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:

(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为
(3)B与A的差值为
(4)B点对应的沉淀的物质的量为
您最近一年使用:0次
解题方法
6 . 铝、铁是常见的两种金属,它们的单质及化合物在生活生产中处处可见。
(1)过量的铁和稀硝酸发生反应,产物是Fe(NO3)2和NO,写出该反应的化学方程式___________ 。
(2)实验室配制FeSO4溶液时,如果没有隔绝空气,FeSO4会被氧化为_______ (填写化学式)。在该溶液中加入___________ 试剂,看到_____________________ 现象,证明溶液变质。
(3)KAl(SO4)2·12H2O俗称明矾,常用作净水剂,请述其原因并写出有关的离子方程式____________________ 。
(4)已知Ba(AlO2)2可溶于水,下图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系。

由图可知c点的沉淀是________ (填化学式),已知a-b时存在的沉淀是Al(OH)3和BaSO4,两者的物质的量:________ 比________ 多。
(1)过量的铁和稀硝酸发生反应,产物是Fe(NO3)2和NO,写出该反应的化学方程式
(2)实验室配制FeSO4溶液时,如果没有隔绝空气,FeSO4会被氧化为
(3)KAl(SO4)2·12H2O俗称明矾,常用作净水剂,请述其原因并写出有关的离子方程式
(4)已知Ba(AlO2)2可溶于水,下图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系。

由图可知c点的沉淀是
您最近一年使用:0次
名校
7 . 现准确称取0.92g 的有机物样品(只含C、H、O三种元素中的两种或三种),完全燃烧后生成的CO2为1.76g,生成的水1.08g。回答下列问题:
(1)则该有机物的元素组成为:______ ,最简式为________ 。
(2)根据上述结果能否写出该有机物可能的结构简式:________ (填“能”或“不能”)。若能,请写出该有机物各种可能的结构简式为:_____________
(3)请设计简单实验证明该有机物是上述何种物质(备选试剂:NaOH溶液、石蕊试液、Na、冰醋酸、CaCO3 实验仪器自选):____________________ 。
(1)则该有机物的元素组成为:
(2)根据上述结果能否写出该有机物可能的结构简式:
(3)请设计简单实验证明该有机物是上述何种物质(备选试剂:NaOH溶液、石蕊试液、Na、冰醋酸、CaCO3 实验仪器自选):
您最近一年使用:0次
8 . 有机物A的蒸汽密度为6.69g·L-1(已折算为标况),现取15g A完全氧化,产物依次通过浓硫酸和碱石灰,浓硫酸增重9g,碱石灰增重39.6g。用现代物理方法测定:
①核磁共振仪测出A的核磁共振氢谱有5组峰,其峰面积之比为1:2:2:2:3。
②利用红外光谱仪可初步检测有机化合物中的某些基团,现测得A分子中具有一个苯环结构,一个C-O-C结构和一个C=O结构,且A的苯环上只有一取代基。
③性质实验证明,A能在稀硫酸作用下生成两种有机物,且其中一种有酸性。
(1)通过计算求A的相对分子质量及分子式。
(2)根据谱图信息写出A的三种可能结构。
①核磁共振仪测出A的核磁共振氢谱有5组峰,其峰面积之比为1:2:2:2:3。
②利用红外光谱仪可初步检测有机化合物中的某些基团,现测得A分子中具有一个苯环结构,一个C-O-C结构和一个C=O结构,且A的苯环上只有一取代基。
③性质实验证明,A能在稀硫酸作用下生成两种有机物,且其中一种有酸性。
(1)通过计算求A的相对分子质量及分子式。
(2)根据谱图信息写出A的三种可能结构。
您最近一年使用:0次
10-11高三上·云南昆明·阶段练习
9 . 苹果酸是一种浓缩饮料的主要酸性物质。分离提纯后的化学分析如下:
(1)元素分析证明该酸只含C、H、O三种元素,其中C、H、O的质量比为24∶3∶40;该酸蒸气的密度是同温同压下氢气密度的67倍。
(2)0.l mol该酸与足量NaHCO3反应放出4.48 L CO2,与足量金属Na反应放出3.36 L H2(气体体积均已折算为标准状况下的体积)。
(3)该酸分子结构中没有支链。
通过计算求苹果酸的分子式______________ ,结构简式____________ 。
(1)元素分析证明该酸只含C、H、O三种元素,其中C、H、O的质量比为24∶3∶40;该酸蒸气的密度是同温同压下氢气密度的67倍。
(2)0.l mol该酸与足量NaHCO3反应放出4.48 L CO2,与足量金属Na反应放出3.36 L H2(气体体积均已折算为标准状况下的体积)。
(3)该酸分子结构中没有支链。
通过计算求苹果酸的分子式
您最近一年使用:0次
10 . 人类的生存环境是一个巨大的生态系统,随着社会生产力的发展,环境污染已严重威胁着人类的生存环境,而森林对保护和改善环境有着十分重要的作用。科学实验证明1 ha(公顷)柳杉林,每月可吸收SO 2 160 kg。试回答下列问题:
(1)柳杉林吸收SO 2 ,说明森林对环境的作用是:___________________。
(2)某火力发电厂每月燃烧含硫1%的烟煤10 000 t,若要吸收该厂所排出的烟道气中的SO2 需要栽柳杉林多少公顷?若该厂在排放烟道气之前用脱硫法处理,每年可回收硫多少千克?这些硫可生产98%的浓H2SO4 多少千克?
(1)柳杉林吸收SO 2 ,说明森林对环境的作用是:___________________。
(2)某火力发电厂每月燃烧含硫1%的烟煤10 000 t,若要吸收该厂所排出的烟道气中的SO2 需要栽柳杉林多少公顷?若该厂在排放烟道气之前用脱硫法处理,每年可回收硫多少千克?这些硫可生产98%的浓H2SO4 多少千克?
您最近一年使用:0次



