1 . 有机物A的蒸汽密度为6.69g·L-1(已折算为标况),现取15g A完全氧化,产物依次通过浓硫酸和碱石灰,浓硫酸增重9g,碱石灰增重39.6g。用现代物理方法测定:
①核磁共振仪测出A的核磁共振氢谱有5组峰,其峰面积之比为1:2:2:2:3。
②利用红外光谱仪可初步检测有机化合物中的某些基团,现测得A分子中具有一个苯环结构,一个C-O-C结构和一个C=O结构,且A的苯环上只有一取代基。
③性质实验证明,A能在稀硫酸作用下生成两种有机物,且其中一种有酸性。
(1)通过计算求A的相对分子质量及分子式。
(2)根据谱图信息写出A的三种可能结构。
①核磁共振仪测出A的核磁共振氢谱有5组峰,其峰面积之比为1:2:2:2:3。
②利用红外光谱仪可初步检测有机化合物中的某些基团,现测得A分子中具有一个苯环结构,一个C-O-C结构和一个C=O结构,且A的苯环上只有一取代基。
③性质实验证明,A能在稀硫酸作用下生成两种有机物,且其中一种有酸性。
(1)通过计算求A的相对分子质量及分子式。
(2)根据谱图信息写出A的三种可能结构。
您最近一年使用:0次
名校
解题方法
2 . 天然气的主要成分为 ,一般还含有
,一般还含有 、
、 等烃类,是重要的燃料和化工原料。
等烃类,是重要的燃料和化工原料。
(1)乙烷在一定条件可发生如下反应:
 ,相关物质的摩尔燃烧焓数据如表所示:
,相关物质的摩尔燃烧焓数据如表所示:
则
_____ 
(2)甲烷是常见的燃料, 加氢可制备甲烷,其反应为
加氢可制备甲烷,其反应为
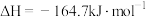 。
。
①
_____ 。
②对于 加氢制备甲烷的反应,有关说法错误的是
加氢制备甲烷的反应,有关说法错误的是_____ 。
A.该反应理论上可以设计成原电池
B.该反应过程中有旧键断裂吸收的能量大于新键形成释放的能量
C.反应结束,体系中物质的总能量降低
D.此反应可以变废为宝,有利于碳中和和碳达峰的实现
③已知:标准摩尔生成焓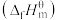 是指标况下,由元素最稳定的单质生成1mol纯净物时的反应焓变。298K时,几种气态物质标准摩尔生成焓如表:
是指标况下,由元素最稳定的单质生成1mol纯净物时的反应焓变。298K时,几种气态物质标准摩尔生成焓如表:
则
_____ 。
(3)丙烷燃烧可以通过以下两种途径:
途径I:
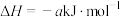
途径Ⅱ: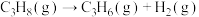
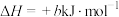

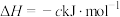

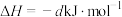 (a、b、c、d均为正值)
(a、b、c、d均为正值)
按途径Ⅱ反应,常温下,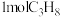 完全燃烧时放出的热量为
完全燃烧时放出的热量为_____ kJ(用含b、c、d的代数式表示);相同条件下,等量的丙烷通过两种途径完全燃烧时,途径I放出的热量_____ (填“大于”、“小于”或“等于”)途径Ⅱ放出的热量。
 ,一般还含有
,一般还含有 、
、 等烃类,是重要的燃料和化工原料。
等烃类,是重要的燃料和化工原料。(1)乙烷在一定条件可发生如下反应:

 ,相关物质的摩尔燃烧焓数据如表所示:
,相关物质的摩尔燃烧焓数据如表所示:| 物质 | 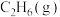 | 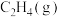 |  |
摩尔燃烧焓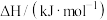 | -1560 | -1411 | -286 |


(2)甲烷是常见的燃料,
 加氢可制备甲烷,其反应为
加氢可制备甲烷,其反应为
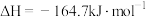 。
。| 物质 |  |  |  |  |
| 键能:1mol化学键断裂时需要吸收的能量/kJ | 436 | 465 | 413 | a |

②对于
 加氢制备甲烷的反应,有关说法错误的是
加氢制备甲烷的反应,有关说法错误的是A.该反应理论上可以设计成原电池
B.该反应过程中有旧键断裂吸收的能量大于新键形成释放的能量
C.反应结束,体系中物质的总能量降低
D.此反应可以变废为宝,有利于碳中和和碳达峰的实现
③已知:标准摩尔生成焓
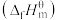 是指标况下,由元素最稳定的单质生成1mol纯净物时的反应焓变。298K时,几种气态物质标准摩尔生成焓如表:
是指标况下,由元素最稳定的单质生成1mol纯净物时的反应焓变。298K时,几种气态物质标准摩尔生成焓如表:| 物质 |  |  |  |  |
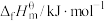 | -393.5 | -241.5 | x | 0 |

(3)丙烷燃烧可以通过以下两种途径:
途径I:

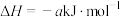
途径Ⅱ:
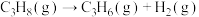
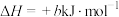

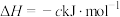

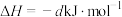 (a、b、c、d均为正值)
(a、b、c、d均为正值)按途径Ⅱ反应,常温下,
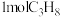 完全燃烧时放出的热量为
完全燃烧时放出的热量为
您最近一年使用:0次
名校
3 . 某兴趣小组在化学实验室找到了敞口放置较长时间的市售漂白粉,包装袋上标明其成分为CaCl2和Ca(ClO)2,有效成分含量为40%。已知Ca(ClO)2在空气中易变质为CaCO3,为探究漂白粉的变质情况,小组成员小昕用电子天平称取了1.887g的固体,向其中加入足量稀硝酸,把生成的气体全部通入:250mL 的澄清石灰水中使之充分反应,将所得沉淀过滤,洗涤,烘干之后,称量得到其质量为0.400g。小昕通过计算得出结论,此时的漂白粉中必定存在部分未变质的Ca(ClO)2。
的澄清石灰水中使之充分反应,将所得沉淀过滤,洗涤,烘干之后,称量得到其质量为0.400g。小昕通过计算得出结论,此时的漂白粉中必定存在部分未变质的Ca(ClO)2。
(1)你认为小昕的说法正确吗?___________ 。并说明理由___________ 。
(2)书写S原子的结构示意图:___________ 。
(3)乔同学和樊同学想用84消毒液杀死真菌,为了提高效果,乔同学向“84”中加入了洁厕灵(主要成分为HCl),结果导致两人双双中毒紧急送进医院,请写出相关方程式___________ 。
(4)在石灰窑中烧制生石灰,lmolCaCO3完全分解所需要的能量,可燃烧0.453mol碳来提供。设空气中O2体积分数为0.21,N2为0.79,则石灰窑产生的气体中CO2的体积分数最大值是___________ 。
(5)某固体仅由一种元素组成,其密度为: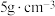 ,用X射线研究该固体的结果表明:在边长为
,用X射线研究该固体的结果表明:在边长为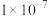 cm的立方体中含有20个原子,则此元素的相对原子质量约为
cm的立方体中含有20个原子,则此元素的相对原子质量约为___________ (取整数)。
 的澄清石灰水中使之充分反应,将所得沉淀过滤,洗涤,烘干之后,称量得到其质量为0.400g。小昕通过计算得出结论,此时的漂白粉中必定存在部分未变质的Ca(ClO)2。
的澄清石灰水中使之充分反应,将所得沉淀过滤,洗涤,烘干之后,称量得到其质量为0.400g。小昕通过计算得出结论,此时的漂白粉中必定存在部分未变质的Ca(ClO)2。(1)你认为小昕的说法正确吗?
(2)书写S原子的结构示意图:
(3)乔同学和樊同学想用84消毒液杀死真菌,为了提高效果,乔同学向“84”中加入了洁厕灵(主要成分为HCl),结果导致两人双双中毒紧急送进医院,请写出相关方程式
(4)在石灰窑中烧制生石灰,lmolCaCO3完全分解所需要的能量,可燃烧0.453mol碳来提供。设空气中O2体积分数为0.21,N2为0.79,则石灰窑产生的气体中CO2的体积分数最大值是
(5)某固体仅由一种元素组成,其密度为:
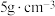 ,用X射线研究该固体的结果表明:在边长为
,用X射线研究该固体的结果表明:在边长为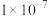 cm的立方体中含有20个原子,则此元素的相对原子质量约为
cm的立方体中含有20个原子,则此元素的相对原子质量约为
您最近一年使用:0次
名校
解题方法
4 . 已知:25℃时,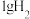 燃烧生成液态水放出142.9kJ的热量,
燃烧生成液态水放出142.9kJ的热量,
(1)写出表示 燃烧热的热化学反应方程式
燃烧热的热化学反应方程式___________ 。
(2)关于热化学方程式:
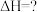 的说法正确的是
的说法正确的是
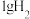 燃烧生成液态水放出142.9kJ的热量,
燃烧生成液态水放出142.9kJ的热量,(1)写出表示
 燃烧热的热化学反应方程式
燃烧热的热化学反应方程式(2)关于热化学方程式:

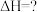 的说法正确的是
的说法正确的是| A.热化学方程式中化学计量数表示分子数 | B.该反应 大于零 大于零 |
C.该反应的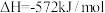 | D.该反应可表示36g水分解时的热效应 |
您最近一年使用:0次
解题方法
5 . 回答下列问题:
(1)合成气(CO、H2)是一种重要的化工原料,在化工生产中具有十分广泛的用途。工业上用CO和H2合成CH3OH: △H。则该反应的平衡常数表达式为
△H。则该反应的平衡常数表达式为_______ ;
(2)测得不同温度下反应的平衡常数 如下表:
如下表:
下列说法错误的是_______。
(3)工业上,利用水煤气法制取合成气,其中发生的一步反应为:CO(g)+H2O(g) CO2(g)+H2(g) △H=-41.2kJ·mol-1。已知
CO2(g)+H2(g) △H=-41.2kJ·mol-1。已知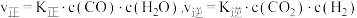 (k正、k逆为化学反应速率常数,只与温度有关,与浓度、压强无关)。830℃时,体积为2L的恒容密闭容器中,投入2molCO(g)和2molH2O(g)。5min达到平衡,测得H2的平均生成速率为0.1mol∙L-1∙min-1,则反应达到平衡后,速率常数
(k正、k逆为化学反应速率常数,只与温度有关,与浓度、压强无关)。830℃时,体积为2L的恒容密闭容器中,投入2molCO(g)和2molH2O(g)。5min达到平衡,测得H2的平均生成速率为0.1mol∙L-1∙min-1,则反应达到平衡后,速率常数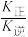 =
=_______ 。
(4)以天然气为原料生产合成气也有多种方法,其中Sparg工艺的原理为CH4(g)+CO2(g) 2CO(g)+2H2(g) △H1。T℃下,向容积可变的密闭容器中充入一定量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如表所示:
2CO(g)+2H2(g) △H1。T℃下,向容积可变的密闭容器中充入一定量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如表所示:
①T℃下,该反应的平衡常数K=_______ 。
②实验1中,CO的平衡体积分数为_______ %(保留三位有效数字)。
③V1:V2=_______ 。
(1)合成气(CO、H2)是一种重要的化工原料,在化工生产中具有十分广泛的用途。工业上用CO和H2合成CH3OH:
 △H。则该反应的平衡常数表达式为
△H。则该反应的平衡常数表达式为(2)测得不同温度下反应的平衡常数
 如下表:
如下表:| 温度/℃ | T1 | 100 | T2 | 200 | 300 |
| 平衡常数K | 100 | 13 | 1 | 1.9×10-2 | 2.4×10-4 |
| A.△H<0 |
| B.该反应的ΔS<0 |
| C.T2时,某时刻1L容器中含0.1mol CO、0.2mol H2和0.3mol CH3OH,此时v正>v逆 |
| D.T1时,向1L密闭容器中投入0.1mol CO和0.2mol H2,平衡时CO转化率为50% |
 CO2(g)+H2(g) △H=-41.2kJ·mol-1。已知
CO2(g)+H2(g) △H=-41.2kJ·mol-1。已知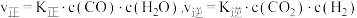 (k正、k逆为化学反应速率常数,只与温度有关,与浓度、压强无关)。830℃时,体积为2L的恒容密闭容器中,投入2molCO(g)和2molH2O(g)。5min达到平衡,测得H2的平均生成速率为0.1mol∙L-1∙min-1,则反应达到平衡后,速率常数
(k正、k逆为化学反应速率常数,只与温度有关,与浓度、压强无关)。830℃时,体积为2L的恒容密闭容器中,投入2molCO(g)和2molH2O(g)。5min达到平衡,测得H2的平均生成速率为0.1mol∙L-1∙min-1,则反应达到平衡后,速率常数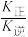 =
=(4)以天然气为原料生产合成气也有多种方法,其中Sparg工艺的原理为CH4(g)+CO2(g)
 2CO(g)+2H2(g) △H1。T℃下,向容积可变的密闭容器中充入一定量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如表所示:
2CO(g)+2H2(g) △H1。T℃下,向容积可变的密闭容器中充入一定量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如表所示:| 实验编号 | 容器体积 | 物质浓度/mol·L-1 | ||
| CH4 | CO2 | CO | ||
| 1 | V1 | 0.02 | 0.02 | 0.10 |
| 2 | V2 | x | x | 0.05 |
②实验1中,CO的平衡体积分数为
③V1:V2=
您最近一年使用:0次
名校
6 . 某小组设计如下实验研究实验室中的甲酸。已知:25℃时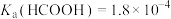
(1)配制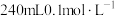 的HCOOH溶液,需
的HCOOH溶液,需 的HCOOH溶液的体积为
的HCOOH溶液的体积为_______ mL。
(2)为确定甲酸溶液的准确浓度,取20mL甲酸溶液于锥形瓶中,加入2滴_______ 溶液,用 的NaOH溶液滴定至终点,消耗NaOH溶液的体积为22.04mL,滴定实验中所使用的锥形瓶的容积最恰当的是
的NaOH溶液滴定至终点,消耗NaOH溶液的体积为22.04mL,滴定实验中所使用的锥形瓶的容积最恰当的是_______ (填字母)。
A.50mL B.100mL C.200mL D.250mL
(3)下列关于滴定操作的说法正确的_______
(4)小组同学用_______ 测出25℃时该甲酸溶液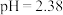 ,则水电离产生的
,则水电离产生的 数量级为
数量级为_______ 。
(5)25℃时甲酸与醋酸钠溶液反应: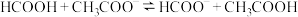 ,该反应的平衡常数为10,则该温度下醋酸的电离常数
,该反应的平衡常数为10,则该温度下醋酸的电离常数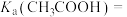
_______ 。
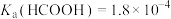
(1)配制
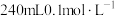 的HCOOH溶液,需
的HCOOH溶液,需 的HCOOH溶液的体积为
的HCOOH溶液的体积为(2)为确定甲酸溶液的准确浓度,取20mL甲酸溶液于锥形瓶中,加入2滴
 的NaOH溶液滴定至终点,消耗NaOH溶液的体积为22.04mL,滴定实验中所使用的锥形瓶的容积最恰当的是
的NaOH溶液滴定至终点,消耗NaOH溶液的体积为22.04mL,滴定实验中所使用的锥形瓶的容积最恰当的是A.50mL B.100mL C.200mL D.250mL
(3)下列关于滴定操作的说法正确的_______
| A.滴定前应检查滴定管是否漏水,进行洗涤、润洗 |
| B.将标准溶液装入滴定管时,应借助玻璃棒或漏斗等玻璃仪器转移 |
| C.进行滴定操作时,眼睛要始终注视着滴定管内液面的变化 |
| D.滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁 |
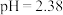 ,则水电离产生的
,则水电离产生的 数量级为
数量级为(5)25℃时甲酸与醋酸钠溶液反应:
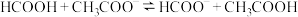 ,该反应的平衡常数为10,则该温度下醋酸的电离常数
,该反应的平衡常数为10,则该温度下醋酸的电离常数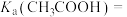
您最近一年使用:0次
2022-11-12更新
|
232次组卷
|
2卷引用:湖北省荆、荆、襄、宜四地七校考试联盟2022-2023学年高二上学期期中联考化学试题
名校
解题方法
7 . 物质的量是将微观粒子数与宏观可称量物理量联系起来的桥梁,极大地促进了化学学科的发展。
(1)下列关于气体说法正确的是_________。
(2)下列示意图中,白球代表氢原子,黑球代表氮原子;方框代表容器,容器中间有一个可以左右滑动的隔板。其中能表示等质量的氢气与氮气的是_________。
(3)现有 的硫酸500mL,则含有
的硫酸500mL,则含有 的物质的量为
的物质的量为___________ mol,其中氢离子的浓度为___________ 。取出100mL该溶液,需要___________ mol的NaOH才可将此100mL溶液完全反应。对于 的硫酸,若其密度为
的硫酸,若其密度为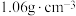 ,则其质量分数为
,则其质量分数为___________ (结果保留三位有效数字)。
(1)下列关于气体说法正确的是_________。
A.同温同压下,2g  的体积为22.4L 的体积为22.4L |
| B.同温同压下,气体物质的量越大,其体积也越大 |
C.标准状况下,18g  的体积为22.4L 的体积为22.4L |
D.标准状况下,1L HClI与1L  所含原子数不同 所含原子数不同 |
(2)下列示意图中,白球代表氢原子,黑球代表氮原子;方框代表容器,容器中间有一个可以左右滑动的隔板。其中能表示等质量的氢气与氮气的是_________。
A. | B.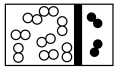 | C.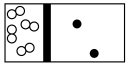 | D.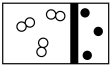 |
(3)现有
 的硫酸500mL,则含有
的硫酸500mL,则含有 的物质的量为
的物质的量为 的硫酸,若其密度为
的硫酸,若其密度为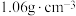 ,则其质量分数为
,则其质量分数为
您最近一年使用:0次
8 . 已知:N2O4(g)⇌2NO2(g) =+52.70 kJ/mol。
=+52.70 kJ/mol。
(1)在恒温、恒容的已达平衡的密闭容器中,再向容器内充入1 mol N2O4(g),并达新平衡,下列说法正确的______
a.N2O4(g)的转化率增大
b.平衡常数K减小
c.新平衡N2O4的百分含量比原平衡大
d.新平衡透明容器的气体颜色比原平衡还要深
(2)t℃恒温下,在固定容积为2 L的密闭容器中充入0.54 mol N2O4,2分钟时达到化学平衡,测得容器中含n(NO2)=0.6 mol,则在前2分钟的平均反应速率v(NO2)=_______ ,t℃时反应N2O4(g)⇌2NO2(g)的平衡常数K=________ 。
(3)现有两个体积均为2 L的恒容绝热(不与外界进行热交换)密闭容器甲和乙,若在甲容器中加入1 mol N2O4,在乙容器加入2 mol NO2,分别达平衡后,甲容器N2O4(g)⇌2NO2(g)的平衡常数_______ 乙容器N2O4(g)⇌2NO2(g)的平衡常数(填“大于”、“小于”或“等于”),甲容器中N2O4转化率与乙容器中NO2的转化率之和_________ 1(填“大于”、“小于”或“等于”)。
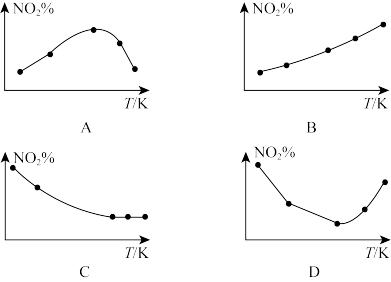
(4)取五等份NO2,分别加入温度不同、容积相同的恒容密闭容器中,发生反应2NO2(g)⇌N2O4(g)。反应相同时间后,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是__________
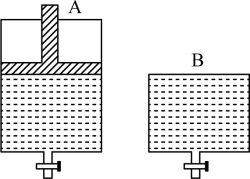
(5)一定温度下,若将3 mol N2O4气体置入开始体积为V但体积可变的等压密闭容器中(如图A),达平衡后容器体积增大至1.5V。若在另一个体积也为V但体积不变的密闭容器中(如图B)加入_______ mol NO2,达平衡后A、B两容器的NO2百分含量相等。
 =+52.70 kJ/mol。
=+52.70 kJ/mol。(1)在恒温、恒容的已达平衡的密闭容器中,再向容器内充入1 mol N2O4(g),并达新平衡,下列说法正确的
a.N2O4(g)的转化率增大
b.平衡常数K减小
c.新平衡N2O4的百分含量比原平衡大
d.新平衡透明容器的气体颜色比原平衡还要深
(2)t℃恒温下,在固定容积为2 L的密闭容器中充入0.54 mol N2O4,2分钟时达到化学平衡,测得容器中含n(NO2)=0.6 mol,则在前2分钟的平均反应速率v(NO2)=
(3)现有两个体积均为2 L的恒容绝热(不与外界进行热交换)密闭容器甲和乙,若在甲容器中加入1 mol N2O4,在乙容器加入2 mol NO2,分别达平衡后,甲容器N2O4(g)⇌2NO2(g)的平衡常数
(4)取五等份NO2,分别加入温度不同、容积相同的恒容密闭容器中,发生反应2NO2(g)⇌N2O4(g)。反应相同时间后,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是

(5)一定温度下,若将3 mol N2O4气体置入开始体积为V但体积可变的等压密闭容器中(如图A),达平衡后容器体积增大至1.5V。若在另一个体积也为V但体积不变的密闭容器中(如图B)加入

您最近一年使用:0次
名校
解题方法
9 . 钠及其化合物有非常重要的用途。
(1)钠的化学性质非常活泼。画出钠的原子结构示意图________ 。
钠与水反应的实验过程如图①、②、③所示。
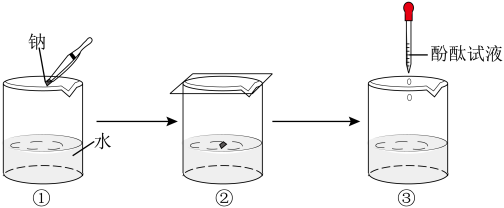
①将图②中的现象与解释用直线连接起来。_________
实验现象 解释
钠熔成小球 产生了气体
钠四处游动,嘶嘶作响 钠的密度比水小
钠浮在水面上 钠与水反应放热且钠的熔点低
②在③中酚酞变红,说明溶液呈_______ (填“酸”或“碱”或“中”)性。
③钠与水反应的化学方程式是_________ 。
(2)过氧化钠可在潜水艇中作为氧气的来源。写出过氧化钠与水反应的化学方程式___ ,与二氧化碳反应的化学方程式___ 。
(3)为探究Na2CO3和NaHCO3的热稳定性,某同学设计了如下实验:
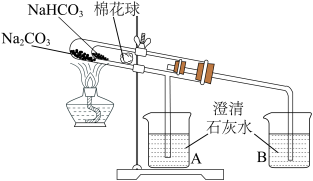
加热一段时间后,________ (填“A”或“B”)中澄清石灰水变浑浊,写出澄清石灰水变浑浊的离子方程式:________ 。写出试管中发生反应的化学方程式________ 。
(4)我国化学家侯德榜发明了联合制碱法,对世界制碱工业做出了巨大贡献。联合制碱法的主要过程如图所示(部分物质已略去)。含有氮元素、钾元素、磷元素的某些盐可以作为化肥。
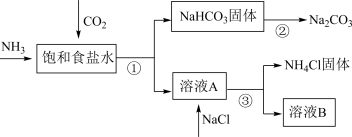
①联合制碱法所制得的“碱”是指_______ (填化学式)。
②在①-③所涉及的操作方法中,包含过滤的是_______ (填序号)。
③根据图,将化学方程式补充完整:NH3+CO2+___ +___ =NaHCO3↓+NH4Cl
④NaHCO3溶于水电离的方程式___ 。
⑤下列说法中,正确的是___ (填字母)
a.CO2可循环使用
b.副产物NH4Cl可用作肥料
c.溶液B中一定含有Na+、NH4+、Cl-
(1)钠的化学性质非常活泼。画出钠的原子结构示意图
钠与水反应的实验过程如图①、②、③所示。

①将图②中的现象与解释用直线连接起来。
实验现象 解释
钠熔成小球 产生了气体
钠四处游动,嘶嘶作响 钠的密度比水小
钠浮在水面上 钠与水反应放热且钠的熔点低
②在③中酚酞变红,说明溶液呈
③钠与水反应的化学方程式是
(2)过氧化钠可在潜水艇中作为氧气的来源。写出过氧化钠与水反应的化学方程式
(3)为探究Na2CO3和NaHCO3的热稳定性,某同学设计了如下实验:

加热一段时间后,
(4)我国化学家侯德榜发明了联合制碱法,对世界制碱工业做出了巨大贡献。联合制碱法的主要过程如图所示(部分物质已略去)。含有氮元素、钾元素、磷元素的某些盐可以作为化肥。

①联合制碱法所制得的“碱”是指
②在①-③所涉及的操作方法中,包含过滤的是
③根据图,将化学方程式补充完整:NH3+CO2+
④NaHCO3溶于水电离的方程式
⑤下列说法中,正确的是
a.CO2可循环使用
b.副产物NH4Cl可用作肥料
c.溶液B中一定含有Na+、NH4+、Cl-
您最近一年使用:0次
解题方法
10 . (1)煤的利用可以是直接燃烧,也可以是先气化再燃烧 ,下面用等量的C分别按两途径进行反应
a. C(s)+O2(g) = CO2(g) △H =E1
b. C(s) +H2O(g)=CO(g)+H2 (g) △H =E2
H2(g)+ O2(g)=H2O(g ) △H =E3
O2(g)=H2O(g ) △H =E3
CO(s)+ O2(g)=CO2(g) △H =E4
O2(g)=CO2(g) △H =E4
甲同学认为:煤的气化效率高,所以b途径产生的热量高。乙同学认为,a、b途径产生的热量在理论上应该相同,你认为_____ 同学说法正确,理由是______________ 。
(2)在一元强碱MOH溶液中加入一元酸HA溶液,充分反应后,溶液呈中性。甲同学认为溶液中c(A-)=c(M+),而乙同学认为c(A-)是否等于 c(M+),要看一元酸HA是强酸还是弱酸。你认为_____ 同学说法正确,理由是______________
a. C(s)+O2(g) = CO2(g) △H =E1
b. C(s) +H2O(g)=CO(g)+H2 (g) △H =E2
H2(g)+
 O2(g)=H2O(g ) △H =E3
O2(g)=H2O(g ) △H =E3CO(s)+
 O2(g)=CO2(g) △H =E4
O2(g)=CO2(g) △H =E4甲同学认为:煤的气化效率高,所以b途径产生的热量高。乙同学认为,a、b途径产生的热量在理论上应该相同,你认为
(2)在一元强碱MOH溶液中加入一元酸HA溶液,充分反应后,溶液呈中性。甲同学认为溶液中c(A-)=c(M+),而乙同学认为c(A-)是否等于 c(M+),要看一元酸HA是强酸还是弱酸。你认为
您最近一年使用:0次



