名校
1 . 粗ZnS中S含量测定可采用“碘量法”测得。称取0.210g样品置于碘量瓶中,移取25.00mL0.1000mol/L的I2溶液于其中,并加入乙酸溶液,密闭,置于暗处反应10min,有单质S析出。以淀粉为指示剂,过量的I2用0.1000mol/L的Na2S2O3溶液滴定至终点。重复实验,数据如下:
已知:I2+2 =2I-+
=2I-+ ,假设杂质不参加反应。
,假设杂质不参加反应。
计算该样品中S元素的质量分数是____ %(保留小数点后一位);写出简要的计算过程。
| 序号 | 滴定前读数/mL | 滴定终点读数/mL |
| 1 | 0.28 | 10.30 |
| 2 | 0.08 | 11.26 |
| 3 | 1.34 | 11.32 |
已知:I2+2
 =2I-+
=2I-+ ,假设杂质不参加反应。
,假设杂质不参加反应。计算该样品中S元素的质量分数是
您最近一年使用:0次
名校
2 . 市售铁强化盐中铁含量测定。
已知:①铁强化盐中含有NaCl、KIO3、NaFeY,其中n(KIO3):n(NaFeY)=1:50,
②I2+2S2O =2I-+S4O
=2I-+S4O
称取m g样品,加稀硫酸溶解后配成100 mL溶液。取出10 mL,加入稍过量的KI溶液,充分反应后,滴入淀粉溶液,用c mol/L Na2S2O3标准溶液滴定,重复操作2~3次,消耗Na2S2O3标准溶液平均值为V mL。
(1)I-除了与Fe3+反应外,还可发生的反应的离子方程式为___________ 。
(2)样品中铁元素的质量分数为___________ (列出式子即可)。
已知:①铁强化盐中含有NaCl、KIO3、NaFeY,其中n(KIO3):n(NaFeY)=1:50,
②I2+2S2O
 =2I-+S4O
=2I-+S4O
称取m g样品,加稀硫酸溶解后配成100 mL溶液。取出10 mL,加入稍过量的KI溶液,充分反应后,滴入淀粉溶液,用c mol/L Na2S2O3标准溶液滴定,重复操作2~3次,消耗Na2S2O3标准溶液平均值为V mL。
(1)I-除了与Fe3+反应外,还可发生的反应的离子方程式为
(2)样品中铁元素的质量分数为
您最近一年使用:0次
名校
3 . A、B都是芳香族化合物,1molA水解得到1molB和1mol醋酸。A、B相对分子质量都不超过200,完全燃烧都只生成CO2和H2O,且B分子中碳和氢元素总的质量百分含量为65.2%(即质量分数为0.652)。A溶液具有酸性,不能使FeCl3溶液显色。
(1)A、B相对分子质量之差为___________ 。
(2)1个B分子中应该有___________ 个氧原子。
(3)A的分子式是___________ 。
(4) B可能有的三种结构简式是___________ 、___________ 、___________ 。
(1)A、B相对分子质量之差为
(2)1个B分子中应该有
(3)A的分子式是
(4) B可能有的三种结构简式是
您最近一年使用:0次
2021-06-18更新
|
519次组卷
|
2卷引用:甘肃省天水市一中2020-2021学年高二下学期第二阶段(期中)考试化学试题
4 . Ⅰ.(1)病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如右图所示。利用标签所提供的信息,计算该注射液中葡萄糖的物质的量浓度为____________ (保留两位有效数字);
(2)检查人的血液中葡萄糖(简称血糖)的含量,参考指标常以两种计量单位表示,即“mmol/L”和“mg/dL”(1L=10dL)。以“mmol/L”表示时,人的血糖正常值在3.61~6.11 mmol/L 之间。若某人的血糖检查结果为92mg/dL,他的血糖正常吗?_________ (填“正常”或“不正常”)
Ⅱ.现有0.270kg质量分数为10%的CuCl2溶液,计算
(1)溶液中CuCl2的物质的量为___________ ;
(2)要将溶液中的Cl-完全沉淀,需加入1.0 mol/L的AgNO3溶液_______ mL;
(3)要将溶液中的铜完全置换出来,需加入Fe 的质量为__________ 。

(2)检查人的血液中葡萄糖(简称血糖)的含量,参考指标常以两种计量单位表示,即“mmol/L”和“mg/dL”(1L=10dL)。以“mmol/L”表示时,人的血糖正常值在3.61~6.11 mmol/L 之间。若某人的血糖检查结果为92mg/dL,他的血糖正常吗?
Ⅱ.现有0.270kg质量分数为10%的CuCl2溶液,计算
(1)溶液中CuCl2的物质的量为
(2)要将溶液中的Cl-完全沉淀,需加入1.0 mol/L的AgNO3溶液
(3)要将溶液中的铜完全置换出来,需加入Fe 的质量为
您最近一年使用:0次
名校
5 . 现有一种铜粉和铝粉的混合物样品,为测定该样品中铝的含量,称取5.0g此样品置于锥形瓶中,将100mL稀盐酸加入其中恰好完全反应,剩余固体2.3g。
(1)求该混合物中铝的质量分数为多少?
(2)所用盐酸中溶质的物质的量浓度为多少?
(1)求该混合物中铝的质量分数为多少?
(2)所用盐酸中溶质的物质的量浓度为多少?
您最近一年使用:0次
2018-01-28更新
|
125次组卷
|
2卷引用:安徽省百花中学等四校联考2023-2024学年高二上学期11月期中化学试题
名校
6 . 肼是一种强还原剂,用NaClO与NH3反应可用于生产肼(N2H4),其反应的化学方程式为:NaClO+2NH3= N2H4+NaCl+H2O。
⑴生产1000 g质量分数为25.6%的肼溶液最少需要___________ L(标准状况)NH3。
⑵工业次氯酸钠溶液中含有氯酸钠会影响所得肼的产品质量。测定次氯酸钠样品中的氯酸钠含量的方法如下:取10.00 mL 碱性NaClO溶液试样,加入过量H2O2,将次氯酸钠完全还原( 在酸性条件下具有强氧化性,但碱性条件下几乎无氧化性),加热煮沸,冷却至室温,加入硫酸至酸性,再加入0.1000 mol·L-1 硫酸亚铁标准溶液30.00 mL,充分反应后,用0.01000 mol·L-1酸性K2Cr2O7溶液滴定至终点(
在酸性条件下具有强氧化性,但碱性条件下几乎无氧化性),加热煮沸,冷却至室温,加入硫酸至酸性,再加入0.1000 mol·L-1 硫酸亚铁标准溶液30.00 mL,充分反应后,用0.01000 mol·L-1酸性K2Cr2O7溶液滴定至终点( 被还原为Cr3+),消耗该溶液20.00 mL。
被还原为Cr3+),消耗该溶液20.00 mL。
①用H2O2与次氯酸钠反应的离子方程式为___________ 。
②实验中加热煮沸的目的是___________ 。
③计算样品中NaClO3的含量(以g·L-1表示),写出计算过程。___________
⑴生产1000 g质量分数为25.6%的肼溶液最少需要
⑵工业次氯酸钠溶液中含有氯酸钠会影响所得肼的产品质量。测定次氯酸钠样品中的氯酸钠含量的方法如下:取10.00 mL 碱性NaClO溶液试样,加入过量H2O2,将次氯酸钠完全还原(
 在酸性条件下具有强氧化性,但碱性条件下几乎无氧化性),加热煮沸,冷却至室温,加入硫酸至酸性,再加入0.1000 mol·L-1 硫酸亚铁标准溶液30.00 mL,充分反应后,用0.01000 mol·L-1酸性K2Cr2O7溶液滴定至终点(
在酸性条件下具有强氧化性,但碱性条件下几乎无氧化性),加热煮沸,冷却至室温,加入硫酸至酸性,再加入0.1000 mol·L-1 硫酸亚铁标准溶液30.00 mL,充分反应后,用0.01000 mol·L-1酸性K2Cr2O7溶液滴定至终点( 被还原为Cr3+),消耗该溶液20.00 mL。
被还原为Cr3+),消耗该溶液20.00 mL。①用H2O2与次氯酸钠反应的离子方程式为
②实验中加热煮沸的目的是
③计算样品中NaClO3的含量(以g·L-1表示),写出计算过程。
您最近一年使用:0次
2017-04-16更新
|
668次组卷
|
4卷引用:江苏省海安高级中学2019-2020学年高一下学期期中考试化学(必修)试题
2010·上海徐汇·一模
7 . 粉煤灰是燃煤电厂排出的工业废渣,其中含莫来石(Al6Si2O13)的质量分数为43.4%,还有含量较多的SiO2(其他成分不含Al和Si)。用粉煤灰和纯碱在高温下烧结,可制取NaAlSiO4(霞石)、Na2SiO3和NaAlO2,有关化学方程式为:
Al6Si2O13 + 3Na2CO3→ 2NaAlSiO4+ 4NaAlO2+ 3CO2↑ ①
Al6Si2O13 + 5Na2CO3→ 2Na2SiO3 + 6NaAlO2+ 5CO2↑ ②
SiO2+ Na2CO3→ Na2SiO3+ CO2↑ ③
(1)粉煤灰中铝的质量分数为________ % 。
(2)用1 mol Al6Si2O13 和 4 mol SiO2制得5mol NaAlO2、1mol NaAlSiO4,还应制得Na2SiO3____________ mol,共消耗Na2CO3________ mol(得到的固体中无SiO2)。
(3)若粉煤灰中 Al6Si2O13 与 SiO2的物质的量之比为1:2,则1kg粉煤灰与6mol Na2CO3反应(反应物全部都参与反应),可制得NaAlO2_________________ mol。
(4)若用100 mol Al6Si2O13同时生产NaAlSiO4和NaAlO2,且n(NaAlSiO4):n(NaAlO2) =x,消耗Na2CO3 ymol,试确定y与x的关系式________________ 。
Al6Si2O13 + 3Na2CO3→ 2NaAlSiO4+ 4NaAlO2+ 3CO2↑ ①
Al6Si2O13 + 5Na2CO3→ 2Na2SiO3 + 6NaAlO2+ 5CO2↑ ②
SiO2+ Na2CO3→ Na2SiO3+ CO2↑ ③
(1)粉煤灰中铝的质量分数为
(2)用1 mol Al6Si2O13 和 4 mol SiO2制得5mol NaAlO2、1mol NaAlSiO4,还应制得Na2SiO3
(3)若粉煤灰中 Al6Si2O13 与 SiO2的物质的量之比为1:2,则1kg粉煤灰与6mol Na2CO3反应(反应物全部都参与反应),可制得NaAlO2
(4)若用100 mol Al6Si2O13同时生产NaAlSiO4和NaAlO2,且n(NaAlSiO4):n(NaAlO2) =x,消耗Na2CO3 ymol,试确定y与x的关系式
您最近一年使用:0次
名校
解题方法
8 . 计算填空:
(1)NA是阿伏加德罗常数的值,如果ag某气体中含有的分子数为b,则cg该气体在标准状况下的体积是_______ 。
(2)标准状况下,1.6g某气态氧化物RO2的体积为0.56L,该气体的摩尔质量是_______ 。
(3)已知某VLK2SO4溶液中,含有K+mg,则溶液中 的物质的量浓度为
的物质的量浓度为_______ 。
(4)已知某浓盐酸密度为1.18g/mL,质量分数为36.5%,现需248mL1.0mol·L-1的稀盐酸,请计算实验室配制时需用量筒量取该浓盐酸_______ mL。
(1)NA是阿伏加德罗常数的值,如果ag某气体中含有的分子数为b,则cg该气体在标准状况下的体积是
(2)标准状况下,1.6g某气态氧化物RO2的体积为0.56L,该气体的摩尔质量是
(3)已知某VLK2SO4溶液中,含有K+mg,则溶液中
 的物质的量浓度为
的物质的量浓度为(4)已知某浓盐酸密度为1.18g/mL,质量分数为36.5%,现需248mL1.0mol·L-1的稀盐酸,请计算实验室配制时需用量筒量取该浓盐酸
您最近一年使用:0次
名校
解题方法
9 . 请根据物质的量的相关概念及计算公式,完成下列各题:
(1)请填写下表:
(2)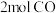 与
与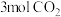 的质量之比
的质量之比__________ ;分子数之比为__________ ;含氧原子的数目之比为__________ 。
(3)将含杂质软锰矿粉末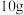 与足量浓盐酸共热(杂质不与盐酸反应),完全反应后,制得
与足量浓盐酸共热(杂质不与盐酸反应),完全反应后,制得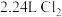 (标准状况下)。请回答下列问题:
(标准状况下)。请回答下列问题:
反应中被氧化的 的物质的量为
的物质的量为__________ mol,软锰矿中 的质量分数为
的质量分数为__________ 。
(1)请填写下表:
物质 | 摩尔质量 | 物质的量 | 质量 | 分子或离子数目 |
|
| |||
|
|
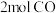 与
与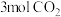 的质量之比
的质量之比(3)将含杂质软锰矿粉末
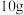 与足量浓盐酸共热(杂质不与盐酸反应),完全反应后,制得
与足量浓盐酸共热(杂质不与盐酸反应),完全反应后,制得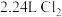 (标准状况下)。请回答下列问题:
(标准状况下)。请回答下列问题:反应中被氧化的
 的物质的量为
的物质的量为 的质量分数为
的质量分数为
您最近一年使用:0次
名校
解题方法
10 . 某工厂每天燃烧含硫质量分数为0.64%的煤100吨,如果煤中的硫元素全部转化为 气体,且产生的
气体,且产生的 全部用来生产硫酸,理论上每年(按365天计)可得到质量分数为98%的浓硫酸的质量为
全部用来生产硫酸,理论上每年(按365天计)可得到质量分数为98%的浓硫酸的质量为_______ 吨。
 气体,且产生的
气体,且产生的 全部用来生产硫酸,理论上每年(按365天计)可得到质量分数为98%的浓硫酸的质量为
全部用来生产硫酸,理论上每年(按365天计)可得到质量分数为98%的浓硫酸的质量为
您最近一年使用:0次