1 .  可用于光电材料,为测定某实验小组制得的产品中硫化氢的质量分数(设该产品中的其他成分不与
可用于光电材料,为测定某实验小组制得的产品中硫化氢的质量分数(设该产品中的其他成分不与 溶液反应):
溶液反应):
Ⅰ.取0.68000 g 产品,与足量
产品,与足量 溶液充分反应后。
溶液充分反应后。
Ⅱ.将生成的CuS置于已恒重、质量为31.230 g的坩埚中煅烧,恒重后总质量为32.814 g。
请计算:
(1)实验过程中化学科研工作者使用了950 mL 0.60000 mol/L 溶液,该试剂的物质的量为
溶液,该试剂的物质的量为___________ mol。
(2)Ⅱ中CuS煅烧成CuO,CuO的物质的量为___________ mol。
(3)产品中硫化氢的质量分数为___________ 。
 可用于光电材料,为测定某实验小组制得的产品中硫化氢的质量分数(设该产品中的其他成分不与
可用于光电材料,为测定某实验小组制得的产品中硫化氢的质量分数(设该产品中的其他成分不与 溶液反应):
溶液反应):Ⅰ.取0.68000 g
 产品,与足量
产品,与足量 溶液充分反应后。
溶液充分反应后。Ⅱ.将生成的CuS置于已恒重、质量为31.230 g的坩埚中煅烧,恒重后总质量为32.814 g。
请计算:
(1)实验过程中化学科研工作者使用了950 mL 0.60000 mol/L
 溶液,该试剂的物质的量为
溶液,该试剂的物质的量为(2)Ⅱ中CuS煅烧成CuO,CuO的物质的量为
(3)产品中硫化氢的质量分数为
您最近一年使用:0次
2 . 在潜水艇和消防员的呼吸面具中,常用 粉末作为氧气的来源。已知每人每小时消耗的
粉末作为氧气的来源。已知每人每小时消耗的 在标准状况下的体积约为
在标准状况下的体积约为 。请计算:
。请计算:
(1)每人每小时消耗 的物质的量约为
的物质的量约为_______  ;
;
(2)假设所需的氧气全部由 来提供,则每位消防员工作1小时所消耗
来提供,则每位消防员工作1小时所消耗 的质量为
的质量为_______  ;
;
(3)取久置呼吸面具中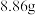 粉末溶于水(杂质为
粉末溶于水(杂质为 ),加入
),加入 盐酸完全反应至溶液呈中性,共消耗
盐酸完全反应至溶液呈中性,共消耗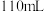 盐酸,则该呼吸面具中的
盐酸,则该呼吸面具中的 的质量分数为
的质量分数为_______ 。
 粉末作为氧气的来源。已知每人每小时消耗的
粉末作为氧气的来源。已知每人每小时消耗的 在标准状况下的体积约为
在标准状况下的体积约为 。请计算:
。请计算:(1)每人每小时消耗
 的物质的量约为
的物质的量约为 ;
;(2)假设所需的氧气全部由
 来提供,则每位消防员工作1小时所消耗
来提供,则每位消防员工作1小时所消耗 的质量为
的质量为 ;
;(3)取久置呼吸面具中
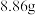 粉末溶于水(杂质为
粉末溶于水(杂质为 ),加入
),加入 盐酸完全反应至溶液呈中性,共消耗
盐酸完全反应至溶液呈中性,共消耗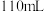 盐酸,则该呼吸面具中的
盐酸,则该呼吸面具中的 的质量分数为
的质量分数为
您最近一年使用:0次
解题方法
3 . 如图是某硫酸试剂瓶标签上的部分文字说明。请计算:
(1)H2SO4的摩尔质量为_____ g/mol。
(2)该试剂瓶中H2SO4的物质的量浓度为______ mol/L。
(3)取10mL该硫酸稀释至100mL,与足量锌粒充分反应求生成氢气的质量______ (写出计算过程)。
| 硫酸 500mL 化学式: H2SO4 密度: 1.84 g/cm3 质量分数: 98% |
(2)该试剂瓶中H2SO4的物质的量浓度为
(3)取10mL该硫酸稀释至100mL,与足量锌粒充分反应求生成氢气的质量
您最近一年使用:0次
2023-01-07更新
|
311次组卷
|
2卷引用:2021年河南省普通高中学生学业水平考试化学试题
解题方法
4 . 某研究性学习小组利用酸性 溶液测定护校河中溶解的
溶液测定护校河中溶解的 的含量。其测定反应原理:
的含量。其测定反应原理: 。现将
。现将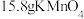 固体溶于水配成
固体溶于水配成 溶液,稀释100倍后,取稀释后的
溶液,稀释100倍后,取稀释后的 溶液
溶液 溶液与
溶液与 河水反应恰好褪色。请计算:
河水反应恰好褪色。请计算:
(1)稀释后的 溶液的物质的量浓度为
溶液的物质的量浓度为___________  。
。
(2)护校河中 的含量为
的含量为___________ 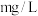 。
。
(3)城乡污水排放一级标准是: 的浓度不超过
的浓度不超过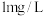 为合格,则该护校河中硫化氢含量
为合格,则该护校河中硫化氢含量___________ (填“合格”或“不合格”)。
 溶液测定护校河中溶解的
溶液测定护校河中溶解的 的含量。其测定反应原理:
的含量。其测定反应原理: 。现将
。现将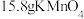 固体溶于水配成
固体溶于水配成 溶液,稀释100倍后,取稀释后的
溶液,稀释100倍后,取稀释后的 溶液
溶液 溶液与
溶液与 河水反应恰好褪色。请计算:
河水反应恰好褪色。请计算:(1)稀释后的
 溶液的物质的量浓度为
溶液的物质的量浓度为 。
。(2)护校河中
 的含量为
的含量为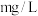 。
。(3)城乡污水排放一级标准是:
 的浓度不超过
的浓度不超过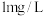 为合格,则该护校河中硫化氢含量
为合格,则该护校河中硫化氢含量
您最近一年使用:0次
5 . 已知10g铁铜混合物与100mL一定浓度的盐酸恰好完全反应,得到标准状况下2.24L的 。请计算:
。请计算:
(1)反应生成 的物质的量为
的物质的量为__________ mol。
(2)该盐酸的物质的量浓度为________________ 。
(3)该混合物中铁的质量分数为________________ 。
 。请计算:
。请计算:(1)反应生成
 的物质的量为
的物质的量为(2)该盐酸的物质的量浓度为
(3)该混合物中铁的质量分数为
您最近一年使用:0次
2020-10-04更新
|
1459次组卷
|
3卷引用:河南省漯河市2021级普通高中学业水平模拟考试化学试题
名校
解题方法
6 . 为测定某抗酸药中碳酸钙固体的纯度(另一种成分为淀粉),称取12.5g此药片置于烧杯中,加入过量的稀盐酸,测得反应过程中烧杯和药品的总重量随时间的变化数据如下:
计算:(1)共收集到标准状况下CO2的体积____________________ ;
(2)该样品中碳酸钙的质量分数________________________ 。
| 反应时间/s | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 烧杯和药品的总重/g | 310.0 | 306.8 | 305.9 | 305.7 | 305.6 | 305.6 | 305.6 |
(2)该样品中碳酸钙的质量分数
您最近一年使用:0次
2011高三·上海·学业考试
解题方法
7 . 氨气和氧气在催化剂存在下的反应方程式为4NH3+5O2 4NO+6H2O,完成下列计算:
4NO+6H2O,完成下列计算:
(1)生成1 mol NO消耗氧气的体积为__________ L(标准状况)。
(2)5 mol NH3和5 molO2反应生成4 mol NO,过量的氨溶于产物水中成为氨水,计算该氨水中氨的质量分数。_______
(3)如果没有催化剂,氨氧化生成NO的同时也生成氮气:4NH3+3O2=2N2+6H2O。若4 mol NH3和4 molO2恰好完全反应,计算产物气体中NO的物质的量。_________
 4NO+6H2O,完成下列计算:
4NO+6H2O,完成下列计算:(1)生成1 mol NO消耗氧气的体积为
(2)5 mol NH3和5 molO2反应生成4 mol NO,过量的氨溶于产物水中成为氨水,计算该氨水中氨的质量分数。
(3)如果没有催化剂,氨氧化生成NO的同时也生成氮气:4NH3+3O2=2N2+6H2O。若4 mol NH3和4 molO2恰好完全反应,计算产物气体中NO的物质的量。
您最近一年使用:0次
2014高二·上海·学业考试
8 . 电解饱和食盐水是一项重要的化学工业,其反应原理为:2NaCl+2H2O 2NaOH+H2↑+Cl2↑,完成下列计算:
2NaOH+H2↑+Cl2↑,完成下列计算:
(1)当电解产生0.2 mol NaOH时,能收集到标准状况下的H2____________ L。
(2)电解生成的氯气和氢气可以化合生成氯化氢。某工厂每天电解400t食盐,若生成的氯气80%用于生产盐酸,每天最多可生产31%的盐酸___________ t。
(3)已知室温时饱和食盐水的溶质质量分数为0.265,取200g饱和食盐水进行电解,当NaCl反应了一半时停止电解,分别求出所得混合溶液中NaCl和NaOH的质量分数。(写出计算过程,保留3位小数)___________
 2NaOH+H2↑+Cl2↑,完成下列计算:
2NaOH+H2↑+Cl2↑,完成下列计算:(1)当电解产生0.2 mol NaOH时,能收集到标准状况下的H2
(2)电解生成的氯气和氢气可以化合生成氯化氢。某工厂每天电解400t食盐,若生成的氯气80%用于生产盐酸,每天最多可生产31%的盐酸
(3)已知室温时饱和食盐水的溶质质量分数为0.265,取200g饱和食盐水进行电解,当NaCl反应了一半时停止电解,分别求出所得混合溶液中NaCl和NaOH的质量分数。(写出计算过程,保留3位小数)
您最近一年使用:0次
9 . 某抗酸药(主要成分)每片含有氢氧化铝 250 毫克。某同学为测定该药中氢氧化铝的质量分数,进行如下操作:取一片质量为 0.5g 的药片研碎后加 20mL 蒸馏水,然后加入质量分数为 5%的盐酸至完全反应(其他成分不与盐酸反应),测得实验中反应掉的盐酸 7.3g。试通过计算:
(1)判断该药片中氢氧化铝的质量是否达到标准?_______________
(2)该药片中氢氧化铝的质量分数是多少?_________________
(1)判断该药片中氢氧化铝的质量是否达到标准?
(2)该药片中氢氧化铝的质量分数是多少?
您最近一年使用:0次



