真题
名校
1 . Na2SO3·7H2O是食品工业中常用的漂白剂、抗氧化剂和防腐剂。Na2SO3在30℃时的溶解度为35.5g/100gH2O。
1)计算30℃时Na2SO3饱和溶液中Na2SO3的质量分数
________ 。(保留2位小数)
2)计算30℃时271g Na2SO3饱和溶液中水的质量___________ 。
3)将30℃的Na2SO3饱和溶液271g冷却到10℃,析出Na2SO3·7H2O晶体79.5g。计算10℃时Na2SO3在水中的溶解度__________ 。
1)计算30℃时Na2SO3饱和溶液中Na2SO3的质量分数

2)计算30℃时271g Na2SO3饱和溶液中水的质量
3)将30℃的Na2SO3饱和溶液271g冷却到10℃,析出Na2SO3·7H2O晶体79.5g。计算10℃时Na2SO3在水中的溶解度
您最近一年使用:0次
2020-08-21更新
|
163次组卷
|
4卷引用:2010年全国普通高等学校招生统一考试上海卷化学试题
真题
2 . 氨和联氨(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用。
根据题意完成下列计算:
(1)联氨用亚硝酸氧化生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,计算确定该氢化物的分子式___________ 。该氢化物受撞击则完全分解为氮气和氢气。4.30 g该氢化物受撞击后产生的气体在标准状况下的体积为___________ L。
(2)联氨和四氧化二氮可用作火箭推进剂,联氨是燃料,四氧化二氮作氧化剂,反应产物是氮气和水。
由联氨和四氧化二氮组成的火箭推进剂完全反应生成72.0 kg水,计算推进剂中联氨的质量___________ 。
(3)氨的水溶液可用于吸收NO与NO2混合气体,反应方程式为6NO+ 4NH3=5N2+6H2O,6NO2+ 8NH3=7N2+12H2O;NO与NO2混合气体180 mol被8.90×103g氨水(质量分数0.300)完全吸收,产生156 mol氮气。吸收后氨水密度为0.980 g/cm3。计算:①该混合气体中NO与NO2的体积比____________ 。②吸收后氨水的物质的量浓度_______________ (答案保留1位小数)。
(4)氨和二氧化碳反应可生成尿素CO(NH2)2。尿素在一定条件下会失去氨而缩合,如两分子尿素失去一分子氨形成二聚物:
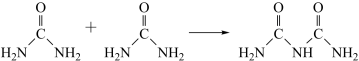 +NH3
+NH3
已知常压下120 mol CO(NH2)2在熔融状态发生缩合反应,失去80 mol NH3,生成二聚物(C2H5N3O2)和三聚物。测得缩合产物中二聚物的物质的量分数为0.60,推算缩合产物中各缩合物的物质的量之比__________ 。
根据题意完成下列计算:
(1)联氨用亚硝酸氧化生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,计算确定该氢化物的分子式
(2)联氨和四氧化二氮可用作火箭推进剂,联氨是燃料,四氧化二氮作氧化剂,反应产物是氮气和水。
由联氨和四氧化二氮组成的火箭推进剂完全反应生成72.0 kg水,计算推进剂中联氨的质量
(3)氨的水溶液可用于吸收NO与NO2混合气体,反应方程式为6NO+ 4NH3=5N2+6H2O,6NO2+ 8NH3=7N2+12H2O;NO与NO2混合气体180 mol被8.90×103g氨水(质量分数0.300)完全吸收,产生156 mol氮气。吸收后氨水密度为0.980 g/cm3。计算:①该混合气体中NO与NO2的体积比
(4)氨和二氧化碳反应可生成尿素CO(NH2)2。尿素在一定条件下会失去氨而缩合,如两分子尿素失去一分子氨形成二聚物:
 +NH3
+NH3已知常压下120 mol CO(NH2)2在熔融状态发生缩合反应,失去80 mol NH3,生成二聚物(C2H5N3O2)和三聚物。测得缩合产物中二聚物的物质的量分数为0.60,推算缩合产物中各缩合物的物质的量之比
您最近一年使用:0次
真题
3 . 为测定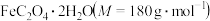 样品的纯度,用硫酸溶解6.300 g样品,定容至250 mL。取25.00 mL溶液,用
样品的纯度,用硫酸溶解6.300 g样品,定容至250 mL。取25.00 mL溶液,用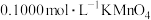 标准溶液滴定至终点。重复实验,数据如下:
标准溶液滴定至终点。重复实验,数据如下:
已知: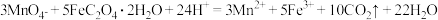
假设杂质不参加反应。
该样品中 的质量分数是
的质量分数是________ %(保留小数点后一位);
写出简要计算过程:________ 。
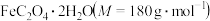 样品的纯度,用硫酸溶解6.300 g样品,定容至250 mL。取25.00 mL溶液,用
样品的纯度,用硫酸溶解6.300 g样品,定容至250 mL。取25.00 mL溶液,用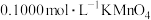 标准溶液滴定至终点。重复实验,数据如下:
标准溶液滴定至终点。重复实验,数据如下:| 序号 | 滴定前读数/mL | 滴定终点读数/mL |
| 1 | 0.00 | 19.98 |
| 2 | 1.26 | 22.40 |
| 3 | 1.54 | 21.56 |
已知:
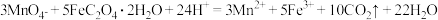
假设杂质不参加反应。
该样品中
 的质量分数是
的质量分数是写出简要计算过程:
您最近一年使用:0次
2020-01-10更新
|
3873次组卷
|
17卷引用:2020年浙江省高考化学试卷(1月选考)
2020年浙江省高考化学试卷(1月选考)(已下线)浙江省2020年1月选考(学考)化学试题专题5.3 化学计算(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升浙江省丽水市松阳县第二中学2019-2020学年高二4月线上教学检测化学试题(已下线)解密02 物质的量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密02 物质的量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)专题18.化学计算-十年(2012-2021)高考化学真题分项汇编(浙江专用)(已下线)专题13 化学实验-备战2022年高考化学学霸纠错(全国通用)(已下线)解密02 物质的量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密02 物质的量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)专题2 样品纯度专练(已下线)考点52 定量分析-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)题型43 氧化还原滴定——高锰酸钾法(已下线)题型41 氧化还原滴定——高锰酸钾法(已下线)第03讲 物质的量在化学方程式计算中的应用(讲义)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)
真题
名校
4 . 一定量的氢气在氯气中燃烧,所得混合物用100mL 3.00mol/L的NaOH溶液(密度为1.12g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500mol。
(1)原NaOH溶液的质量分数为___________
(2)所得溶液中Cl-的物质的量为_______ mol
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)=_____________ 。
(1)原NaOH溶液的质量分数为
(2)所得溶液中Cl-的物质的量为
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)=
您最近一年使用:0次
2016-12-08更新
|
1515次组卷
|
24卷引用:2007年普通高等学校招生全国统一考试(上海卷)化学试题
2007年普通高等学校招生全国统一考试(上海卷)化学试题(已下线)2011届江西省南昌一中高三第一次月考化学试题(已下线)2010—2011学年黑龙江省鹤岗一中高二下学期期末考试化学试卷(已下线)2011-2012学年河北省唐山市第一中学高一上学期期中考试化学试卷(已下线)2012届安徽省蚌埠二中高三上学期期中考试化学试卷(已下线)2013-2014学年浙江省杭州地区六校高二下学期期中联考化学试卷(已下线)2015届江西省南昌市三校高三上第一次联考化学试卷(已下线)2015河北保定某重点中学同步作业(必修1苏教版)2.1氯气的生产原理和性质2015-2016学年吉林省吉林第一中学高一入学摸底化学试卷2016届江西省靖安中学高三上学期第一次月考化学试卷2016-2017学年河北省石家庄市第一中学高一上学期期末考试化学试卷河南省郑州市第一中学2017-2018学年高一上学期期中考试化学试题【全国百强校】浙江省余姚中学2018-2019学年高一上学期期中考试化学试题【全国百强校】江苏省启东中学2018-2019学年高一下学期3月月考化学试题宁夏回族自治区石嘴山市第三中学2019-2020学年高一上学期期中考试化学试题(已下线)【新东方】高中化学5037(已下线)上海市长宁区2011届高三上学期期末质量调研化学试题上海理工大附中2014-2015学年高一上学期期末化学试卷高一必修第一册(鲁科2019)第1章第3节 化学中常用的物理量——物质的量人教版(2019)高一必修第一册 第二章 海水中的重要元素 第三节 物质的量(已下线)【新东方】【2019】【高一上】【期中考】【JYZ】【化学】(已下线)【浙江新东方】10山东省泰安肥城市2020-2021学年高一上学期期中考试化学试题(已下线)【2022】【高一下】【长征中学】【期中考】【高中化学】【赵涛收集】
真题
5 . 氨碱法制纯碱包括石灰石分解、粗盐水精制、氨盐水碳酸化等基本步骤,完成下列计算:
(1).CaCO3质量分数为0.90的石灰石100 kg完成分解产生CO2______ L(标准状况)。石灰窑中,该石灰石100 kg与焦炭混合焙烧,产生CO229120 L(标准状况),如果石灰石中碳酸钙完全分解,且焦炭完全燃烧,不产生CO,则焦炭的物质的量为______ mol。
(2).已知粗盐水含MgCl26.80 mol/m3,含CaCl23.00mol/m3。向粗盐水中加入Ca(OH)2除镁离子:MgCl2+ Ca(OH)2→ Mg(OH)2↓ + CaCl2,然后加入Na2CO3除钙离子。处理上述粗盐水10 m3,至少需要加Na2CO3_____ g。如果用碳酸化尾气(含NH3体积分数为0.100、CO2体积分数0.040)代替碳酸钠,发生如下反应:Ca2++ 2NH3+ CO2+ H2O → CaCO3↓ + 2NH4+,处理上述10 m3粗盐水至少需要通入______ L(标准状况)碳酸化尾气。
(3).某氨盐水含氯化钠1521 kg,通入二氧化碳后析出碳酸氢钠晶体,过滤后溶液中含氯化铵1070 kg。列式计算:
①过滤后溶液中氯化钠的质量____________ 。
②析出的碳酸氢钠晶体的质量____________ 。
(1).CaCO3质量分数为0.90的石灰石100 kg完成分解产生CO2
(2).已知粗盐水含MgCl26.80 mol/m3,含CaCl23.00mol/m3。向粗盐水中加入Ca(OH)2除镁离子:MgCl2+ Ca(OH)2→ Mg(OH)2↓ + CaCl2,然后加入Na2CO3除钙离子。处理上述粗盐水10 m3,至少需要加Na2CO3
(3).某氨盐水含氯化钠1521 kg,通入二氧化碳后析出碳酸氢钠晶体,过滤后溶液中含氯化铵1070 kg。列式计算:
①过滤后溶液中氯化钠的质量
②析出的碳酸氢钠晶体的质量
您最近一年使用:0次
真题
解题方法
6 . 硫有多种含氧酸,亚硫酸(H2SO3)、硫酸(H2SO4)、焦硫酸(H2SO4·SO3)、硫代硫酸(H2S2O3)等等,其中硫酸最为重要,在工业上有广泛的应用。在实验室,浓硫酸是常用的干燥剂。完成下列计算:
(1)焦硫酸(H2SO4·SO3)溶于水,其中的SO3都转化为硫酸。若将445g焦硫酸溶于水配成4.00L硫酸,该硫酸的物质的量浓度为________ mol/L。
(2)若以浓硫酸吸水后生成的H2SO4·H2O计算,250g质量分数为98%的硫酸能吸收_____ g水
(3)硫铁矿是工业上制硫酸的主要原料。硫铁矿氧化焙烧的化学反应如下:
3FeS2+8O2=Fe3O4+6SO2 4FeS2+11 O2=2Fe2O3+8SO2
若48mol FeS2完全反应耗用氧气2934.4L(标准状况),计算反应产物中Fe3O4与Fe2O3物质的量之比_______ 。
(4)用硫化氢制取硫酸,既能充分利用资源又能保护环境,是一种很有发展前途的制备硫酸的方法。
硫化氢体积分数为0.84的混合气体(H2S、H2O、N2)在空气中完全燃烧,若空气过量77%,计算产物气体中SO2体积分数________ (水是气体)。(已知空气组成:N2体积分数0.79、O2体积分数0.21)
(1)焦硫酸(H2SO4·SO3)溶于水,其中的SO3都转化为硫酸。若将445g焦硫酸溶于水配成4.00L硫酸,该硫酸的物质的量浓度为
(2)若以浓硫酸吸水后生成的H2SO4·H2O计算,250g质量分数为98%的硫酸能吸收
(3)硫铁矿是工业上制硫酸的主要原料。硫铁矿氧化焙烧的化学反应如下:
3FeS2+8O2=Fe3O4+6SO2 4FeS2+11 O2=2Fe2O3+8SO2
若48mol FeS2完全反应耗用氧气2934.4L(标准状况),计算反应产物中Fe3O4与Fe2O3物质的量之比
(4)用硫化氢制取硫酸,既能充分利用资源又能保护环境,是一种很有发展前途的制备硫酸的方法。
硫化氢体积分数为0.84的混合气体(H2S、H2O、N2)在空气中完全燃烧,若空气过量77%,计算产物气体中SO2体积分数
您最近一年使用:0次
真题
7 . 钾是活泼的碱金属,钾和氧有氧化钾(K2O)、过氧化钾(K2O2)和超氧化钾(KO2)等多种化合物。
(1)钾和硝酸钾反应可制得K2O(10K+2KNO3→6K2O+N2),39.0g钾与10.1g硝酸钾充分反应生成K2O的质量为__________ g。
(2)某过氧化钾样品中氧的质量分数(杂质不含氧)为0.28,则样品中K2O2的质量分数为__________ 。
(3)超氧化钾和二氧化碳反应生成氧气(4KO2+2CO2→2K2CO3+3O2),在医院、矿井、潜水、高空飞行中用作供氧剂。13.2L(标准状况)CO2和KO2反应后,气体体积变为18.8L (标准状况),计算反应消耗的KO2的质量________
(4)KO2加热至600℃部分分解得到产物A。6.30g产物A充分吸收二氧化碳生成碳酸钾并产生氧气1.12L(标准状况),试确定产物A中钾氧两种原子个数之比。如果产物A只含有两种化合物,写出所有可能的化学式并计算A中两种化合物的物质的量之比_______
_______________ 。
(1)钾和硝酸钾反应可制得K2O(10K+2KNO3→6K2O+N2),39.0g钾与10.1g硝酸钾充分反应生成K2O的质量为
(2)某过氧化钾样品中氧的质量分数(杂质不含氧)为0.28,则样品中K2O2的质量分数为
(3)超氧化钾和二氧化碳反应生成氧气(4KO2+2CO2→2K2CO3+3O2),在医院、矿井、潜水、高空飞行中用作供氧剂。13.2L(标准状况)CO2和KO2反应后,气体体积变为18.8L (标准状况),计算反应消耗的KO2的质量
(4)KO2加热至600℃部分分解得到产物A。6.30g产物A充分吸收二氧化碳生成碳酸钾并产生氧气1.12L(标准状况),试确定产物A中钾氧两种原子个数之比。如果产物A只含有两种化合物,写出所有可能的化学式并计算A中两种化合物的物质的量之比
您最近一年使用:0次
8 . 小苏打、胃舒、平达喜都是常用的中和胃酸的药物。
(1)小苏打片每片含0.5g NaHCO3,2片小苏打片和胃酸完全中和,被中和的H+是___________ mol。
(2)胃舒平每片含0.245g Al(OH)3。中和胃酸时,6片小苏打片相当于胃舒平_____ 片。
(3)达喜的化学成分是铝和镁的碱式盐。
①取该碱式盐3.01g,加入2.0mol·L-1盐酸使其溶解,当加入盐酸42.5mL时,开始产生CO2,加入盐酸至45.0mL时正好反应完全,计算该碱式盐样品中氢氧根与碳酸根的物质的量之比。________
②在上述碱式盐溶于盐酸后的溶液中加入过量的氢氧化钠,过滤,沉淀物进行干燥后重1.74g,若该碱式盐中氢元素的质量分数为0.040,试推测该碱式盐的化学式。
________
(1)小苏打片每片含0.5g NaHCO3,2片小苏打片和胃酸完全中和,被中和的H+是
(2)胃舒平每片含0.245g Al(OH)3。中和胃酸时,6片小苏打片相当于胃舒平
(3)达喜的化学成分是铝和镁的碱式盐。
①取该碱式盐3.01g,加入2.0mol·L-1盐酸使其溶解,当加入盐酸42.5mL时,开始产生CO2,加入盐酸至45.0mL时正好反应完全,计算该碱式盐样品中氢氧根与碳酸根的物质的量之比。
②在上述碱式盐溶于盐酸后的溶液中加入过量的氢氧化钠,过滤,沉淀物进行干燥后重1.74g,若该碱式盐中氢元素的质量分数为0.040,试推测该碱式盐的化学式。
您最近一年使用:0次
9 . 在隔绝空气的条件下,某同学将一块部分被氧化的钠块用一张已除去氧化膜、并用针刺一些小孔的铝箔包好,然后放入盛满水且倒置于水槽中的容器内。待钠块反应完全后,在容器中仅收集到1.12 L氢气(标准状况),此时测得铝箔质量比反应前减少了0.27 g,水槽和容器内溶液的总体积为2.0 L,溶液中NaOH的浓度为0.050 mol·L-1(忽略溶液中离子的水解和溶解的氢气的量)。
(1)写出该实验中发生反应的化学方程式:_____________ _____________ _____________
(2)试通过计算确定该钠块中钠元素的质量分数为_________
(1)写出该实验中发生反应的化学方程式:
(2)试通过计算确定该钠块中钠元素的质量分数为
您最近一年使用:0次
2009-11-17更新
|
1655次组卷
|
3卷引用:2007年普通高等学校招生全国统一考试(江苏卷)化学试题



