解题方法
1 . SO2在生产生活中有重要的应用,处理不当会造成环境污染。回答下列问题:
(1)标准状况下16.0gSO2的体积为______ L,与______ molH2O中所含氧原子数相等。
(2)为测定某工厂废气中SO2的含量,课外小组的同学将废气样品经过管道通入密闭容器中的100mL0.1000mol•L-1的酸性高锰酸钾溶液。反应原理为:5SO2+2MnO +2H2O=5SO
+2H2O=5SO +2Mn2++4H+。
+2Mn2++4H+。
①该反应中被还原的元素是_____ 。
②100mL该酸性高锰酸钾溶液恰好完全反应时,转移电子的数目为______ 。
③若通入管道的废气样品为am3时,酸性高锰酸钾溶液恰好褪色,则该废气样品中SO2的含量为______ g•m-3(用含a的表达式表示,假定样品中其它气体均不参与反应,SO2可被溶液充分吸收)。
④实验需240mL0.500mol•L-1的硫酸溶液,使用的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管、_____ ;需用量筒量取密度为1.84g•cm-3,质量分数为98%的浓硫酸_____ mL;若定容时俯视刻度线,则所配溶液的浓度______ (填“偏高”、“偏低”或“不变”)。
(1)标准状况下16.0gSO2的体积为
(2)为测定某工厂废气中SO2的含量,课外小组的同学将废气样品经过管道通入密闭容器中的100mL0.1000mol•L-1的酸性高锰酸钾溶液。反应原理为:5SO2+2MnO
 +2H2O=5SO
+2H2O=5SO +2Mn2++4H+。
+2Mn2++4H+。①该反应中被还原的元素是
②100mL该酸性高锰酸钾溶液恰好完全反应时,转移电子的数目为
③若通入管道的废气样品为am3时,酸性高锰酸钾溶液恰好褪色,则该废气样品中SO2的含量为
④实验需240mL0.500mol•L-1的硫酸溶液,使用的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管、
您最近一年使用:0次
名校
2 . A、B都是芳香族化合物,1molA水解得到1molB和1mol醋酸。A、B相对分子质量都不超过200,完全燃烧都只生成CO2和H2O,且B分子中碳和氢元素总的质量百分含量为65.2%(即质量分数为0.652)。A溶液具有酸性,不能使FeCl3溶液显色。
(1)A、B相对分子质量之差为___________ 。
(2)1个B分子中应该有___________ 个氧原子。
(3)A的分子式是___________ 。
(4) B可能有的三种结构简式是___________ 、___________ 、___________ 。
(1)A、B相对分子质量之差为
(2)1个B分子中应该有
(3)A的分子式是
(4) B可能有的三种结构简式是
您最近一年使用:0次
2021-06-18更新
|
517次组卷
|
2卷引用:河北省邯郸市大名县第一中学2021-2022学年高二下学期第一次月考化学试题
20-21高一下·浙江·阶段练习
解题方法
3 . 某种胃药的有效成分为碳酸钙,某实验小组为测定其中碳酸钙的含量,取10粒药片(0.1 g/粒)研碎后溶解。加入25.00 mL 1.0 mol/L的稀盐酸反应,最后用1.0 mol/LNaOH溶液中和过量的盐酸,测定所消耗的NaOH的溶液体积如下:
(1)配制100 mL 1.0 mol/L的稀盐酸,需要2.5 mol/L的盐酸的体积为___________ mL。
(2)药片中碳酸钙的质量分数为___________ 。
| 测定次数 | 第1次 | 第2次 | 第3次 | 第4次 |
| V(NaOH)/mL | 13.00 | 12.90 | 11.40 | 13.10 |
(1)配制100 mL 1.0 mol/L的稀盐酸,需要2.5 mol/L的盐酸的体积为
(2)药片中碳酸钙的质量分数为
您最近一年使用:0次
解题方法
4 . I.科学研究小组的同学为测定某Na2CO3和NaHCO3混合物中Na2CO3的质量分数,进行了下列相关实验。其实验流程如下:
(1)该实验需要用到1.50 mol/L的稀盐酸500 mL,但实验室只有12.0 mol/L的浓盐酸。则配制稀盐酸所用浓盐酸_______ mL。
(2)若实验中测得样品质量为46.4 g,固体质量为40.95 g,请列式计算碳酸钠的质量分数_______ (保留3位有效数字)。
II.为测定某氯化亚铜样品中CuCl的含量,某同学设计如下实验:准确称取氯化亚铜样品m g,将其置于过量的FeCl3溶液中,待固体完全溶解后,加入适量稀硫酸,用a mol/L的K2Cr2O7溶液氧化反应生成的Fe2+,消耗K2Cr2O7溶液b mL,反应中 被还原为Cr3+。请列式计算样品中CuCl的质量分数
被还原为Cr3+。请列式计算样品中CuCl的质量分数_______ 。
(1)该实验需要用到1.50 mol/L的稀盐酸500 mL,但实验室只有12.0 mol/L的浓盐酸。则配制稀盐酸所用浓盐酸
(2)若实验中测得样品质量为46.4 g,固体质量为40.95 g,请列式计算碳酸钠的质量分数
II.为测定某氯化亚铜样品中CuCl的含量,某同学设计如下实验:准确称取氯化亚铜样品m g,将其置于过量的FeCl3溶液中,待固体完全溶解后,加入适量稀硫酸,用a mol/L的K2Cr2O7溶液氧化反应生成的Fe2+,消耗K2Cr2O7溶液b mL,反应中
 被还原为Cr3+。请列式计算样品中CuCl的质量分数
被还原为Cr3+。请列式计算样品中CuCl的质量分数
您最近一年使用:0次
2021-01-27更新
|
261次组卷
|
2卷引用:河北省衡水市第十四中学2020-2021学年高一下学期一调考试化学试题
名校
解题方法
5 . 计算:
(1)agNa2S中含b个Na+,则阿伏加德罗常数为__ (用含a、b的代数式表示)
(2)OH-与H2O数目之比为1:20的KOH水溶液中,溶质(KOH)的质量分数是__ %(结果保留一位小数)
(3)病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如图所示。利用标签所提供的信息,回答下列问题:
①葡萄糖的摩尔质量为___ ;
②该注射液中葡萄糖的物质的量浓度为___ 。(保留两位小数)
③检测人的血液中葡萄糖(简称血糖)的含量,参考指标常以两种计量单位表示,即“mmol/L”和“mg/dL”(1L=10dL;1mol=1000mmol)。以“mmol/L”表示时,人的血糖正常值在3.6~6.1mmol/L之间。如果以“mg/dL”表示,血糖正常值范围是___ 。(结果保留1位小数)
(1)agNa2S中含b个Na+,则阿伏加德罗常数为
(2)OH-与H2O数目之比为1:20的KOH水溶液中,溶质(KOH)的质量分数是
(3)病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如图所示。利用标签所提供的信息,回答下列问题:
| 5%葡萄糖注射液 1000mL [性状]本品为无色或几 乎无色的透明 晶体。味甜。 [规格] 1000mL, 50g。 [贮藏]密闭保存。 |
①葡萄糖的摩尔质量为
②该注射液中葡萄糖的物质的量浓度为
③检测人的血液中葡萄糖(简称血糖)的含量,参考指标常以两种计量单位表示,即“mmol/L”和“mg/dL”(1L=10dL;1mol=1000mmol)。以“mmol/L”表示时,人的血糖正常值在3.6~6.1mmol/L之间。如果以“mg/dL”表示,血糖正常值范围是
您最近一年使用:0次
解题方法
6 . 化学兴趣小组按如图实验测定部分变质的NaOH固体中Na2CO3的含量。
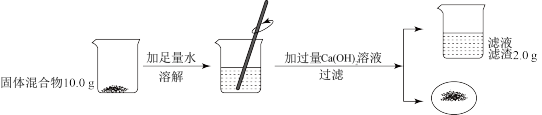
(1)根据题中信息_______ (填“能”或“不能”)计算Ca(OH)2溶液的质量分数。
(2)计算固体混合物中Na2CO3的质量_______ 。

(1)根据题中信息
(2)计算固体混合物中Na2CO3的质量
您最近一年使用:0次
20-21高一上·全国·阶段练习
7 . 医学上常用酸性高锰酸钾溶液和草酸溶液的反应用于测定血钙的含量。回答下列问题:
(1)配平以下离子方程式,并填上所需的微粒。
___ H++___ MnO4−+___ H2C2O4 ══___ CO2↑+___ Mn2++___ 。
(2)该反应中的还原剂是___ 。
(3)反应转移了0.4mol电子,则消耗KMnO4的物质的量为___ mol。
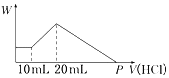
(4) 将一定质量的镁铝合金投入100mL一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加5mol·L-1的NaOH溶液到过量,生成沉淀的质量与加入的NaOH溶液的体积关系如图所示。
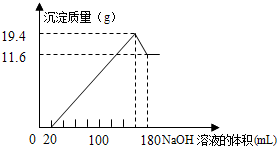
①原合金Al的质量分数是______ ;
②盐酸的物质的量浓度是________ 。

(1)配平以下离子方程式,并填上所需的微粒。
(2)该反应中的还原剂是
(3)反应转移了0.4mol电子,则消耗KMnO4的物质的量为
(4) 将一定质量的镁铝合金投入100mL一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加5mol·L-1的NaOH溶液到过量,生成沉淀的质量与加入的NaOH溶液的体积关系如图所示。

①原合金Al的质量分数是
②盐酸的物质的量浓度是
您最近一年使用:0次
名校
解题方法
8 . 三聚氰胺最早被李比希于1834年合成,它有毒,不可用于食品加工或食品添加剂。经李比希法分析得知,三聚氰胺分子中,氮元素的含量高达66.67%,氢元素的质量分数为4.76%,其余为碳元素。它的相对分子质量大于100,但小于150。试回答下列问题:
(1)分子式中原子个数比N(C)∶N(H)∶N(N)=_____________ 。
(2)三聚氰胺分子中碳原子数为_____________ ,理由是(写出计算式)_____________ 。
(3)三聚氰胺的分子式为_____________ 。
(4)若核磁共振氢谱显示只有1个吸收峰,红外光谱表征有1个由碳氮两种元素组成的六元杂环。则三聚氰胺的结构简式为______ 。
(1)分子式中原子个数比N(C)∶N(H)∶N(N)=
(2)三聚氰胺分子中碳原子数为
(3)三聚氰胺的分子式为
(4)若核磁共振氢谱显示只有1个吸收峰,红外光谱表征有1个由碳氮两种元素组成的六元杂环。则三聚氰胺的结构简式为
您最近一年使用:0次
2020-07-30更新
|
546次组卷
|
4卷引用:江西省南昌市外国语学校2021-2022学年高二下学期第一次月考化学(理科)试题
名校
解题方法
9 . 为测定 K2[Cu(C2O4)2]·2H2O(M=354g/mol)含量,准确称取试样1.000g溶于 NH3·H2O中,并加水定容至250mL,取试样溶液25.00mL于锥形瓶中,再加入10mL 3.000mol/L的H2SO4溶液,用0.01000mol/L的KMnO4溶液滴定,重复试验,平均消耗 KMnO4标准液20.00mL。已知:C2O42-酸性条件下被MnO4-氧化为CO2,杂质不参加反应。该样品中K2[Cu(C2O4)2]·2H2O的质量分数为____________ (保留小数点后两位) ,写出简要计算过程:__________________ 。
您最近一年使用:0次
19-20高一·浙江·阶段练习
解题方法
10 . 洁厕灵是常用的陶瓷清洗液,小彭同学对某品牌洁厕灵的有效成分及其含量进行研究。
(1)查阅资料得知:洁厕灵有效成分是HCl.HCl的含量可通过已知溶质质量分数的NaHCO3溶液来测定,其它成分均不参与反应。请完成HCl与NaHCO3反应的化学方程式:HCl+NaHCO3=NaCl+___________ +CO2↑。
(2)配制一定溶质质量分数的NaHCO3溶液,需要用到的玻璃仪器有烧杯、滴管和___________ 。
(3)向一锥形瓶中加入100克该品牌的洁厕灵,再逐次加入相同质量分数的 NaHCO3溶液,测出每次锥形瓶中反应后溶液的总质量,数据记录如下:
试分析计算下列问题:
①第一次实验时,所加 NaHCO3溶液中溶质质量是_______ 克?
②该品牌洁厕灵中HCl的质量分数是________ ?

(1)查阅资料得知:洁厕灵有效成分是HCl.HCl的含量可通过已知溶质质量分数的NaHCO3溶液来测定,其它成分均不参与反应。请完成HCl与NaHCO3反应的化学方程式:HCl+NaHCO3=NaCl+
(2)配制一定溶质质量分数的NaHCO3溶液,需要用到的玻璃仪器有烧杯、滴管和
(3)向一锥形瓶中加入100克该品牌的洁厕灵,再逐次加入相同质量分数的 NaHCO3溶液,测出每次锥形瓶中反应后溶液的总质量,数据记录如下:
| 第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
| 加入NaHCO3溶液的质量/g | 40 | 40 | 40 | 40 | 40 |
| 反应后溶液的总质量/g | 138.9 | 177.8 | 216.7 | 255.6 | 295.6 |
试分析计算下列问题:
①第一次实验时,所加 NaHCO3溶液中溶质质量是
②该品牌洁厕灵中HCl的质量分数是
您最近一年使用:0次



