1 . 已知:常温下,部分弱电解质的电离平衡常数如下表所示,回答下列问题:
(1)常温下,物质的量浓度相等的下列溶液pH由大到小的顺序是_______ (填序号)。
① 溶液 ②
溶液 ② 溶液 ③
溶液 ③ 溶液 ④
溶液 ④ 溶液 ⑤
溶液 ⑤ 溶液
溶液
(2)常温下,将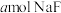 溶于水向该溶液中滴加
溶于水向该溶液中滴加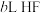 溶液后溶液呈中性,所滴加HF溶液的浓度为
溶液后溶液呈中性,所滴加HF溶液的浓度为_______  。
。
(3)下列离子方程式错误的是_______ (填序号)。
①向 溶液中加入过量
溶液中加入过量 溶液:
溶液:
②向 溶液中通入少量
溶液中通入少量 气体:
气体: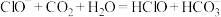
③向 溶液中通入过量
溶液中通入过量 气体:
气体: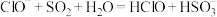
④向 溶液中加入少量
溶液中加入少量 溶液:
溶液:
(4)①下列能证明草酸为弱酸的实验是_______ (填标号)。
A.室温下,分别取等浓度 溶液和盐酸测 pH,
溶液和盐酸测 pH, 溶液 pH 大于盐酸
溶液 pH 大于盐酸
B.室温下,浓度为 c1的 溶液 pH=a,加入一定量的
溶液 pH=a,加入一定量的  溶液,测得pH>a
溶液,测得pH>a
C.室温下,取pH=a(a<3)的 溶液稀释 100 倍后,测其pH<a +2
溶液稀释 100 倍后,测其pH<a +2
D.标准状况下,取0.10mol/L的 溶液100mL 与足量锌粉反应,收集到H2体积为224mL
溶液100mL 与足量锌粉反应,收集到H2体积为224mL
②用0.02000 mol/L的NaOH溶液滴定某未知浓度的草酸,若选择甲基橙为指示剂,到达滴定终点时主要溶质的化学式为_______ 。当pH为3时,溶液中
_______ 。
 | HF |  |  |  | |
 | 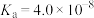 | 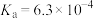 |   | 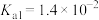  |  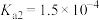 |
①
 溶液 ②
溶液 ② 溶液 ③
溶液 ③ 溶液 ④
溶液 ④ 溶液 ⑤
溶液 ⑤ 溶液
溶液(2)常温下,将
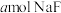 溶于水向该溶液中滴加
溶于水向该溶液中滴加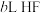 溶液后溶液呈中性,所滴加HF溶液的浓度为
溶液后溶液呈中性,所滴加HF溶液的浓度为 。
。(3)下列离子方程式错误的是
①向
 溶液中加入过量
溶液中加入过量 溶液:
溶液:
②向
 溶液中通入少量
溶液中通入少量 气体:
气体: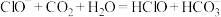
③向
 溶液中通入过量
溶液中通入过量 气体:
气体: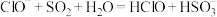
④向
 溶液中加入少量
溶液中加入少量 溶液:
溶液:
(4)①下列能证明草酸为弱酸的实验是
A.室温下,分别取等浓度
 溶液和盐酸测 pH,
溶液和盐酸测 pH, 溶液 pH 大于盐酸
溶液 pH 大于盐酸B.室温下,浓度为 c1的
 溶液 pH=a,加入一定量的
溶液 pH=a,加入一定量的  溶液,测得pH>a
溶液,测得pH>aC.室温下,取pH=a(a<3)的
 溶液稀释 100 倍后,测其pH<a +2
溶液稀释 100 倍后,测其pH<a +2D.标准状况下,取0.10mol/L的
 溶液100mL 与足量锌粉反应,收集到H2体积为224mL
溶液100mL 与足量锌粉反应,收集到H2体积为224mL②用0.02000 mol/L的NaOH溶液滴定某未知浓度的草酸,若选择甲基橙为指示剂,到达滴定终点时主要溶质的化学式为

您最近一年使用:0次
名校
解题方法
2 . 生活无处不化学,运用所学知识,回答下列问题。
(1)节日燃放的五彩缤纷的烟花,就是锂、钠、钾、锶、钡等金属化合物所呈现的各种艳丽色彩。 、
、 在无色火焰上灼烧时,其焰色
在无色火焰上灼烧时,其焰色___________ (填“相同”或“不相同”),该原理是___________ (填“物理”或“化学”)变化。
(2)电子工业用 溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出
溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出 溶液与铜反应的离子方程式:
溶液与铜反应的离子方程式:___________ 。
(3)高铁酸钠( )是一种新型的净水剂。其净水过程中发生的化学反应主要为
)是一种新型的净水剂。其净水过程中发生的化学反应主要为 ,证明有
,证明有 胶体生成的方法为:
胶体生成的方法为:___________ 。
(4)工业上常用绿矾( )做处理剂,处理废水中含有的重铬酸根离子(
)做处理剂,处理废水中含有的重铬酸根离子( ),反应的离子方程式如下:
),反应的离子方程式如下: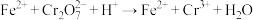 (未配平)。
(未配平)。
①在该反应中,氧化剂是___________ (填离子符号,下同),被氧化的是___________ 。
②该反应每消耗 离子,生成
离子,生成 的物质的量为
的物质的量为___________ mol,转移电子的物质的量为___________ mol。
(1)节日燃放的五彩缤纷的烟花,就是锂、钠、钾、锶、钡等金属化合物所呈现的各种艳丽色彩。
 、
、 在无色火焰上灼烧时,其焰色
在无色火焰上灼烧时,其焰色(2)电子工业用
 溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出
溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出 溶液与铜反应的离子方程式:
溶液与铜反应的离子方程式:(3)高铁酸钠(
 )是一种新型的净水剂。其净水过程中发生的化学反应主要为
)是一种新型的净水剂。其净水过程中发生的化学反应主要为 ,证明有
,证明有 胶体生成的方法为:
胶体生成的方法为:(4)工业上常用绿矾(
 )做处理剂,处理废水中含有的重铬酸根离子(
)做处理剂,处理废水中含有的重铬酸根离子( ),反应的离子方程式如下:
),反应的离子方程式如下: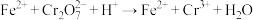 (未配平)。
(未配平)。①在该反应中,氧化剂是
②该反应每消耗
 离子,生成
离子,生成 的物质的量为
的物质的量为
您最近一年使用:0次
名校
解题方法
3 . 铝、氧化铝的性质与其他常见金属及氧化物相比,有一定的特殊性。
(1)可用NaOH溶液除去铁粉中的铝粉,反应原理是(用离子方程式表示)___________ ,将2.7gAl分别置于足量的NaOH溶液、稀硫酸中,生成H2的体积之比(同温同压)为___________ 。
(2)证明Al2O3是两性氧化物的常用试剂是___________ (填名称),将ag废铝片置于100mL盐酸中,测得反应过程中生成氢气体积(标准状况)与时间的关系如图所示:0~t1时间段无气体生成的原因是___________ ,若反应后所得溶液中n(Al3+)=0.102mol且盐酸恰好完全反应,则原溶液中c(HCl)=___________ 。
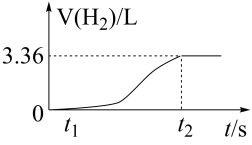
(1)可用NaOH溶液除去铁粉中的铝粉,反应原理是(用离子方程式表示)
(2)证明Al2O3是两性氧化物的常用试剂是

您最近一年使用:0次
2022-06-22更新
|
336次组卷
|
4卷引用:青海玉树州三校2021-2022学年高一上学期期末考试化学试题
名校
4 . Co2O3、Co3+是均属于极强的氧化剂,在生产中有着重要的应用。
(1)一定条件下,Co3+与足量Na2S2O3溶液反应后生成Co2+和SO ,写出该反应的离子方程式
,写出该反应的离子方程式___ 。设计实验证明反应后溶液中含有SO :
:___ 。(已知:S2O 与H+反应生成S、SO2,BaS2O3不溶于水)
与H+反应生成S、SO2,BaS2O3不溶于水)
(2)为测定某Co2O3样品中Co2O3的纯度(杂质不参与反应),现进行如下实验:
步骤1:称取样品2.000g于锥形瓶中,加入足量硫酸和50mL0.5000mol·L-1FeSO4溶液充分反应。
步骤2:向步骤1所得溶液中逐滴滴加0.0500mol·L-1KMnO4标准溶液至终点,消耗KMnO4标准溶液的体积为20.00mL。
已知步骤1、2中所涉及物质的转化分别为:Co2O3 Co3+
Co3+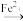 Co2+、MnO
Co2+、MnO
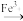 Mn2+
Mn2+
通过计算确定Co2O3样品中Co2O3的质量分数___ (写出计算过程)。
(1)一定条件下,Co3+与足量Na2S2O3溶液反应后生成Co2+和SO
 ,写出该反应的离子方程式
,写出该反应的离子方程式 :
: 与H+反应生成S、SO2,BaS2O3不溶于水)
与H+反应生成S、SO2,BaS2O3不溶于水)(2)为测定某Co2O3样品中Co2O3的纯度(杂质不参与反应),现进行如下实验:
步骤1:称取样品2.000g于锥形瓶中,加入足量硫酸和50mL0.5000mol·L-1FeSO4溶液充分反应。
步骤2:向步骤1所得溶液中逐滴滴加0.0500mol·L-1KMnO4标准溶液至终点,消耗KMnO4标准溶液的体积为20.00mL。
已知步骤1、2中所涉及物质的转化分别为:Co2O3
 Co3+
Co3+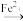 Co2+、MnO
Co2+、MnO
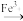 Mn2+
Mn2+通过计算确定Co2O3样品中Co2O3的质量分数
您最近一年使用:0次
5 . 草酸(H2C2O4)存在于自然界的植物中,是一种二元弱酸。草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以 上分解。
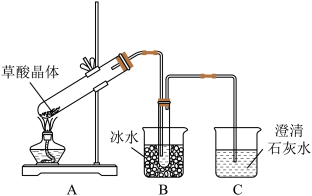
回答下列问题:
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物。
①装置A中试管口略向上倾斜的原因是____________________ ;
②装置C中可观察到有气泡冒出且澄清石灰水变浑浊,由此可知草酸晶体分解的产物中有____________________ ;
③装置B的主要作用是冷凝水蒸气、草酸等,防止草酸进入装置C发生_______ 反应(填化学方程式),从而干扰CO2的检验。
(2)乙组同学认为草酸晶体分解的产物中含有CO,为进行验证,选用甲组实验中的装置A、B和下图所示的部分装置(可以重复选用)进行实验。
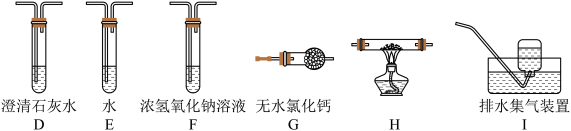
①乙组同学的实验装置中,依次连接的合理顺序为A→B→____ →D→G→_____ →D→______ 。装置H反应管中盛有的物质是_______ (填化学式)。
②能证明草酸晶体分解产物中有CO的现象是:__________________ ,___________ ,第二个D装置中澄清石灰水变浑浊。
③H装置中发生反应的化学方程式为______________________ 。

回答下列问题:
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物。
①装置A中试管口略向上倾斜的原因是
②装置C中可观察到有气泡冒出且澄清石灰水变浑浊,由此可知草酸晶体分解的产物中有
③装置B的主要作用是冷凝水蒸气、草酸等,防止草酸进入装置C发生
(2)乙组同学认为草酸晶体分解的产物中含有CO,为进行验证,选用甲组实验中的装置A、B和下图所示的部分装置(可以重复选用)进行实验。

①乙组同学的实验装置中,依次连接的合理顺序为A→B→
②能证明草酸晶体分解产物中有CO的现象是:
③H装置中发生反应的化学方程式为
您最近一年使用:0次
6 . 已知:硝酸铜受热易分解。170℃时,2Cu(NO3)2 2CuO+4NO2↑+O2↑开始分解,至250℃分解完全。(其中2NO2
2CuO+4NO2↑+O2↑开始分解,至250℃分解完全。(其中2NO2 N2O4,2NO2
N2O4,2NO2 2NO+O2等反应忽略不计)。
2NO+O2等反应忽略不计)。
800℃时,4CuO 2Cu2O+O2↑ 开始分解,至1000℃以上分解完全。
2Cu2O+O2↑ 开始分解,至1000℃以上分解完全。
(1)取5.64 g无水硝酸铜,加热至1000℃以上,将生成的气体导入足量的NaOH溶液充分吸收后,还有逸出的气体是____ (填分子式),体积(标准状况)为______ ;将吸收液加水稀释到100 mL,此溶液中NO3-的物质的量浓度为_____________ 。
(2)取5.64 g无水硝酸铜加热至某温度分解后的残留固体中含有1.60 g CuO,则残留固体的质量可能是_________ 。
(3)实验证明,当温度达到1800℃时,Cu2O也会发生分解:2Cu2O 4Cu+O2↑。取8.00 g CuO,加热到1800℃左右,冷却后称得质量为6.88 g,通过计算求出反应后剩余固体中各成分的物质的量之比________________ 。
(4)取8.00 g CuO,通入一定量H2并加热,使其部分还原为Cu和Cu2O,且其中n(Cu2O):n(Cu)=x。将此混合物溶于足量的稀硫酸中(Cu2O+2H+=Cu+Cu2++H2O),充分反应后过滤得到Cu y g,试求未被还原的CuO的物质的量(用含x、y的代数式表示)。_________
 2CuO+4NO2↑+O2↑开始分解,至250℃分解完全。(其中2NO2
2CuO+4NO2↑+O2↑开始分解,至250℃分解完全。(其中2NO2 N2O4,2NO2
N2O4,2NO2 2NO+O2等反应忽略不计)。
2NO+O2等反应忽略不计)。800℃时,4CuO
 2Cu2O+O2↑ 开始分解,至1000℃以上分解完全。
2Cu2O+O2↑ 开始分解,至1000℃以上分解完全。(1)取5.64 g无水硝酸铜,加热至1000℃以上,将生成的气体导入足量的NaOH溶液充分吸收后,还有逸出的气体是
(2)取5.64 g无水硝酸铜加热至某温度分解后的残留固体中含有1.60 g CuO,则残留固体的质量可能是
(3)实验证明,当温度达到1800℃时,Cu2O也会发生分解:2Cu2O 4Cu+O2↑。取8.00 g CuO,加热到1800℃左右,冷却后称得质量为6.88 g,通过计算求出反应后剩余固体中各成分的物质的量之比
(4)取8.00 g CuO,通入一定量H2并加热,使其部分还原为Cu和Cu2O,且其中n(Cu2O):n(Cu)=x。将此混合物溶于足量的稀硫酸中(Cu2O+2H+=Cu+Cu2++H2O),充分反应后过滤得到Cu y g,试求未被还原的CuO的物质的量(用含x、y的代数式表示)。
您最近一年使用:0次
名校
解题方法
7 . 某同学欲验证碳与浓硫酸反应产物的性质。现已将装置如图连接,请回答下列问题。
(1)烧瓶中发生反应的化学反应方程式是___________ 。
(2)实验中两次使用到品红溶液,其目的不同。A的使用目的是_____ ,通过洗气瓶C中无现象和___ 的现象,证明反应有_______ (填化学式)生成。
(3)洗气瓶B中溶液颜色变浅,说明碳与浓硫酸反应的产物之一______ (填名称)具有______ 的性质。
(4)实验完成后,取出洗气瓶A中的无色溶液于试管中,加热,可观察到__________ 。
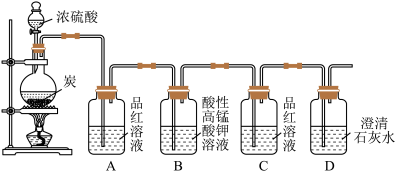
(1)烧瓶中发生反应的化学反应方程式是
(2)实验中两次使用到品红溶液,其目的不同。A的使用目的是
(3)洗气瓶B中溶液颜色变浅,说明碳与浓硫酸反应的产物之一
(4)实验完成后,取出洗气瓶A中的无色溶液于试管中,加热,可观察到
您最近一年使用:0次
2020-01-05更新
|
361次组卷
|
3卷引用:河北省唐山市丰润车轴山中学2019—2020学年高一上学期12月月考化学试题
8 . 甲、乙都是二元固体化合物,将32g的粉末加入足量浓硝酸并加热,完全溶解得蓝色溶液,向该溶液中加入足量 溶液,过滤、洗涤、干燥得沉淀
溶液,过滤、洗涤、干燥得沉淀 ;滤液中再滴加NaOH溶液,又出现蓝色沉淀。
;滤液中再滴加NaOH溶液,又出现蓝色沉淀。
含乙的矿石自然界中储量较多,称取一定量的乙,加入稀盐酸使其完全溶解,溶液分为A、B两等分,向A中加入足量NaOH溶液,过滤、洗涤、灼烧得到红棕色固体28g,经分析乙与红棕色固体组成元素相同,向B中加入 铜粉充分反应后过滤、洗涤、干燥得固体
铜粉充分反应后过滤、洗涤、干燥得固体 。
。
 写出构成甲的阴离子的结构示意图
写出构成甲的阴离子的结构示意图______ ,32g甲在足量浓硝酸中反应转移的电子数为______ 。
 乙的化学式
乙的化学式______ ;稀硫酸溶解乙的化学方程式______ 。
 将甲在足量氧气中充分灼烧的气体产物通入一定量A溶液中,该反应的离子方程式为
将甲在足量氧气中充分灼烧的气体产物通入一定量A溶液中,该反应的离子方程式为______ ,设计实验证明此步反应后的溶液中金属元素的化合价______ 。
 溶液,过滤、洗涤、干燥得沉淀
溶液,过滤、洗涤、干燥得沉淀 ;滤液中再滴加NaOH溶液,又出现蓝色沉淀。
;滤液中再滴加NaOH溶液,又出现蓝色沉淀。含乙的矿石自然界中储量较多,称取一定量的乙,加入稀盐酸使其完全溶解,溶液分为A、B两等分,向A中加入足量NaOH溶液,过滤、洗涤、灼烧得到红棕色固体28g,经分析乙与红棕色固体组成元素相同,向B中加入
 铜粉充分反应后过滤、洗涤、干燥得固体
铜粉充分反应后过滤、洗涤、干燥得固体 。
。 写出构成甲的阴离子的结构示意图
写出构成甲的阴离子的结构示意图 乙的化学式
乙的化学式 将甲在足量氧气中充分灼烧的气体产物通入一定量A溶液中,该反应的离子方程式为
将甲在足量氧气中充分灼烧的气体产物通入一定量A溶液中,该反应的离子方程式为
您最近一年使用:0次
2019-12-26更新
|
188次组卷
|
2卷引用:2019年秋高三化学复习强化练习——离子反应
解题方法
9 . 某研究性学习小组对铝热反应实验展开研究。现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如下:
Ⅰ.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?________ (填“合理”或“不合理”)。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是________ ,反应的离子方程式为__________________________________________________ 。
(3)实验室溶解该熔融物,在下列试剂中最适宜的试剂是________ (填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4 mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
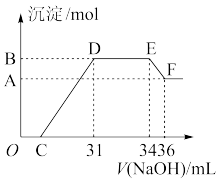
(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为_________________________ 。
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为___________ ;上述现象说明溶液中________ 结合OH-的能力比________ 强(填离子符号)。
(3)B与A的差值为________ mol。
(4)B点对应的沉淀的物质的量为________ mol,C点对应的氢氧化钠溶液的体积为________ mL。
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2 054 | 1 535 | 1 462 |
| 沸点/℃ | 2 467 | 2 980 | 2 750 | - |
Ⅰ.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是
(3)实验室溶解该熔融物,在下列试剂中最适宜的试剂是
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4 mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:

(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为
(3)B与A的差值为
(4)B点对应的沉淀的物质的量为
您最近一年使用:0次
10 . 有机物A的蒸汽密度为6.69g·L-1(已折算为标况),现取15g A完全氧化,产物依次通过浓硫酸和碱石灰,浓硫酸增重9g,碱石灰增重39.6g。用现代物理方法测定:
①核磁共振仪测出A的核磁共振氢谱有5组峰,其峰面积之比为1:2:2:2:3。
②利用红外光谱仪可初步检测有机化合物中的某些基团,现测得A分子中具有一个苯环结构,一个C-O-C结构和一个C=O结构,且A的苯环上只有一取代基。
③性质实验证明,A能在稀硫酸作用下生成两种有机物,且其中一种有酸性。
(1)通过计算求A的相对分子质量及分子式。
(2)根据谱图信息写出A的三种可能结构。
①核磁共振仪测出A的核磁共振氢谱有5组峰,其峰面积之比为1:2:2:2:3。
②利用红外光谱仪可初步检测有机化合物中的某些基团,现测得A分子中具有一个苯环结构,一个C-O-C结构和一个C=O结构,且A的苯环上只有一取代基。
③性质实验证明,A能在稀硫酸作用下生成两种有机物,且其中一种有酸性。
(1)通过计算求A的相对分子质量及分子式。
(2)根据谱图信息写出A的三种可能结构。
您最近一年使用:0次



