名校
1 . Co2O3、Co3+是均属于极强的氧化剂,在生产中有着重要的应用。
(1)一定条件下,Co3+与足量Na2S2O3溶液反应后生成Co2+和SO ,写出该反应的离子方程式
,写出该反应的离子方程式___ 。设计实验证明反应后溶液中含有SO :
:___ 。(已知:S2O 与H+反应生成S、SO2,BaS2O3不溶于水)
与H+反应生成S、SO2,BaS2O3不溶于水)
(2)为测定某Co2O3样品中Co2O3的纯度(杂质不参与反应),现进行如下实验:
步骤1:称取样品2.000g于锥形瓶中,加入足量硫酸和50mL0.5000mol·L-1FeSO4溶液充分反应。
步骤2:向步骤1所得溶液中逐滴滴加0.0500mol·L-1KMnO4标准溶液至终点,消耗KMnO4标准溶液的体积为20.00mL。
已知步骤1、2中所涉及物质的转化分别为:Co2O3 Co3+
Co3+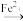 Co2+、MnO
Co2+、MnO
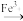 Mn2+
Mn2+
通过计算确定Co2O3样品中Co2O3的质量分数___ (写出计算过程)。
(1)一定条件下,Co3+与足量Na2S2O3溶液反应后生成Co2+和SO
 ,写出该反应的离子方程式
,写出该反应的离子方程式 :
: 与H+反应生成S、SO2,BaS2O3不溶于水)
与H+反应生成S、SO2,BaS2O3不溶于水)(2)为测定某Co2O3样品中Co2O3的纯度(杂质不参与反应),现进行如下实验:
步骤1:称取样品2.000g于锥形瓶中,加入足量硫酸和50mL0.5000mol·L-1FeSO4溶液充分反应。
步骤2:向步骤1所得溶液中逐滴滴加0.0500mol·L-1KMnO4标准溶液至终点,消耗KMnO4标准溶液的体积为20.00mL。
已知步骤1、2中所涉及物质的转化分别为:Co2O3
 Co3+
Co3+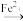 Co2+、MnO
Co2+、MnO
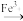 Mn2+
Mn2+通过计算确定Co2O3样品中Co2O3的质量分数
您最近一年使用:0次
名校
2 . 已知黄钠铁矾[NaxFey(SO4)m(OH)n]具有沉淀颗粒大、沉淀速率快、容易过滤等特点。某研究小组先将某废水中Fe2+氧化为Fe3+,再加入Na2SO4使其生成黄钠铁矾而除去。该小组为测定黄钠铁矾的组成,进行了如下实验:
①称取4.850 g样品,加盐酸完全溶解后,配成100.00 mL溶液A;
②量取25.00 mL溶液A,加入足量的KI,用0.2500 mol·L-1Na2S2O3溶液进行滴定(反应为I2+2Na2S2O3=2NaI+Na2S4O6),消耗30.00 mLNa2S2O3溶液至终点。
③另取25.00 mL溶液A,加足量BaCl2溶液充分反应后,过滤、洗涤、干燥后得沉淀1.165 g。
(1)如何证明步骤③中的沉淀已洗涤干净?___________ 。
(2)用Na2S2O3溶液进行滴定时,使用的指示剂为________ ,滴定到终点的颜色变化为_________ 。
(3)通过计算确定黄钠铁矾的化学式_________ (写出计算过程)。
①称取4.850 g样品,加盐酸完全溶解后,配成100.00 mL溶液A;
②量取25.00 mL溶液A,加入足量的KI,用0.2500 mol·L-1Na2S2O3溶液进行滴定(反应为I2+2Na2S2O3=2NaI+Na2S4O6),消耗30.00 mLNa2S2O3溶液至终点。
③另取25.00 mL溶液A,加足量BaCl2溶液充分反应后,过滤、洗涤、干燥后得沉淀1.165 g。
(1)如何证明步骤③中的沉淀已洗涤干净?
(2)用Na2S2O3溶液进行滴定时,使用的指示剂为
(3)通过计算确定黄钠铁矾的化学式
您最近一年使用:0次
名校
解题方法
3 . 一定温度下,在 的密闭容器中,
的密闭容器中, 三种气体的物质的量随时间变化的曲线如图所示:
三种气体的物质的量随时间变化的曲线如图所示:
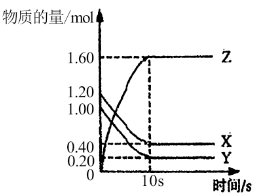
(1)反应的化学方程式为______ 。
(2)反应开始到 ,用X表示的平均反应速率为
,用X表示的平均反应速率为______ 。
(3)下列关于该反应的说法正确的是______ (填字母)。
A. 时,该反应已经停止 B.
时,该反应已经停止 B. 之前X的消耗速率小于它的生成速率
之前X的消耗速率小于它的生成速率
C. 时正反应速率等于逆反应速率 D.
时正反应速率等于逆反应速率 D. 时
时 的浓度保持不变
的浓度保持不变
 的密闭容器中,
的密闭容器中, 三种气体的物质的量随时间变化的曲线如图所示:
三种气体的物质的量随时间变化的曲线如图所示:
(1)反应的化学方程式为
(2)反应开始到
 ,用X表示的平均反应速率为
,用X表示的平均反应速率为(3)下列关于该反应的说法正确的是
A.
 时,该反应已经停止 B.
时,该反应已经停止 B. 之前X的消耗速率小于它的生成速率
之前X的消耗速率小于它的生成速率C.
 时正反应速率等于逆反应速率 D.
时正反应速率等于逆反应速率 D. 时
时 的浓度保持不变
的浓度保持不变
您最近一年使用:0次
4 . (1)可逆反应:N2O4⇌2NO2,在体积不变的密闭容器中反应,下列说法中可判断该反应达到平衡状态的是____________ (选填序号)
①单位时间内生成2n molNO2的同时生成n mol N2O4
②单位时间内消耗n mol N2O4的同时生成2n mol NO2
③容器中的压强不再改变的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
(2)373k时把0.12 mol无色的N2O4气体通入体积500 mL的密闭容器中,发生反应:N2O4⇌2NO2,容器中立即出现红棕色。反应进行到2s时,测得生成NO2的物质的量为0.01 mol;反应进行到60 s时达到平衡,此时容器内N2O4与NO2的物质的量相等。请计算:(本小题要求写出解过程)
①开始2 s内以N2O4表示的化学反应速率_________ ;
②达到平衡时体系的压强与开始时体系的压强之比_________ ;
③达到平衡时,体系中NO2的物质的量浓度_________ ;
④N2O4的平衡转化率_________ 。
①单位时间内生成2n molNO2的同时生成n mol N2O4
②单位时间内消耗n mol N2O4的同时生成2n mol NO2
③容器中的压强不再改变的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
(2)373k时把0.12 mol无色的N2O4气体通入体积500 mL的密闭容器中,发生反应:N2O4⇌2NO2,容器中立即出现红棕色。反应进行到2s时,测得生成NO2的物质的量为0.01 mol;反应进行到60 s时达到平衡,此时容器内N2O4与NO2的物质的量相等。请计算:(本小题要求写出解过程)
①开始2 s内以N2O4表示的化学反应速率
②达到平衡时体系的压强与开始时体系的压强之比
③达到平衡时,体系中NO2的物质的量浓度
④N2O4的平衡转化率
您最近一年使用:0次
2017-05-03更新
|
637次组卷
|
3卷引用:江苏省宿迁市名校2016-2017学年高一下学期期中考试化学试题



