名校
1 . 某小组设计如下实验研究实验室中的甲酸。已知:25℃时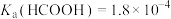
(1)配制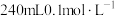 的HCOOH溶液,需
的HCOOH溶液,需 的HCOOH溶液的体积为
的HCOOH溶液的体积为_______ mL。
(2)为确定甲酸溶液的准确浓度,取20mL甲酸溶液于锥形瓶中,加入2滴_______ 溶液,用 的NaOH溶液滴定至终点,消耗NaOH溶液的体积为22.04mL,滴定实验中所使用的锥形瓶的容积最恰当的是
的NaOH溶液滴定至终点,消耗NaOH溶液的体积为22.04mL,滴定实验中所使用的锥形瓶的容积最恰当的是_______ (填字母)。
A.50mL B.100mL C.200mL D.250mL
(3)下列关于滴定操作的说法正确的_______
(4)小组同学用_______ 测出25℃时该甲酸溶液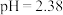 ,则水电离产生的
,则水电离产生的 数量级为
数量级为_______ 。
(5)25℃时甲酸与醋酸钠溶液反应: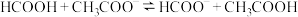 ,该反应的平衡常数为10,则该温度下醋酸的电离常数
,该反应的平衡常数为10,则该温度下醋酸的电离常数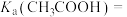
_______ 。
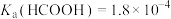
(1)配制
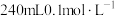 的HCOOH溶液,需
的HCOOH溶液,需 的HCOOH溶液的体积为
的HCOOH溶液的体积为(2)为确定甲酸溶液的准确浓度,取20mL甲酸溶液于锥形瓶中,加入2滴
 的NaOH溶液滴定至终点,消耗NaOH溶液的体积为22.04mL,滴定实验中所使用的锥形瓶的容积最恰当的是
的NaOH溶液滴定至终点,消耗NaOH溶液的体积为22.04mL,滴定实验中所使用的锥形瓶的容积最恰当的是A.50mL B.100mL C.200mL D.250mL
(3)下列关于滴定操作的说法正确的_______
| A.滴定前应检查滴定管是否漏水,进行洗涤、润洗 |
| B.将标准溶液装入滴定管时,应借助玻璃棒或漏斗等玻璃仪器转移 |
| C.进行滴定操作时,眼睛要始终注视着滴定管内液面的变化 |
| D.滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁 |
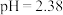 ,则水电离产生的
,则水电离产生的 数量级为
数量级为(5)25℃时甲酸与醋酸钠溶液反应:
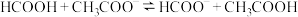 ,该反应的平衡常数为10,则该温度下醋酸的电离常数
,该反应的平衡常数为10,则该温度下醋酸的电离常数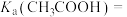
您最近一年使用:0次
2022-11-12更新
|
248次组卷
|
2卷引用:湖北省荆、荆、襄、宜四地七校考试联盟2022-2023学年高二上学期期中联考化学试题
解题方法
2 . 回答下列问题:
(1)合成气(CO、H2)是一种重要的化工原料,在化工生产中具有十分广泛的用途。工业上用CO和H2合成CH3OH: △H。则该反应的平衡常数表达式为
△H。则该反应的平衡常数表达式为_______ ;
(2)测得不同温度下反应的平衡常数 如下表:
如下表:
下列说法错误的是_______。
(3)工业上,利用水煤气法制取合成气,其中发生的一步反应为:CO(g)+H2O(g) CO2(g)+H2(g) △H=-41.2kJ·mol-1。已知
CO2(g)+H2(g) △H=-41.2kJ·mol-1。已知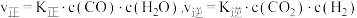 (k正、k逆为化学反应速率常数,只与温度有关,与浓度、压强无关)。830℃时,体积为2L的恒容密闭容器中,投入2molCO(g)和2molH2O(g)。5min达到平衡,测得H2的平均生成速率为0.1mol∙L-1∙min-1,则反应达到平衡后,速率常数
(k正、k逆为化学反应速率常数,只与温度有关,与浓度、压强无关)。830℃时,体积为2L的恒容密闭容器中,投入2molCO(g)和2molH2O(g)。5min达到平衡,测得H2的平均生成速率为0.1mol∙L-1∙min-1,则反应达到平衡后,速率常数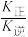 =
=_______ 。
(4)以天然气为原料生产合成气也有多种方法,其中Sparg工艺的原理为CH4(g)+CO2(g) 2CO(g)+2H2(g) △H1。T℃下,向容积可变的密闭容器中充入一定量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如表所示:
2CO(g)+2H2(g) △H1。T℃下,向容积可变的密闭容器中充入一定量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如表所示:
①T℃下,该反应的平衡常数K=_______ 。
②实验1中,CO的平衡体积分数为_______ %(保留三位有效数字)。
③V1:V2=_______ 。
(1)合成气(CO、H2)是一种重要的化工原料,在化工生产中具有十分广泛的用途。工业上用CO和H2合成CH3OH:
 △H。则该反应的平衡常数表达式为
△H。则该反应的平衡常数表达式为(2)测得不同温度下反应的平衡常数
 如下表:
如下表:| 温度/℃ | T1 | 100 | T2 | 200 | 300 |
| 平衡常数K | 100 | 13 | 1 | 1.9×10-2 | 2.4×10-4 |
| A.△H<0 |
| B.该反应的ΔS<0 |
| C.T2时,某时刻1L容器中含0.1mol CO、0.2mol H2和0.3mol CH3OH,此时v正>v逆 |
| D.T1时,向1L密闭容器中投入0.1mol CO和0.2mol H2,平衡时CO转化率为50% |
 CO2(g)+H2(g) △H=-41.2kJ·mol-1。已知
CO2(g)+H2(g) △H=-41.2kJ·mol-1。已知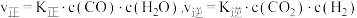 (k正、k逆为化学反应速率常数,只与温度有关,与浓度、压强无关)。830℃时,体积为2L的恒容密闭容器中,投入2molCO(g)和2molH2O(g)。5min达到平衡,测得H2的平均生成速率为0.1mol∙L-1∙min-1,则反应达到平衡后,速率常数
(k正、k逆为化学反应速率常数,只与温度有关,与浓度、压强无关)。830℃时,体积为2L的恒容密闭容器中,投入2molCO(g)和2molH2O(g)。5min达到平衡,测得H2的平均生成速率为0.1mol∙L-1∙min-1,则反应达到平衡后,速率常数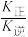 =
=(4)以天然气为原料生产合成气也有多种方法,其中Sparg工艺的原理为CH4(g)+CO2(g)
 2CO(g)+2H2(g) △H1。T℃下,向容积可变的密闭容器中充入一定量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如表所示:
2CO(g)+2H2(g) △H1。T℃下,向容积可变的密闭容器中充入一定量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如表所示:| 实验编号 | 容器体积 | 物质浓度/mol·L-1 | ||
| CH4 | CO2 | CO | ||
| 1 | V1 | 0.02 | 0.02 | 0.10 |
| 2 | V2 | x | x | 0.05 |
②实验1中,CO的平衡体积分数为
③V1:V2=
您最近一年使用:0次
解题方法
3 . 完成下列各题:
(1)磷的一种化合物叫亚磷酸( )。已知:
)。已知:
(i)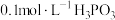 溶液的
溶液的 ;
;
(ii) 与NaOH反应只生成
与NaOH反应只生成 和
和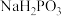 ;
;
(iii) 和碘水反应,碘水棕黄色褪去,再加
和碘水反应,碘水棕黄色褪去,再加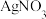 溶液有黄色沉淀生成。
溶液有黄色沉淀生成。
①关于 的说法:a.强酸;b.弱酸;c.二元酸;d.三元酸;e.氧化性酸;f.还原性酸,其中正确的是
的说法:a.强酸;b.弱酸;c.二元酸;d.三元酸;e.氧化性酸;f.还原性酸,其中正确的是______ 。(填序号)
A.bdf B.ade C.bcf D. bce
②Na2HPO3为__________ (填“正盐”或“酸式盐”)
(2)常温下,氨水的pH>7,用离子方程式解释其原因:_____________________________ 。
(3)25℃时, 溶液和盐酸的物质的量浓度相同。
溶液和盐酸的物质的量浓度相同。
①加水稀释至相同的倍数,此时 溶液的pH
溶液的pH______ (填“大于”“小于”或“等于”)盐酸的pH。
②加水稀释至相同的pH,此时加入 溶液中水的体积
溶液中水的体积______ (填“大于”“小于”或“等于”)加入盐酸中水的体积。
(4)常温下, 溶液中
溶液中
______ (用含 和
和 的代数式表示)。
的代数式表示)。
(5)25℃时,现有 的HCl溶液100mL,要使它的
的HCl溶液100mL,要使它的 ,如果加入蒸馏水,需加水
,如果加入蒸馏水,需加水______ mL;如果加入 的HCl溶液,需加入此HCl溶液
的HCl溶液,需加入此HCl溶液______ mL(假定溶液体积有加和性,下同)。
(6)某温度下,纯水中的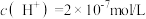 。若温度不变,滴入稀硫酸使
。若温度不变,滴入稀硫酸使 ,则由水电离出的
,则由水电离出的 为
为______ mol/L。
(1)磷的一种化合物叫亚磷酸(
 )。已知:
)。已知:(i)
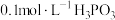 溶液的
溶液的 ;
;(ii)
 与NaOH反应只生成
与NaOH反应只生成 和
和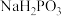 ;
;(iii)
 和碘水反应,碘水棕黄色褪去,再加
和碘水反应,碘水棕黄色褪去,再加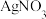 溶液有黄色沉淀生成。
溶液有黄色沉淀生成。①关于
 的说法:a.强酸;b.弱酸;c.二元酸;d.三元酸;e.氧化性酸;f.还原性酸,其中正确的是
的说法:a.强酸;b.弱酸;c.二元酸;d.三元酸;e.氧化性酸;f.还原性酸,其中正确的是A.bdf B.ade C.bcf D. bce
②Na2HPO3为
(2)常温下,氨水的pH>7,用离子方程式解释其原因:
(3)25℃时,
 溶液和盐酸的物质的量浓度相同。
溶液和盐酸的物质的量浓度相同。①加水稀释至相同的倍数,此时
 溶液的pH
溶液的pH②加水稀释至相同的pH,此时加入
 溶液中水的体积
溶液中水的体积(4)常温下,
 溶液中
溶液中
 和
和 的代数式表示)。
的代数式表示)。(5)25℃时,现有
 的HCl溶液100mL,要使它的
的HCl溶液100mL,要使它的 ,如果加入蒸馏水,需加水
,如果加入蒸馏水,需加水 的HCl溶液,需加入此HCl溶液
的HCl溶液,需加入此HCl溶液(6)某温度下,纯水中的
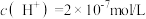 。若温度不变,滴入稀硫酸使
。若温度不变,滴入稀硫酸使 ,则由水电离出的
,则由水电离出的 为
为
您最近一年使用:0次
名校
4 . I.氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40~50℃时反应可生成它。CuH具有的性质有:不稳定,易分解;在氯气中能燃烧;与稀盐酸反应能生成气体;Cu+在酸性条件下发生的反应是:2Cu+ = Cu2++Cu。根据以上信息,结合自己所掌握的化学知识,回答下列问题:
(1)用CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中作____ (填“氧化剂”或“还原剂”)。
(2)CuH溶解在稀盐酸中生成的气体是_____ (填化学式)。
(3)氯气具有很强的氧化性,能将多数物质氧化到较高价态,试写出CuH在氯气中燃烧的化学反应方程式:____
II.已知PbO2具有强氧化性,某强酸性反应体系中,反应物和生成物共六种物质:PbO2、PbSO4(难溶盐)、Pb(MnO4)2(强电解质)、H2O、X(水溶液呈无色)、H2SO4,已知X是一种盐,且0.1 mol X在该反应中失去3.01×1023个电子。
(4)写出X的化学式:_______ ;
(5)若有9.8 g H2SO4参加反应,则转移电子的物质的量为_______ mol
III.下列有关说法正确的有_______
①过氧化钠与二氧化硫反应类似于过氧化钠与二氧化碳反应
②室温下,Al与少量NaOH溶液反应生成Al(OH)3
③金属钠储存在装有煤油的广口瓶中
④可用浓硫酸干燥二氧化硫
⑤明矾可用作净水剂和消毒剂
⑥用二氧化碳灭火器扑灭金属钾的燃烧
⑦湿润的红色酚酞试纸遇氯化氢气体变无色
(1)用CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中作
(2)CuH溶解在稀盐酸中生成的气体是
(3)氯气具有很强的氧化性,能将多数物质氧化到较高价态,试写出CuH在氯气中燃烧的化学反应方程式:
II.已知PbO2具有强氧化性,某强酸性反应体系中,反应物和生成物共六种物质:PbO2、PbSO4(难溶盐)、Pb(MnO4)2(强电解质)、H2O、X(水溶液呈无色)、H2SO4,已知X是一种盐,且0.1 mol X在该反应中失去3.01×1023个电子。
(4)写出X的化学式:
(5)若有9.8 g H2SO4参加反应,则转移电子的物质的量为
III.下列有关说法正确的有
①过氧化钠与二氧化硫反应类似于过氧化钠与二氧化碳反应
②室温下,Al与少量NaOH溶液反应生成Al(OH)3
③金属钠储存在装有煤油的广口瓶中
④可用浓硫酸干燥二氧化硫
⑤明矾可用作净水剂和消毒剂
⑥用二氧化碳灭火器扑灭金属钾的燃烧
⑦湿润的红色酚酞试纸遇氯化氢气体变无色
您最近一年使用:0次
名校
5 . 五氯化磷(PCl5)是有机合成中重要的氯化剂,可以由三氯化磷(PCl3)氯化得到:PCl3(g)+Cl2(g)⇌PCl5(g)ΔH =-93.0kJ·mol-1。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0mol PCl3和1.0molCl2,一段时间后反应达平衡状态,实验数据如表所示:
(1)0~150 s内的平均反应速率υ(PCl3)=_______ mol·L-1·s-1。
(2)该温度下,此反应的化学平衡常数的数值为(可用分数表示)_______ 。
(3)反应至250 s时,该反应放出的热量为_______ kJ。
(4)下列关于上述反应的说法中,正确的是(填字母序号)_______ 。
a.无论是否达平衡状态,混合气体的密度始终不变
b.300s时,升高温度,正、逆反应速率同时增大
c.350s时,向该密闭容器中充入氮气,平衡向正反应方向移动
(5)温度为T1时,混合气体中PCl5的体积分数随时间t变化的示意图如图。其他条件相同,请在图中画出温度为T2(T2>T1)时,PCl5的体积分数随时间变化的曲线_______ 。
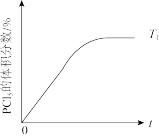
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl5)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)0~150 s内的平均反应速率υ(PCl3)=
(2)该温度下,此反应的化学平衡常数的数值为(可用分数表示)
(3)反应至250 s时,该反应放出的热量为
(4)下列关于上述反应的说法中,正确的是(填字母序号)
a.无论是否达平衡状态,混合气体的密度始终不变
b.300s时,升高温度,正、逆反应速率同时增大
c.350s时,向该密闭容器中充入氮气,平衡向正反应方向移动
(5)温度为T1时,混合气体中PCl5的体积分数随时间t变化的示意图如图。其他条件相同,请在图中画出温度为T2(T2>T1)时,PCl5的体积分数随时间变化的曲线

您最近一年使用:0次
2021-03-23更新
|
202次组卷
|
2卷引用:安徽省六安市新安中学2020-2021学年高二下学期入学考试(普通班)化学试题
6 . 已知:N2O4(g)⇌2NO2(g) =+52.70 kJ/mol。
=+52.70 kJ/mol。
(1)在恒温、恒容的已达平衡的密闭容器中,再向容器内充入1 mol N2O4(g),并达新平衡,下列说法正确的______
a.N2O4(g)的转化率增大
b.平衡常数K减小
c.新平衡N2O4的百分含量比原平衡大
d.新平衡透明容器的气体颜色比原平衡还要深
(2)t℃恒温下,在固定容积为2 L的密闭容器中充入0.54 mol N2O4,2分钟时达到化学平衡,测得容器中含n(NO2)=0.6 mol,则在前2分钟的平均反应速率v(NO2)=_______ ,t℃时反应N2O4(g)⇌2NO2(g)的平衡常数K=________ 。
(3)现有两个体积均为2 L的恒容绝热(不与外界进行热交换)密闭容器甲和乙,若在甲容器中加入1 mol N2O4,在乙容器加入2 mol NO2,分别达平衡后,甲容器N2O4(g)⇌2NO2(g)的平衡常数_______ 乙容器N2O4(g)⇌2NO2(g)的平衡常数(填“大于”、“小于”或“等于”),甲容器中N2O4转化率与乙容器中NO2的转化率之和_________ 1(填“大于”、“小于”或“等于”)。
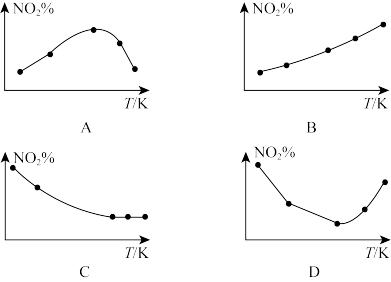
(4)取五等份NO2,分别加入温度不同、容积相同的恒容密闭容器中,发生反应2NO2(g)⇌N2O4(g)。反应相同时间后,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是__________
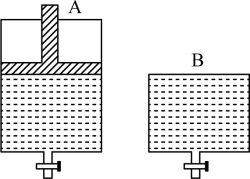
(5)一定温度下,若将3 mol N2O4气体置入开始体积为V但体积可变的等压密闭容器中(如图A),达平衡后容器体积增大至1.5V。若在另一个体积也为V但体积不变的密闭容器中(如图B)加入_______ mol NO2,达平衡后A、B两容器的NO2百分含量相等。
 =+52.70 kJ/mol。
=+52.70 kJ/mol。(1)在恒温、恒容的已达平衡的密闭容器中,再向容器内充入1 mol N2O4(g),并达新平衡,下列说法正确的
a.N2O4(g)的转化率增大
b.平衡常数K减小
c.新平衡N2O4的百分含量比原平衡大
d.新平衡透明容器的气体颜色比原平衡还要深
(2)t℃恒温下,在固定容积为2 L的密闭容器中充入0.54 mol N2O4,2分钟时达到化学平衡,测得容器中含n(NO2)=0.6 mol,则在前2分钟的平均反应速率v(NO2)=
(3)现有两个体积均为2 L的恒容绝热(不与外界进行热交换)密闭容器甲和乙,若在甲容器中加入1 mol N2O4,在乙容器加入2 mol NO2,分别达平衡后,甲容器N2O4(g)⇌2NO2(g)的平衡常数
(4)取五等份NO2,分别加入温度不同、容积相同的恒容密闭容器中,发生反应2NO2(g)⇌N2O4(g)。反应相同时间后,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是

(5)一定温度下,若将3 mol N2O4气体置入开始体积为V但体积可变的等压密闭容器中(如图A),达平衡后容器体积增大至1.5V。若在另一个体积也为V但体积不变的密闭容器中(如图B)加入

您最近一年使用:0次
7 . CH4和CO2是引起温室效应的常见气体,CH4超干重整CO2是现在减少温室气体的一种有效方式,回答下面问题:
(1)实验测得:101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量;1 mol CH4完全燃烧生成液态水和CO2,放出890.3 kJ的热量。下列热化学方程式的书写正确的是_______ 。
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=+890.3 kJ·mol-1
②CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
④2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
A.仅有②④ B.仅有④ C.仅有②③④ D.全部符合要求
(2)在25℃、101 kPa时,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5 kJ·mol-1、285.8 kJ·mol-1、870.3 kJ·mol-1,则2C(s)+2H2(g)+O2(g)=CH3COOH(l) ΔH=________ kJ·mol-1
(3)Ⅰ.CH4超干重整CO2过程中的能量变化图象如下图:
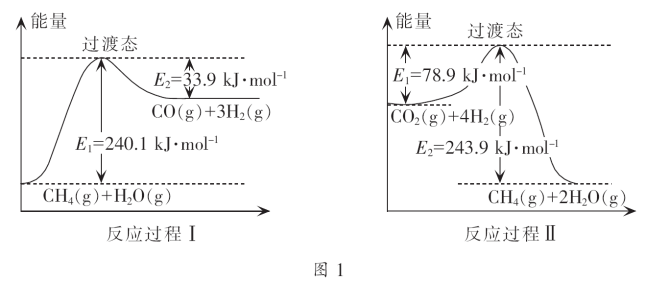
反应过程Ⅰ中发生的活化能是_______ kJ·mol-1,该反应的热化学方程式是______________ 。
反应过程Ⅱ中,CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH=____________ kJ·mol-1
Ⅱ.CH4在某催化剂作用下超干重整CO2的转化如图2所示:
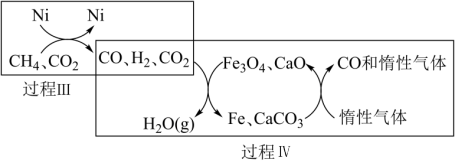
图2
①关于上述过程Ⅳ的说法不正确的是_____________ (填字母)。
a.实现了含碳物质与含氢物质的分离
b.可表示为CO2+H2=H2O(g)+CO
c.CO未参与反应
d.Fe3O4、CaO为催化剂,降低了反应的ΔH
②写出过程Ⅲ的热化学方程式为:___________________ 。
(1)实验测得:101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量;1 mol CH4完全燃烧生成液态水和CO2,放出890.3 kJ的热量。下列热化学方程式的书写正确的是
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=+890.3 kJ·mol-1
②CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
④2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
A.仅有②④ B.仅有④ C.仅有②③④ D.全部符合要求
(2)在25℃、101 kPa时,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5 kJ·mol-1、285.8 kJ·mol-1、870.3 kJ·mol-1,则2C(s)+2H2(g)+O2(g)=CH3COOH(l) ΔH=
(3)Ⅰ.CH4超干重整CO2过程中的能量变化图象如下图:

反应过程Ⅰ中发生的活化能是
反应过程Ⅱ中,CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH=
Ⅱ.CH4在某催化剂作用下超干重整CO2的转化如图2所示:

图2
①关于上述过程Ⅳ的说法不正确的是
a.实现了含碳物质与含氢物质的分离
b.可表示为CO2+H2=H2O(g)+CO
c.CO未参与反应
d.Fe3O4、CaO为催化剂,降低了反应的ΔH
②写出过程Ⅲ的热化学方程式为:
您最近一年使用:0次
2020-10-24更新
|
193次组卷
|
2卷引用:河北省邢台市巨鹿中学2020-2021学年高二上学期第一次月考化学试题
名校
解题方法
8 . 在恒温的2L密闭容器中进行反应,气体X、Y,Z的物质的量随时间的变化曲线如图所示,反应在t时刻达到平衡。

(1)该反应的化学方程式是___ 。
(2)反应起始至t时刻,Y的平均反应速率是___ 。
(3)关于该反应的说法正确的是___ 。
a. 到达t时刻该反应已停止
b. 在t时刻正反应速率等于逆反应速率
c. 混合气体的密度不再改变说明该反应达到平衡
d. 达到化学平衡时,3v正(X)=2v逆(Y)
(4)tmin后,体系内的压强与反应前的压强之比为:___ 。

(1)该反应的化学方程式是
(2)反应起始至t时刻,Y的平均反应速率是
(3)关于该反应的说法正确的是
a. 到达t时刻该反应已停止
b. 在t时刻正反应速率等于逆反应速率
c. 混合气体的密度不再改变说明该反应达到平衡
d. 达到化学平衡时,3v正(X)=2v逆(Y)
(4)tmin后,体系内的压强与反应前的压强之比为:
您最近一年使用:0次
解题方法
9 . 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
(1)Bunsen热化学循环制氢工艺流程图如下:
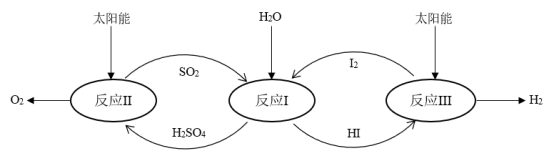
①下列说法错误的是______ (填字母序号)。
A.该过程实现了太阳能化学能的转化
B. 和
和 对总反应起到了催化剂的作用
对总反应起到了催化剂的作用
C.该过程的3个反应均是氧化还原反应
D.常温下,该过程的3个反应均为自发反应
②已知: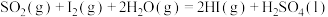
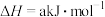
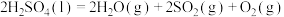
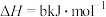
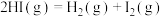
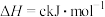
则:
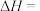
______  (用含
(用含 、
、 、
、 的代数式表示)。
的代数式表示)。
(2)以甲烷为原料制取氢气是工业上常用的制氢方法。已知有关化学反应的能量变化如图所示。
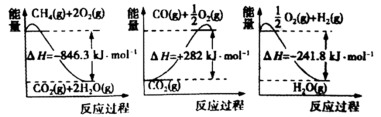
①下列说法正确的是______ (填字母序号)
A. 的燃烧热为
的燃烧热为 B.
B. 的燃烧热为
的燃烧热为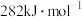
C. 的燃烧热为
的燃烧热为 D.
D. 为放热反应
为放热反应
② 与
与 反应生成
反应生成 和
和 的热化学方程式为
的热化学方程式为________________________ 。
(3)中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,其主要过程可表示为:
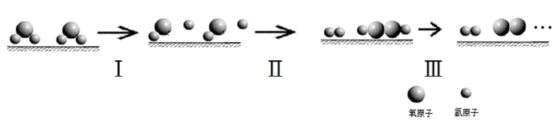
已知:几种物质有关键能[形成(断开) 共价键释放(吸收)的能量]如下表所示。
共价键释放(吸收)的能量]如下表所示。
若反应过程中分解了 ,过程Ⅲ的
,过程Ⅲ的
______  。
。
(1)Bunsen热化学循环制氢工艺流程图如下:

①下列说法错误的是
A.该过程实现了太阳能化学能的转化
B.
 和
和 对总反应起到了催化剂的作用
对总反应起到了催化剂的作用C.该过程的3个反应均是氧化还原反应
D.常温下,该过程的3个反应均为自发反应
②已知:
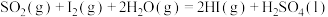
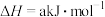
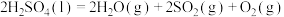
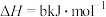
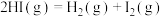
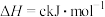
则:

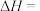
 (用含
(用含 、
、 、
、 的代数式表示)。
的代数式表示)。(2)以甲烷为原料制取氢气是工业上常用的制氢方法。已知有关化学反应的能量变化如图所示。

①下列说法正确的是
A.
 的燃烧热为
的燃烧热为 B.
B. 的燃烧热为
的燃烧热为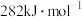
C.
 的燃烧热为
的燃烧热为 D.
D. 为放热反应
为放热反应②
 与
与 反应生成
反应生成 和
和 的热化学方程式为
的热化学方程式为(3)中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,其主要过程可表示为:

已知:几种物质有关键能[形成(断开)
 共价键释放(吸收)的能量]如下表所示。
共价键释放(吸收)的能量]如下表所示。| 化学键 |  |  |  |  |
键能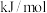 | 463 | 496 | 436 | 138 |
若反应过程中分解了
 ,过程Ⅲ的
,过程Ⅲ的
 。
。
您最近一年使用:0次
名校
解题方法
10 . 一定温度下,在 的密闭容器中,
的密闭容器中,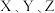 三种气体的物质的量随时间变化的曲线如图所示:
三种气体的物质的量随时间变化的曲线如图所示:
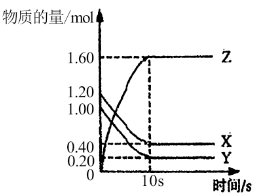
(1)反应的化学方程式为______ 。
(2)反应开始到 ,用X表示的平均反应速率为
,用X表示的平均反应速率为______ 。
(3)下列关于该反应的说法正确的是______ (填字母)。
A. 时,该反应已经停止 B.
时,该反应已经停止 B. 之前X的消耗速率小于它的生成速率
之前X的消耗速率小于它的生成速率
C. 时正反应速率等于逆反应速率 D.
时正反应速率等于逆反应速率 D. 时
时 的浓度保持不变
的浓度保持不变
 的密闭容器中,
的密闭容器中, 三种气体的物质的量随时间变化的曲线如图所示:
三种气体的物质的量随时间变化的曲线如图所示:
(1)反应的化学方程式为
(2)反应开始到
 ,用X表示的平均反应速率为
,用X表示的平均反应速率为(3)下列关于该反应的说法正确的是
A.
 时,该反应已经停止 B.
时,该反应已经停止 B. 之前X的消耗速率小于它的生成速率
之前X的消耗速率小于它的生成速率C.
 时正反应速率等于逆反应速率 D.
时正反应速率等于逆反应速率 D. 时
时 的浓度保持不变
的浓度保持不变
您最近一年使用:0次



