名校
1 . 已知黄钠铁矾[NaxFey(SO4)m(OH)n]具有沉淀颗粒大、沉淀速率快、容易过滤等特点。某研究小组先将某废水中Fe2+氧化为Fe3+,再加入Na2SO4使其生成黄钠铁矾而除去。该小组为测定黄钠铁矾的组成,进行了如下实验:
①称取4.850 g样品,加盐酸完全溶解后,配成100.00 mL溶液A;
②量取25.00 mL溶液A,加入足量的KI,用0.2500 mol·L-1Na2S2O3溶液进行滴定(反应为I2+2Na2S2O3=2NaI+Na2S4O6),消耗30.00 mLNa2S2O3溶液至终点。
③另取25.00 mL溶液A,加足量BaCl2溶液充分反应后,过滤、洗涤、干燥后得沉淀1.165 g。
(1)如何证明步骤③中的沉淀已洗涤干净?___________ 。
(2)用Na2S2O3溶液进行滴定时,使用的指示剂为________ ,滴定到终点的颜色变化为_________ 。
(3)通过计算确定黄钠铁矾的化学式_________ (写出计算过程)。
①称取4.850 g样品,加盐酸完全溶解后,配成100.00 mL溶液A;
②量取25.00 mL溶液A,加入足量的KI,用0.2500 mol·L-1Na2S2O3溶液进行滴定(反应为I2+2Na2S2O3=2NaI+Na2S4O6),消耗30.00 mLNa2S2O3溶液至终点。
③另取25.00 mL溶液A,加足量BaCl2溶液充分反应后,过滤、洗涤、干燥后得沉淀1.165 g。
(1)如何证明步骤③中的沉淀已洗涤干净?
(2)用Na2S2O3溶液进行滴定时,使用的指示剂为
(3)通过计算确定黄钠铁矾的化学式
您最近一年使用:0次
2 . 已知:硝酸铜受热易分解。170℃时,2Cu(NO3)2 2CuO+4NO2↑+O2↑开始分解,至250℃分解完全。(其中2NO2
2CuO+4NO2↑+O2↑开始分解,至250℃分解完全。(其中2NO2 N2O4,2NO2
N2O4,2NO2 2NO+O2等反应忽略不计)。
2NO+O2等反应忽略不计)。
800℃时,4CuO 2Cu2O+O2↑ 开始分解,至1000℃以上分解完全。
2Cu2O+O2↑ 开始分解,至1000℃以上分解完全。
(1)取5.64 g无水硝酸铜,加热至1000℃以上,将生成的气体导入足量的NaOH溶液充分吸收后,还有逸出的气体是____ (填分子式),体积(标准状况)为______ ;将吸收液加水稀释到100 mL,此溶液中NO3-的物质的量浓度为_____________ 。
(2)取5.64 g无水硝酸铜加热至某温度分解后的残留固体中含有1.60 g CuO,则残留固体的质量可能是_________ 。
(3)实验证明,当温度达到1800℃时,Cu2O也会发生分解:2Cu2O 4Cu+O2↑。取8.00 g CuO,加热到1800℃左右,冷却后称得质量为6.88 g,通过计算求出反应后剩余固体中各成分的物质的量之比________________ 。
(4)取8.00 g CuO,通入一定量H2并加热,使其部分还原为Cu和Cu2O,且其中n(Cu2O):n(Cu)=x。将此混合物溶于足量的稀硫酸中(Cu2O+2H+=Cu+Cu2++H2O),充分反应后过滤得到Cu y g,试求未被还原的CuO的物质的量(用含x、y的代数式表示)。_________
 2CuO+4NO2↑+O2↑开始分解,至250℃分解完全。(其中2NO2
2CuO+4NO2↑+O2↑开始分解,至250℃分解完全。(其中2NO2 N2O4,2NO2
N2O4,2NO2 2NO+O2等反应忽略不计)。
2NO+O2等反应忽略不计)。800℃时,4CuO
 2Cu2O+O2↑ 开始分解,至1000℃以上分解完全。
2Cu2O+O2↑ 开始分解,至1000℃以上分解完全。(1)取5.64 g无水硝酸铜,加热至1000℃以上,将生成的气体导入足量的NaOH溶液充分吸收后,还有逸出的气体是
(2)取5.64 g无水硝酸铜加热至某温度分解后的残留固体中含有1.60 g CuO,则残留固体的质量可能是
(3)实验证明,当温度达到1800℃时,Cu2O也会发生分解:2Cu2O 4Cu+O2↑。取8.00 g CuO,加热到1800℃左右,冷却后称得质量为6.88 g,通过计算求出反应后剩余固体中各成分的物质的量之比
(4)取8.00 g CuO,通入一定量H2并加热,使其部分还原为Cu和Cu2O,且其中n(Cu2O):n(Cu)=x。将此混合物溶于足量的稀硫酸中(Cu2O+2H+=Cu+Cu2++H2O),充分反应后过滤得到Cu y g,试求未被还原的CuO的物质的量(用含x、y的代数式表示)。
您最近一年使用:0次
名校
3 . 现准确称取0.92g 的有机物样品(只含C、H、O三种元素中的两种或三种),完全燃烧后生成的CO2为1.76g,生成的水1.08g。回答下列问题:
(1)则该有机物的元素组成为:______ ,最简式为________ 。
(2)根据上述结果能否写出该有机物可能的结构简式:________ (填“能”或“不能”)。若能,请写出该有机物各种可能的结构简式为:_____________
(3)请设计简单实验证明该有机物是上述何种物质(备选试剂:NaOH溶液、石蕊试液、Na、冰醋酸、CaCO3 实验仪器自选):____________________ 。
(1)则该有机物的元素组成为:
(2)根据上述结果能否写出该有机物可能的结构简式:
(3)请设计简单实验证明该有机物是上述何种物质(备选试剂:NaOH溶液、石蕊试液、Na、冰醋酸、CaCO3 实验仪器自选):
您最近一年使用:0次
4 . 有机物A的蒸汽密度为6.69g·L-1(已折算为标况),现取15g A完全氧化,产物依次通过浓硫酸和碱石灰,浓硫酸增重9g,碱石灰增重39.6g。用现代物理方法测定:
①核磁共振仪测出A的核磁共振氢谱有5组峰,其峰面积之比为1:2:2:2:3。
②利用红外光谱仪可初步检测有机化合物中的某些基团,现测得A分子中具有一个苯环结构,一个C-O-C结构和一个C=O结构,且A的苯环上只有一取代基。
③性质实验证明,A能在稀硫酸作用下生成两种有机物,且其中一种有酸性。
(1)通过计算求A的相对分子质量及分子式。
(2)根据谱图信息写出A的三种可能结构。
①核磁共振仪测出A的核磁共振氢谱有5组峰,其峰面积之比为1:2:2:2:3。
②利用红外光谱仪可初步检测有机化合物中的某些基团,现测得A分子中具有一个苯环结构,一个C-O-C结构和一个C=O结构,且A的苯环上只有一取代基。
③性质实验证明,A能在稀硫酸作用下生成两种有机物,且其中一种有酸性。
(1)通过计算求A的相对分子质量及分子式。
(2)根据谱图信息写出A的三种可能结构。
您最近一年使用:0次
名校
5 . CH3OH是一种重要的化工原料,广泛应用于化工生产,根据所学回答下列问题:
(1)工业上制备甲醇的反应方程式为: ,某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:
,某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:
①写出该反应体系中CO2的电子式___________ 。
②用H2表示前2h的平均反应速率v(H2)=___________ 。
③该温度下,CO2的平衡转化率为___________ 。
④在一定条件下,下列说法能说明该可逆反应达到平衡状态的是___________ (填字母)。
A.容器中气体密度不变 B.容器中气体平均摩尔质量不变
C. D.形成2molC=O键同时断裂3molH-H键
D.形成2molC=O键同时断裂3molH-H键
⑤在温度为T,压强为P的条件下,将CO2和H2按物质的量之比1∶3通入一恒压密闭容器中发生上述反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为
___________ (用含P的表达式表示,其中用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)CH3OH制备丙烯的反应为: ,速率常数k与反应温度T的关系遵循Arrhenius方程,已知Arrhenius方程为:
,速率常数k与反应温度T的关系遵循Arrhenius方程,已知Arrhenius方程为: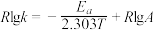 (其中k为速率常数,反应速率与其成正比;
(其中k为速率常数,反应速率与其成正比;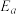 为活化能:
为活化能: ,A为常数)。
,A为常数)。

①在一定条件下,测得实验数据如上图曲线a所示。则该条件下,反应的活化能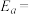
___________ 
②若实验时改变外界条件,测得实验数据为如上图曲线b所示,则可能改变的外界条件是___________ (填标号)
A.升高温度 B.增大压强 C.增大 D.更换适宜的催化剂
D.更换适宜的催化剂
(1)工业上制备甲醇的反应方程式为:
 ,某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:
,某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:| 时间/h | l | 2 | 3 | 4 | 5 | 6 |
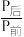 | 0.90 | 0.85 | 0.83 | 0.81 | 0.80 | 0.80 |
②用H2表示前2h的平均反应速率v(H2)=
③该温度下,CO2的平衡转化率为
④在一定条件下,下列说法能说明该可逆反应达到平衡状态的是
A.容器中气体密度不变 B.容器中气体平均摩尔质量不变
C.
 D.形成2molC=O键同时断裂3molH-H键
D.形成2molC=O键同时断裂3molH-H键⑤在温度为T,压强为P的条件下,将CO2和H2按物质的量之比1∶3通入一恒压密闭容器中发生上述反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为

(2)CH3OH制备丙烯的反应为:
 ,速率常数k与反应温度T的关系遵循Arrhenius方程,已知Arrhenius方程为:
,速率常数k与反应温度T的关系遵循Arrhenius方程,已知Arrhenius方程为: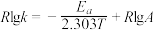 (其中k为速率常数,反应速率与其成正比;
(其中k为速率常数,反应速率与其成正比;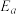 为活化能:
为活化能: ,A为常数)。
,A为常数)。
①在一定条件下,测得实验数据如上图曲线a所示。则该条件下,反应的活化能
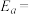

②若实验时改变外界条件,测得实验数据为如上图曲线b所示,则可能改变的外界条件是
A.升高温度 B.增大压强 C.增大
 D.更换适宜的催化剂
D.更换适宜的催化剂
您最近一年使用:0次
2023-06-30更新
|
475次组卷
|
2卷引用:重庆市西南大学附属中学2022-2023学年高一下学期期末考试化学试题
名校
6 . I.氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40~50℃时反应可生成它。CuH具有的性质有:不稳定,易分解;在氯气中能燃烧;与稀盐酸反应能生成气体;Cu+在酸性条件下发生的反应是:2Cu+ = Cu2++Cu。根据以上信息,结合自己所掌握的化学知识,回答下列问题:
(1)用CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中作____ (填“氧化剂”或“还原剂”)。
(2)CuH溶解在稀盐酸中生成的气体是_____ (填化学式)。
(3)氯气具有很强的氧化性,能将多数物质氧化到较高价态,试写出CuH在氯气中燃烧的化学反应方程式:____
II.已知PbO2具有强氧化性,某强酸性反应体系中,反应物和生成物共六种物质:PbO2、PbSO4(难溶盐)、Pb(MnO4)2(强电解质)、H2O、X(水溶液呈无色)、H2SO4,已知X是一种盐,且0.1 mol X在该反应中失去3.01×1023个电子。
(4)写出X的化学式:_______ ;
(5)若有9.8 g H2SO4参加反应,则转移电子的物质的量为_______ mol
III.下列有关说法正确的有_______
①过氧化钠与二氧化硫反应类似于过氧化钠与二氧化碳反应
②室温下,Al与少量NaOH溶液反应生成Al(OH)3
③金属钠储存在装有煤油的广口瓶中
④可用浓硫酸干燥二氧化硫
⑤明矾可用作净水剂和消毒剂
⑥用二氧化碳灭火器扑灭金属钾的燃烧
⑦湿润的红色酚酞试纸遇氯化氢气体变无色
(1)用CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中作
(2)CuH溶解在稀盐酸中生成的气体是
(3)氯气具有很强的氧化性,能将多数物质氧化到较高价态,试写出CuH在氯气中燃烧的化学反应方程式:
II.已知PbO2具有强氧化性,某强酸性反应体系中,反应物和生成物共六种物质:PbO2、PbSO4(难溶盐)、Pb(MnO4)2(强电解质)、H2O、X(水溶液呈无色)、H2SO4,已知X是一种盐,且0.1 mol X在该反应中失去3.01×1023个电子。
(4)写出X的化学式:
(5)若有9.8 g H2SO4参加反应,则转移电子的物质的量为
III.下列有关说法正确的有
①过氧化钠与二氧化硫反应类似于过氧化钠与二氧化碳反应
②室温下,Al与少量NaOH溶液反应生成Al(OH)3
③金属钠储存在装有煤油的广口瓶中
④可用浓硫酸干燥二氧化硫
⑤明矾可用作净水剂和消毒剂
⑥用二氧化碳灭火器扑灭金属钾的燃烧
⑦湿润的红色酚酞试纸遇氯化氢气体变无色
您最近一年使用:0次
7 . 已知:N2O4(g)⇌2NO2(g) =+52.70 kJ/mol。
=+52.70 kJ/mol。
(1)在恒温、恒容的已达平衡的密闭容器中,再向容器内充入1 mol N2O4(g),并达新平衡,下列说法正确的______
a.N2O4(g)的转化率增大
b.平衡常数K减小
c.新平衡N2O4的百分含量比原平衡大
d.新平衡透明容器的气体颜色比原平衡还要深
(2)t℃恒温下,在固定容积为2 L的密闭容器中充入0.54 mol N2O4,2分钟时达到化学平衡,测得容器中含n(NO2)=0.6 mol,则在前2分钟的平均反应速率v(NO2)=_______ ,t℃时反应N2O4(g)⇌2NO2(g)的平衡常数K=________ 。
(3)现有两个体积均为2 L的恒容绝热(不与外界进行热交换)密闭容器甲和乙,若在甲容器中加入1 mol N2O4,在乙容器加入2 mol NO2,分别达平衡后,甲容器N2O4(g)⇌2NO2(g)的平衡常数_______ 乙容器N2O4(g)⇌2NO2(g)的平衡常数(填“大于”、“小于”或“等于”),甲容器中N2O4转化率与乙容器中NO2的转化率之和_________ 1(填“大于”、“小于”或“等于”)。
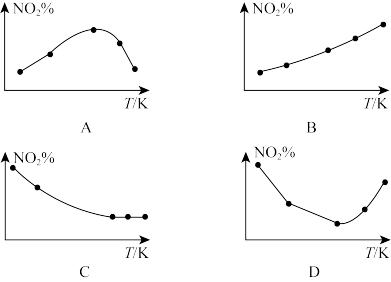
(4)取五等份NO2,分别加入温度不同、容积相同的恒容密闭容器中,发生反应2NO2(g)⇌N2O4(g)。反应相同时间后,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是__________
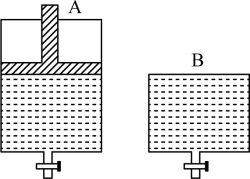
(5)一定温度下,若将3 mol N2O4气体置入开始体积为V但体积可变的等压密闭容器中(如图A),达平衡后容器体积增大至1.5V。若在另一个体积也为V但体积不变的密闭容器中(如图B)加入_______ mol NO2,达平衡后A、B两容器的NO2百分含量相等。
 =+52.70 kJ/mol。
=+52.70 kJ/mol。(1)在恒温、恒容的已达平衡的密闭容器中,再向容器内充入1 mol N2O4(g),并达新平衡,下列说法正确的
a.N2O4(g)的转化率增大
b.平衡常数K减小
c.新平衡N2O4的百分含量比原平衡大
d.新平衡透明容器的气体颜色比原平衡还要深
(2)t℃恒温下,在固定容积为2 L的密闭容器中充入0.54 mol N2O4,2分钟时达到化学平衡,测得容器中含n(NO2)=0.6 mol,则在前2分钟的平均反应速率v(NO2)=
(3)现有两个体积均为2 L的恒容绝热(不与外界进行热交换)密闭容器甲和乙,若在甲容器中加入1 mol N2O4,在乙容器加入2 mol NO2,分别达平衡后,甲容器N2O4(g)⇌2NO2(g)的平衡常数
(4)取五等份NO2,分别加入温度不同、容积相同的恒容密闭容器中,发生反应2NO2(g)⇌N2O4(g)。反应相同时间后,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是

(5)一定温度下,若将3 mol N2O4气体置入开始体积为V但体积可变的等压密闭容器中(如图A),达平衡后容器体积增大至1.5V。若在另一个体积也为V但体积不变的密闭容器中(如图B)加入

您最近一年使用:0次



