名校
1 . 现有一种铜粉和铝粉的混合物样品,为测定该样品中铝的含量,称取5.0g此样品置于锥形瓶中,将100mL稀盐酸加入其中恰好完全反应,剩余固体2.3g。
(1)求该混合物中铝的质量分数为多少?
(2)所用盐酸中溶质的物质的量浓度为多少?
(1)求该混合物中铝的质量分数为多少?
(2)所用盐酸中溶质的物质的量浓度为多少?
您最近一年使用:0次
2018-01-28更新
|
122次组卷
|
2卷引用:安徽省百花中学等四校联考2023-2024学年高二上学期11月期中化学试题
解题方法
2 . 人胃酸(主要成分是盐酸)过多,会引起很多胃病。下图为某抗酸药包装标签上的部分文字,请回答下列问题。

(1)该药“嚼碎后吞服”的原因是_____________________。
(2)某同学为测定该药中氢氧化铝的质量分数进行如下几步操作:取一片药片(药片质量为0.5g),研碎后加20mL蒸馏水,然后用质量分数为5%,密度为1.02g/mL的盐酸进行反应(假设其他成分不与盐酸反应),测得实验中反应掉的盐酸体积为6.0mL。通过计算:
①判断该药片中氢氧化铝的含量是否与标签相符;
②确定该药片中氢氧化铝的质量分数为多少。

(1)该药“嚼碎后吞服”的原因是_____________________。
(2)某同学为测定该药中氢氧化铝的质量分数进行如下几步操作:取一片药片(药片质量为0.5g),研碎后加20mL蒸馏水,然后用质量分数为5%,密度为1.02g/mL的盐酸进行反应(假设其他成分不与盐酸反应),测得实验中反应掉的盐酸体积为6.0mL。通过计算:
①判断该药片中氢氧化铝的含量是否与标签相符;
②确定该药片中氢氧化铝的质量分数为多少。
您最近一年使用:0次
名校
解题方法
3 . 某兴趣小组的同学模拟侯德榜制碱法制取纯碱,流程如图:

(1)向饱和NaCl溶液中通入 和氨气时,应先通入
和氨气时,应先通入___________ (填化学式)。操作①的名称为___________ 。
(2)写出反应①的化学方程式:___________ 。
(3)该流程中可循环利用的物质是___________ (填化学式)。
(4)现将 和
和 的固体均匀混合分成两等份。第一份充分加热至恒重,固体质量减少6.2g;第二份与足量稀盐酸充分反应后,加热、蒸干,得到固体23.4g。则混合物中
的固体均匀混合分成两等份。第一份充分加热至恒重,固体质量减少6.2g;第二份与足量稀盐酸充分反应后,加热、蒸干,得到固体23.4g。则混合物中 和
和 的物质的量之比为
的物质的量之比为___________ 。
(5)下列选项中哪种方法可以鉴别 溶液和
溶液和 溶液___________。
溶液___________。
(6)下列实验方案中,不能测定出 和
和 的混合物中
的混合物中 质量分数的是_______。
质量分数的是_______。
(7)钠是一种典型的碱金属元素,下列性质的递变规律正确,且能作为碱金属元素金属性递变规律判断依据的是___________(填字母)。

(1)向饱和NaCl溶液中通入
 和氨气时,应先通入
和氨气时,应先通入(2)写出反应①的化学方程式:
(3)该流程中可循环利用的物质是
(4)现将
 和
和 的固体均匀混合分成两等份。第一份充分加热至恒重,固体质量减少6.2g;第二份与足量稀盐酸充分反应后,加热、蒸干,得到固体23.4g。则混合物中
的固体均匀混合分成两等份。第一份充分加热至恒重,固体质量减少6.2g;第二份与足量稀盐酸充分反应后,加热、蒸干,得到固体23.4g。则混合物中 和
和 的物质的量之比为
的物质的量之比为(5)下列选项中哪种方法可以鉴别
 溶液和
溶液和 溶液___________。
溶液___________。| A.加入澄清石灰水 | B.加入氢氧化钠溶液 |
| C.加热 | D.逐滴加入稀盐酸 |
(6)下列实验方案中,不能测定出
 和
和 的混合物中
的混合物中 质量分数的是_______。
质量分数的是_______。| A.取ag混合物充分加热,质量减少bg |
| B.取ag混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得到bg固体 |
| C.取ag混合物与足量NaOH溶液充分反应,得到bg溶液 |
| D.取ag混合物与足量稀硫酸充分反应,逸出气体经干燥后用碱石灰吸收,质量增加bg |
(7)钠是一种典型的碱金属元素,下列性质的递变规律正确,且能作为碱金属元素金属性递变规律判断依据的是___________(填字母)。
| A.Li、Na、K的原子半径和密度都随原子序数的增加而增大 |
B.碱性: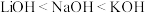 |
C.还原性: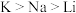 ,故K可以从NaCl溶液中置换出金属钠 ,故K可以从NaCl溶液中置换出金属钠 |
D.熔、沸点: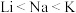 |
您最近一年使用:0次
2023-12-23更新
|
144次组卷
|
3卷引用:安徽省阜阳市第三中学2023-2024学年高一上学期1月期末化学试题
解题方法
4 . 为测定某种铝镁合金中铝的质量分数,探究小组进行了实验:称取质量为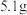 的合金,加入的稀盐酸,恰好完全反应,并产生了
的合金,加入的稀盐酸,恰好完全反应,并产生了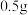 的氢气。计算铝镁合金中铝的质量分数是多少
的氢气。计算铝镁合金中铝的质量分数是多少_____ 。
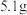 的合金,加入的稀盐酸,恰好完全反应,并产生了
的合金,加入的稀盐酸,恰好完全反应,并产生了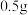 的氢气。计算铝镁合金中铝的质量分数是多少
的氢气。计算铝镁合金中铝的质量分数是多少
您最近一年使用:0次
名校
解题方法
5 . 回答下列问题:
(1)某化工厂用氯气与石灰乳生产漂白粉,该厂出厂产品说明书如下:

漂白粉的主要成分是CaCl2和Ca(ClO)2,其中有效成分为Ca(ClO)2,长期露置在空气中会变质,写出漂白粉变质过程中涉及的化学方程式_______ ,_______ 。
(2)若用43.50g二氧化锰与足量浓盐酸(质量分数为63.50%)完全反应,制取氯气。求:
①所得气体的质量为_______ 。
②若将所得气体全部用石灰乳吸收,所制得的漂白粉中所含有效成分的质量为_______ 。
(已知MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O ,本题要求写出计算步骤,答案保留2位小数)
MnCl2+Cl2↑+2H2O ,本题要求写出计算步骤,答案保留2位小数)
(1)某化工厂用氯气与石灰乳生产漂白粉,该厂出厂产品说明书如下:

漂白粉的主要成分是CaCl2和Ca(ClO)2,其中有效成分为Ca(ClO)2,长期露置在空气中会变质,写出漂白粉变质过程中涉及的化学方程式
(2)若用43.50g二氧化锰与足量浓盐酸(质量分数为63.50%)完全反应,制取氯气。求:
①所得气体的质量为
②若将所得气体全部用石灰乳吸收,所制得的漂白粉中所含有效成分的质量为
(已知MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O ,本题要求写出计算步骤,答案保留2位小数)
MnCl2+Cl2↑+2H2O ,本题要求写出计算步骤,答案保留2位小数)
您最近一年使用:0次
解题方法
6 . 某抗酸药的有效成分为碳酸钙。取0.2克药片研碎后加入30 ml 某浓度稀盐酸,恰好完全反应,生成33.6 mL CO2气体(标准状况下)。(假设药片中其他成分不与盐酸反应)。计算:
(1)药片中CaCO3的质量分数_______ 。
(2)所加稀盐酸的物质的量浓度_______ 。
(1)药片中CaCO3的质量分数
(2)所加稀盐酸的物质的量浓度
您最近一年使用:0次
名校
7 . 已知 2FeCl3+Fe=3FeCl2。在 FeCl3 溶液中加入一定量的 Fe,当反应进行到氯化铁和氯化亚铁的质量分数相等时,求此刻已参加反应的氯化铁和剩余的氯化铁的质量比_______ 。(相对分子质量 FeCl3:162.5 FeCl2:127 )
您最近一年使用:0次
名校
解题方法
8 . 填空。
(1)CH4、CO2和碳酸都是碳的重要化合物,实现碳及其化合物的相互转化。对开发新能源和降低碳排放意义重大。
已知:①
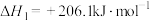
②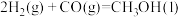
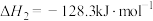
③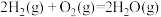
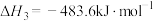
写出由甲烷和氧气合成液态甲醇的热化学方程式:_______ 。
(2)已知: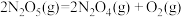
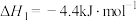
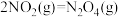
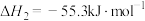
则反应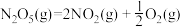 的△H=
的△H=_______ kJ∙mol-1。
(3)若将NaHSO4与Ba(OH)2在溶液中按物质的量之比为1:1混合,化学反应的离子方程式是_______ 。
(4)实验室现欲用质量分数为98%,密度为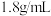 包的浓H2SO4溶液配制450 mL浓度为
包的浓H2SO4溶液配制450 mL浓度为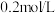 的稀H2SO4溶液,用量筒量取所需浓H2SO4溶液的体积是
的稀H2SO4溶液,用量筒量取所需浓H2SO4溶液的体积是_______ mL。
(1)CH4、CO2和碳酸都是碳的重要化合物,实现碳及其化合物的相互转化。对开发新能源和降低碳排放意义重大。
已知:①

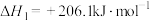
②
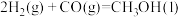
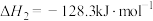
③
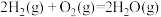
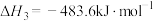
写出由甲烷和氧气合成液态甲醇的热化学方程式:
(2)已知:
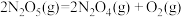
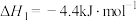
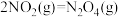
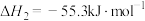
则反应
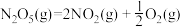 的△H=
的△H=(3)若将NaHSO4与Ba(OH)2在溶液中按物质的量之比为1:1混合,化学反应的离子方程式是
(4)实验室现欲用质量分数为98%,密度为
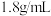 包的浓H2SO4溶液配制450 mL浓度为
包的浓H2SO4溶液配制450 mL浓度为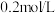 的稀H2SO4溶液,用量筒量取所需浓H2SO4溶液的体积是
的稀H2SO4溶液,用量筒量取所需浓H2SO4溶液的体积是
您最近一年使用:0次
名校
9 . 为了确定Na2CO3和NaHCO3混合物样品的组成,称取四份该样品溶于水后分别滴加相同浓度盐酸50.0g,充分反应,产生CO2的质量,如表。
已知Na2CO3和盐酸反应可分成以下两步:Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+H2O+CO2↑。
求:
(1)样品Na2CO3和NaHCO3的质量之比____ 。
(2)盐酸的质量分数____ 。
已知Na2CO3和盐酸反应可分成以下两步:Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+H2O+CO2↑。
| 实验序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 盐酸质量(g) | 50.0 | 50.0 | 50.0 | 50.0 |
| 样品质量(g) | 2.96 | 3.70 | 5.18 | 6.66 |
| CO2的质量(g) | 1.32 | 1.65 | 1.76 | 1.32 |
求:
(1)样品Na2CO3和NaHCO3的质量之比
(2)盐酸的质量分数
您最近一年使用:0次
12-13高三上·安徽滁州·阶段练习
名校
解题方法
10 . 在标准状况下,将224LHCl气体溶于635mL水中,所得盐酸的密度为1.18g·cm-3试计算:
(1)所得盐酸的质量分数和物质的量浓度分别是___________ 、___________ 。
(2)取这种盐酸100 mL,稀释至1.18L,所得稀盐酸的物质的量浓度是___________ 。
(3)在40.0 mL 0.065 mol·L-1Na2CO3溶液中,逐滴加入上述稀释后的稀盐酸,边加边振荡。若使反应不产生CO2气体,加入稀盐酸的体积最多不超过___________ mL。
(4)将不纯的NaOH样品1g(样品含少量Na2CO3和水),放入50mL2mol·L-1的盐酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40 mL1mol·L-1的NaOH溶液。蒸发中和后的溶液,最终得到___________ g固体。
(1)所得盐酸的质量分数和物质的量浓度分别是
(2)取这种盐酸100 mL,稀释至1.18L,所得稀盐酸的物质的量浓度是
(3)在40.0 mL 0.065 mol·L-1Na2CO3溶液中,逐滴加入上述稀释后的稀盐酸,边加边振荡。若使反应不产生CO2气体,加入稀盐酸的体积最多不超过
(4)将不纯的NaOH样品1g(样品含少量Na2CO3和水),放入50mL2mol·L-1的盐酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40 mL1mol·L-1的NaOH溶液。蒸发中和后的溶液,最终得到
您最近一年使用:0次
2021-01-11更新
|
752次组卷
|
22卷引用:2013届安徽省来安县半塔中学高三上学期第一次月考化学试卷
(已下线)2013届安徽省来安县半塔中学高三上学期第一次月考化学试卷安徽省阜阳市第三中学2019-2020学年高一上学期期末考试化学试题安徽省六安中学2021届高三上学期开学考试化学试题(已下线)2014年高考化学苏教版一轮复习1-2-2溶液的配制及误差分析练习卷2015-2016学年吉林省松原市油田高中高二下期中化学试卷2017届江西省新余一中、宜春一中高三7月联考化学试题2015-2016学年贵州省思南中学高二下学期期末化学卷(已下线)第04讲 一定物质的量浓度的溶液及其配制(精练)——2021年高考化学一轮复习讲练测(已下线)第02章 海水中的重要元素——钠和氯(B卷能力提高篇)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)湖南省邵阳市邵东县创新实验学校2021届高三上学期第一次月考化学试题甘肃省武威市第十八中学2021届高三上学期第一次月考化学试题黑龙江省实验中学2020-2021学年高一12月月考化学试题河南省新蔡县第一高级中学2020-2021学年高一上学期1月月考化学试题(已下线)第02讲 物质的量浓度与溶液的配制(精练)-2022年高考化学一轮复习讲练测(已下线)考点03 物质的量的浓度及溶液配制-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点03 物质的量的浓度及溶液配制-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题一 能力提升检测卷 (测) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)第02讲 物质的量浓度(练)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)第一单元 化学计量在实验中的应用(A卷 新题基础练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)(已下线)考点03 物质的量的浓度及溶液配制-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第02讲 物质的量浓度与溶液的配制(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)考点03 物质的量浓度及溶液配制(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)



