解题方法
1 . I.科学研究小组的同学为测定某Na2CO3和NaHCO3混合物中Na2CO3的质量分数,进行了下列相关实验。其实验流程如下:
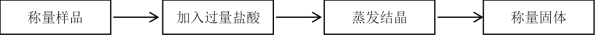
(1)该实验需要用到1.50 mol/L的稀盐酸500 mL,但实验室只有12.0 mol/L的浓盐酸。则配制稀盐酸所用浓盐酸_______ mL。
(2)若实验中测得样品质量为46.4 g,固体质量为40.95 g,请列式计算碳酸钠的质量分数_______ (保留3位有效数字)。
II.为测定某氯化亚铜样品中CuCl的含量,某同学设计如下实验:准确称取氯化亚铜样品m g,将其置于过量的FeCl3溶液中,待固体完全溶解后,加入适量稀硫酸,用a mol/L的K2Cr2O7溶液氧化反应生成的Fe2+,消耗K2Cr2O7溶液b mL,反应中 被还原为Cr3+。请列式计算样品中CuCl的质量分数
被还原为Cr3+。请列式计算样品中CuCl的质量分数_______ 。
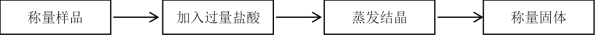
(1)该实验需要用到1.50 mol/L的稀盐酸500 mL,但实验室只有12.0 mol/L的浓盐酸。则配制稀盐酸所用浓盐酸
(2)若实验中测得样品质量为46.4 g,固体质量为40.95 g,请列式计算碳酸钠的质量分数
II.为测定某氯化亚铜样品中CuCl的含量,某同学设计如下实验:准确称取氯化亚铜样品m g,将其置于过量的FeCl3溶液中,待固体完全溶解后,加入适量稀硫酸,用a mol/L的K2Cr2O7溶液氧化反应生成的Fe2+,消耗K2Cr2O7溶液b mL,反应中
 被还原为Cr3+。请列式计算样品中CuCl的质量分数
被还原为Cr3+。请列式计算样品中CuCl的质量分数
您最近一年使用:0次
2021-01-27更新
|
270次组卷
|
2卷引用:山东省淄博市2020-2021学年高一上学期期末考试化学试题
9-10高二·山东·假期作业
2 . 氯化钙是用途广泛的化学试剂,可作干燥剂、冷冻剂、防冻剂等。为了测定某氯化钙样品中钙的含量,进行如下实验:
①准确称取氯化钙样品0.2312g,放入烧杯中,加入适量6mol/L的盐酸和适量蒸馏水使样品完全溶解,再滴加35mL0.25mol/L (NH4)2C2O4溶液,水浴加热,逐渐生成CaC2O4沉淀,经检验,Ca2+已沉淀完全。
②过滤并洗涤①所得沉淀。
③加入足量的10% H2SO4和适量的蒸馏水,②中沉淀完全溶解,溶液呈酸性,加热至75℃,趁热加入0.05mol/L KMnO4溶液16mL,恰好完全反应。
回答下列问题:
(1)配平:___ MnO4-+___ H2C2O4+___ H+―___ Mn2++____ CO2↑+___ H2O
(2)0.05mol·L-1KMnO4标准溶液应置于_________ (选填“酸式”或“碱式”)滴定管中;判断滴定终点的现象为__________________________________________________ 。
(3)计算该氯化钙样品中钙元素的质量分数(精确到0.01%)________________ 。
①准确称取氯化钙样品0.2312g,放入烧杯中,加入适量6mol/L的盐酸和适量蒸馏水使样品完全溶解,再滴加35mL0.25mol/L (NH4)2C2O4溶液,水浴加热,逐渐生成CaC2O4沉淀,经检验,Ca2+已沉淀完全。
②过滤并洗涤①所得沉淀。
③加入足量的10% H2SO4和适量的蒸馏水,②中沉淀完全溶解,溶液呈酸性,加热至75℃,趁热加入0.05mol/L KMnO4溶液16mL,恰好完全反应。
回答下列问题:
(1)配平:
(2)0.05mol·L-1KMnO4标准溶液应置于
(3)计算该氯化钙样品中钙元素的质量分数(精确到0.01%)
您最近一年使用:0次
3 . 实验室用稀盐酸和大理石(杂质不与稀盐酸反应)反应制取二氧化碳。某兴趣小组为测定该实验废液的成分,取100g废液,向其中加入溶质质量分数为20%的碳酸钠溶液,生成沉淀的质量与加入碳酸钠溶液的质量关系如图所示。

(1)当加入碳酸钠溶液的质量为53g时,所得溶液的质量为___________ g。
(2)废液中氯化氢的质量分数为___________ 。
(3)当加入159g碳酸钠溶液时,所得溶液中溶质的质量为___________ g。

(1)当加入碳酸钠溶液的质量为53g时,所得溶液的质量为
(2)废液中氯化氢的质量分数为
(3)当加入159g碳酸钠溶液时,所得溶液中溶质的质量为
您最近一年使用:0次
解题方法
4 . 硫代硫酸钠 的俗名是大苏打,在化学实验中有广泛应用。
的俗名是大苏打,在化学实验中有广泛应用。
(1)实验室可通过向含 和
和 的溶液中通入
的溶液中通入 来制备
来制备 (其简单流程如图所示)。
(其简单流程如图所示)。

①写出制备 的化学方程式:
的化学方程式:________________ 。
②“一系列操作”包括________ 、________ 、过滤、洗涤、干燥。(填操作名称)
(2)工业上,常用 溶液吸收尾气中的
溶液吸收尾气中的 ,氧化产物为
,氧化产物为 。写出发生反应的离子方程式:
。写出发生反应的离子方程式:_______ 。
(3)临床上, 可用于氰化物解毒,解毒原理:
可用于氰化物解毒,解毒原理: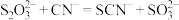 。检验该转化生成了
。检验该转化生成了 的操作为
的操作为________________ 。
(4)工业上,测定 样品纯度的方法:取
样品纯度的方法:取 样品溶于稀硫酸,加入足量
样品溶于稀硫酸,加入足量 溶液,再加入
溶液,再加入 的
的 溶液至恰好完全反应,消耗
溶液至恰好完全反应,消耗 溶液
溶液 。
。
相关反应: ;
;
 。
。
①该样品中 的质量分数为
的质量分数为________ (假设杂质不参与反应)。
②如果稀硫酸过多,测得结果会________ (填“偏高”、“偏低”或“无影响”)。
 的俗名是大苏打,在化学实验中有广泛应用。
的俗名是大苏打,在化学实验中有广泛应用。(1)实验室可通过向含
 和
和 的溶液中通入
的溶液中通入 来制备
来制备 (其简单流程如图所示)。
(其简单流程如图所示)。
①写出制备
 的化学方程式:
的化学方程式:②“一系列操作”包括
(2)工业上,常用
 溶液吸收尾气中的
溶液吸收尾气中的 ,氧化产物为
,氧化产物为 。写出发生反应的离子方程式:
。写出发生反应的离子方程式:(3)临床上,
 可用于氰化物解毒,解毒原理:
可用于氰化物解毒,解毒原理: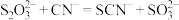 。检验该转化生成了
。检验该转化生成了 的操作为
的操作为(4)工业上,测定
 样品纯度的方法:取
样品纯度的方法:取 样品溶于稀硫酸,加入足量
样品溶于稀硫酸,加入足量 溶液,再加入
溶液,再加入 的
的 溶液至恰好完全反应,消耗
溶液至恰好完全反应,消耗 溶液
溶液 。
。相关反应:
 ;
; 。
。①该样品中
 的质量分数为
的质量分数为②如果稀硫酸过多,测得结果会
您最近一年使用:0次
解题方法
5 . 工业上碳酸钠大多采用侯氏制碱法制取,所得碳酸钠样品中往往含有少量的NaCl,现欲测定某碳酸钠样品中Na2CO3的质量分数,某探究性学习小组设计以下两种方案。
Ⅰ.取样品bg,设计如下实验方案,操作步骤如下:
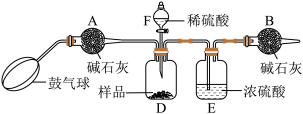
①如图连接装置(除B外)并加入所需药品。
②称量并记录B的质量(a1g)。
③按动鼓气球,持续约1分钟。
④连接上B。
⑤打开分液漏斗F的活塞,将稀硫酸快速加入D中后,关闭活塞。
⑥按动鼓气球,持续约1分钟。
⑦称量并记录B的质量(a2g)。
⑧计算
(1)操作③中,鼓入空气的作用是_______ ;操作⑥中,鼓入空气的作用是_______ ;
(2)根据题干所给的数据列出样品中Na2CO3的质量分数表达式_______ 。
(3)经实验发现最终所得的 Na2CO3的质量分数超过100%,其可能的原因是_______ 。
Ⅱ.现有碳酸钠和氯化钠的混合物样品25g,将其放入干净的烧杯中,加入一定量的水,使其完全溶解得到200mL溶液。向所得溶液中慢慢加入4mol•L-1的盐酸,烧杯中溶液的质量与加入盐酸的体积关系曲线如图所示。请回答下列问题。
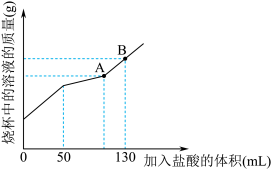
(4)加入50mL盐酸时,写出反应的离子反应方程式_______ 。
(5)在这个样品中,含碳酸钠的质量分数为_______ 。
(6)A点时,溶液溶质是_______ ,所得溶质质量分数为_______ 。(忽略体积的微小变化,结果保留小数点后两位)。
Ⅰ.取样品bg,设计如下实验方案,操作步骤如下:

①如图连接装置(除B外)并加入所需药品。
②称量并记录B的质量(a1g)。
③按动鼓气球,持续约1分钟。
④连接上B。
⑤打开分液漏斗F的活塞,将稀硫酸快速加入D中后,关闭活塞。
⑥按动鼓气球,持续约1分钟。
⑦称量并记录B的质量(a2g)。
⑧计算
(1)操作③中,鼓入空气的作用是
(2)根据题干所给的数据列出样品中Na2CO3的质量分数表达式
(3)经实验发现最终所得的 Na2CO3的质量分数超过100%,其可能的原因是
Ⅱ.现有碳酸钠和氯化钠的混合物样品25g,将其放入干净的烧杯中,加入一定量的水,使其完全溶解得到200mL溶液。向所得溶液中慢慢加入4mol•L-1的盐酸,烧杯中溶液的质量与加入盐酸的体积关系曲线如图所示。请回答下列问题。

(4)加入50mL盐酸时,写出反应的离子反应方程式
(5)在这个样品中,含碳酸钠的质量分数为
(6)A点时,溶液溶质是
您最近一年使用:0次
名校
6 . 某化学兴趣小组为测定某工厂生产的 的纯度(即质量分数),称取10.0g该
的纯度(即质量分数),称取10.0g该 样品放于烧杯中,加水使之完全溶解,再向烧杯中加入60.0g溶质质量分数为16%的NaOH溶液,充分反应后,过滤,将沉淀洗涤、常温干燥,称得固体质量为5.8g。(已知:该
样品放于烧杯中,加水使之完全溶解,再向烧杯中加入60.0g溶质质量分数为16%的NaOH溶液,充分反应后,过滤,将沉淀洗涤、常温干燥,称得固体质量为5.8g。(已知:该 产品中含有少量
产品中含有少量 等杂质,杂质均能溶于水,且不与NaOH反应)
等杂质,杂质均能溶于水,且不与NaOH反应)
请计算:
(1)假设60.0g溶质质量分数为16%的NaOH溶液完全反应,需要 的质量是
的质量是_______ (不写计算过程)。由此可以判断,烧杯内10.0g样品中的
_______ (填“全部”或“部分”)与NaOH溶液发生了反应。
(2)该样品中 的质量分数是多少?(写出计算过程)
的质量分数是多少?(写出计算过程) _______
 的纯度(即质量分数),称取10.0g该
的纯度(即质量分数),称取10.0g该 样品放于烧杯中,加水使之完全溶解,再向烧杯中加入60.0g溶质质量分数为16%的NaOH溶液,充分反应后,过滤,将沉淀洗涤、常温干燥,称得固体质量为5.8g。(已知:该
样品放于烧杯中,加水使之完全溶解,再向烧杯中加入60.0g溶质质量分数为16%的NaOH溶液,充分反应后,过滤,将沉淀洗涤、常温干燥,称得固体质量为5.8g。(已知:该 产品中含有少量
产品中含有少量 等杂质,杂质均能溶于水,且不与NaOH反应)
等杂质,杂质均能溶于水,且不与NaOH反应)请计算:
(1)假设60.0g溶质质量分数为16%的NaOH溶液完全反应,需要
 的质量是
的质量是
(2)该样品中
 的质量分数是多少?(写出计算过程)
的质量分数是多少?(写出计算过程)
您最近一年使用:0次
2022-09-09更新
|
225次组卷
|
2卷引用:山东省临沂市重点中学2022-2023学年高一上学期9月入学考试化学试题
2021·山东·模拟预测
7 . 某FeC2O4﹒2H2O样品中可能含有的杂质为Fe2(C2O4)3、H2C2O4﹒2H2O,采用KMnO4滴定法测定该样品的组成,实验步骤如图:
Ⅰ.取mg样品于锥形瓶中,加入稀H2SO4溶解,水浴加热至75℃。用cmol﹒L-1的KMnO4溶液趁热滴定至溶液出现粉红色且30s内不褪色,消耗KMnO4溶液V1mL。
Ⅱ.向上述溶液中加入适量还原剂将Fe3+完全还原为Fe2+,加入稀H2SO4酸化后,在75℃继续用KMnO4溶液滴定至溶液出现粉红色且30s内不褪色,又消耗KMnO4溶液V2mL。
样品中所含H2C2O4·2H2O(M=126g·mol-1)的质量分数表达式为___ 。
Ⅰ.取mg样品于锥形瓶中,加入稀H2SO4溶解,水浴加热至75℃。用cmol﹒L-1的KMnO4溶液趁热滴定至溶液出现粉红色且30s内不褪色,消耗KMnO4溶液V1mL。
Ⅱ.向上述溶液中加入适量还原剂将Fe3+完全还原为Fe2+,加入稀H2SO4酸化后,在75℃继续用KMnO4溶液滴定至溶液出现粉红色且30s内不褪色,又消耗KMnO4溶液V2mL。
样品中所含H2C2O4·2H2O(M=126g·mol-1)的质量分数表达式为
您最近一年使用:0次
解题方法
8 . 化学正在走向精准。当代化学的三大支柱是:理论、实验和计算。
Ⅰ.某溶液为硫酸和硝酸混合后的稀溶液,取200.00mL,该溶液加入过量锌粉充分反应。反应后溶液中只含有一种溶质,其浓度为 (溶液体积不变),收集到无色气体6.72L(标准状况),请列式计算溶液中硫酸和硝酸的浓度比,及产生的氢气的体积(标准状况)。
(溶液体积不变),收集到无色气体6.72L(标准状况),请列式计算溶液中硫酸和硝酸的浓度比,及产生的氢气的体积(标准状况)。______
Ⅱ.某硫铜矿的主要成分为 ,可用于冶炼金属铜,为测定矿石中
,可用于冶炼金属铜,为测定矿石中 的质量分数,进行如下实验(杂质不参加反应):
的质量分数,进行如下实验(杂质不参加反应):
步骤1:在1.00g试样中加入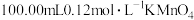 的酸性溶液,加热,硫元素全部转化为
的酸性溶液,加热,硫元素全部转化为 ,铜元素全部转化为
,铜元素全部转化为 ,滤去不溶性杂质。
,滤去不溶性杂质。
步骤2:收集步骤1所得滤液至250mL容量瓶中,定容。取25.00mL溶液,用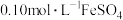 溶液与剩余
溶液与剩余 恰好反应,消耗10.00mL。列式计算
恰好反应,消耗10.00mL。列式计算 的质量分数
的质量分数______ 。
Ⅰ.某溶液为硫酸和硝酸混合后的稀溶液,取200.00mL,该溶液加入过量锌粉充分反应。反应后溶液中只含有一种溶质,其浓度为
 (溶液体积不变),收集到无色气体6.72L(标准状况),请列式计算溶液中硫酸和硝酸的浓度比,及产生的氢气的体积(标准状况)。
(溶液体积不变),收集到无色气体6.72L(标准状况),请列式计算溶液中硫酸和硝酸的浓度比,及产生的氢气的体积(标准状况)。Ⅱ.某硫铜矿的主要成分为
 ,可用于冶炼金属铜,为测定矿石中
,可用于冶炼金属铜,为测定矿石中 的质量分数,进行如下实验(杂质不参加反应):
的质量分数,进行如下实验(杂质不参加反应):步骤1:在1.00g试样中加入
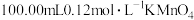 的酸性溶液,加热,硫元素全部转化为
的酸性溶液,加热,硫元素全部转化为 ,铜元素全部转化为
,铜元素全部转化为 ,滤去不溶性杂质。
,滤去不溶性杂质。步骤2:收集步骤1所得滤液至250mL容量瓶中,定容。取25.00mL溶液,用
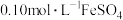 溶液与剩余
溶液与剩余 恰好反应,消耗10.00mL。列式计算
恰好反应,消耗10.00mL。列式计算 的质量分数
的质量分数
您最近一年使用:0次
9 .  是一种消毒、杀菌效率高、二次污染小的水处理剂,实验室可通过以下反应制得:
是一种消毒、杀菌效率高、二次污染小的水处理剂,实验室可通过以下反应制得: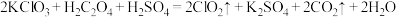 。试回答下列问题。
。试回答下列问题。
(1)若反应共产生了 气体(标准状况),则反应转移电子的物质的量为
气体(标准状况),则反应转移电子的物质的量为_______ 。
(2)标准状况下 的
的 气体恰好能与
气体恰好能与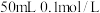 的
的 溶液完全反应生成
溶液完全反应生成 ,此过程所发生的离子方程式为
,此过程所发生的离子方程式为_______ 。
(3)常温下,可用氯酸钾固体与浓盐酸反应制备 ,写出反应的化学方程式
,写出反应的化学方程式_______ ,若氧化产物比还原产物多 ,则被氧化
,则被氧化 的物质的量为
的物质的量为_______  。
。
(4)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克 的氧化能力,
的氧化能力, 的有效氯含量为
的有效氯含量为_______ 。(计算结果保留两位小数)
 是一种消毒、杀菌效率高、二次污染小的水处理剂,实验室可通过以下反应制得:
是一种消毒、杀菌效率高、二次污染小的水处理剂,实验室可通过以下反应制得: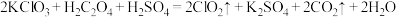 。试回答下列问题。
。试回答下列问题。(1)若反应共产生了
 气体(标准状况),则反应转移电子的物质的量为
气体(标准状况),则反应转移电子的物质的量为(2)标准状况下
 的
的 气体恰好能与
气体恰好能与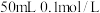 的
的 溶液完全反应生成
溶液完全反应生成 ,此过程所发生的离子方程式为
,此过程所发生的离子方程式为(3)常温下,可用氯酸钾固体与浓盐酸反应制备
 ,写出反应的化学方程式
,写出反应的化学方程式 ,则被氧化
,则被氧化 的物质的量为
的物质的量为 。
。(4)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克
 的氧化能力,
的氧化能力, 的有效氯含量为
的有效氯含量为
您最近一年使用:0次
10 . 1774年,瑞典化学家舍勒发现软锰矿(主要成分是 )和浓盐酸混合加热能制取氯气:
)和浓盐酸混合加热能制取氯气: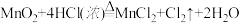 。现将
。现将 含
含 的质量分数为75%的软锰矿石与足量
的质量分数为75%的软锰矿石与足量 浓盐酸完全反应(杂质不参加反应)。
浓盐酸完全反应(杂质不参加反应)。
计算:
(1)参加反应的 的质量
的质量___________ 
(2)生成的 的体积(标准状况)
的体积(标准状况)___________ 
(3)反应中被氧化的 的物质的量
的物质的量___________ 
(4)参加反应的浓盐酸的体积___________ 
 )和浓盐酸混合加热能制取氯气:
)和浓盐酸混合加热能制取氯气: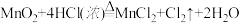 。现将
。现将 含
含 的质量分数为75%的软锰矿石与足量
的质量分数为75%的软锰矿石与足量 浓盐酸完全反应(杂质不参加反应)。
浓盐酸完全反应(杂质不参加反应)。计算:
(1)参加反应的
 的质量
的质量
(2)生成的
 的体积(标准状况)
的体积(标准状况)
(3)反应中被氧化的
 的物质的量
的物质的量
(4)参加反应的浓盐酸的体积

您最近一年使用:0次



