名校
1 . A、B都是芳香族化合物,1molA水解得到1molB和1mol醋酸。A、B相对分子质量都不超过200,完全燃烧都只生成CO2和H2O,且B分子中碳和氢元素总的质量百分含量为65.2%(即质量分数为0.652)。A溶液具有酸性,不能使FeCl3溶液显色。
(1)A、B相对分子质量之差为___________ 。
(2)1个B分子中应该有___________ 个氧原子。
(3)A的分子式是___________ 。
(4) B可能有的三种结构简式是___________ 、___________ 、___________ 。
(1)A、B相对分子质量之差为
(2)1个B分子中应该有
(3)A的分子式是
(4) B可能有的三种结构简式是
您最近一年使用:0次
2021-06-18更新
|
517次组卷
|
2卷引用:河北省邯郸市大名县第一中学2021-2022学年高二下学期第一次月考化学试题
解题方法
2 . I.科学研究小组的同学为测定某Na2CO3和NaHCO3混合物中Na2CO3的质量分数,进行了下列相关实验。其实验流程如下:
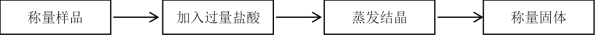
(1)该实验需要用到1.50 mol/L的稀盐酸500 mL,但实验室只有12.0 mol/L的浓盐酸。则配制稀盐酸所用浓盐酸_______ mL。
(2)若实验中测得样品质量为46.4 g,固体质量为40.95 g,请列式计算碳酸钠的质量分数_______ (保留3位有效数字)。
II.为测定某氯化亚铜样品中CuCl的含量,某同学设计如下实验:准确称取氯化亚铜样品m g,将其置于过量的FeCl3溶液中,待固体完全溶解后,加入适量稀硫酸,用a mol/L的K2Cr2O7溶液氧化反应生成的Fe2+,消耗K2Cr2O7溶液b mL,反应中 被还原为Cr3+。请列式计算样品中CuCl的质量分数
被还原为Cr3+。请列式计算样品中CuCl的质量分数_______ 。
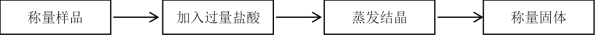
(1)该实验需要用到1.50 mol/L的稀盐酸500 mL,但实验室只有12.0 mol/L的浓盐酸。则配制稀盐酸所用浓盐酸
(2)若实验中测得样品质量为46.4 g,固体质量为40.95 g,请列式计算碳酸钠的质量分数
II.为测定某氯化亚铜样品中CuCl的含量,某同学设计如下实验:准确称取氯化亚铜样品m g,将其置于过量的FeCl3溶液中,待固体完全溶解后,加入适量稀硫酸,用a mol/L的K2Cr2O7溶液氧化反应生成的Fe2+,消耗K2Cr2O7溶液b mL,反应中
 被还原为Cr3+。请列式计算样品中CuCl的质量分数
被还原为Cr3+。请列式计算样品中CuCl的质量分数
您最近一年使用:0次
2021-01-27更新
|
261次组卷
|
2卷引用:河北省衡水市第十四中学2020-2021学年高一下学期一调考试化学试题
名校
3 . 铝是现今人类生产生活中使用广泛性仅次于铁的重要金属。工业上常以“钒土矿”为原料来冶炼金属铝。已知:钒土的主要成分是Al2O3(其中含有Fe2O3、SiO2等杂质)。为了检测某“钒土矿”样中Al2O3的含量,进行了如下实验过程:
①取矿样10.0 g加入过量稀盐酸溶解(假定其他未知成分的杂质都不溶于盐酸,也不和盐酸反应),过滤弃去不溶残渣。
②将滤液稀释并在250 mL容量瓶中定容后,取25.0 mL逐滴滴加2.0 mol·L-1的NaOH溶液,得到如图所示的变化关系。请根据有关数据回答下列问题:
(1)写出滴加NaOH溶液24~30 mL时发生反应的离子方程式:________________________ 。
(2)最后所得不溶于NaOH溶液的沉淀的化学式为________ ,其物质的量为______________ 。
(3)该“钒土矿”样中Al2O3的质量分数为________ 。
(4)工业上制取金属铝的化学反应原理可表示为:2Al2O3(熔融) 4Al+3O2↑
4Al+3O2↑
用10.0 t “钒土矿”样提纯所得的Al2O3(提纯过程的损耗忽略不计)进行电解,理论上最多可制得金属铝________ t,假定Al2O3在熔融状态完全电离为Al3+和O2-,则电解过程的阳极反应式为________________________ 。
①取矿样10.0 g加入过量稀盐酸溶解(假定其他未知成分的杂质都不溶于盐酸,也不和盐酸反应),过滤弃去不溶残渣。
②将滤液稀释并在250 mL容量瓶中定容后,取25.0 mL逐滴滴加2.0 mol·L-1的NaOH溶液,得到如图所示的变化关系。请根据有关数据回答下列问题:
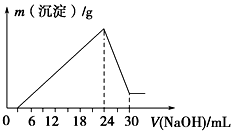
(1)写出滴加NaOH溶液24~30 mL时发生反应的离子方程式:
(2)最后所得不溶于NaOH溶液的沉淀的化学式为
(3)该“钒土矿”样中Al2O3的质量分数为
(4)工业上制取金属铝的化学反应原理可表示为:2Al2O3(熔融)
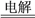 4Al+3O2↑
4Al+3O2↑用10.0 t “钒土矿”样提纯所得的Al2O3(提纯过程的损耗忽略不计)进行电解,理论上最多可制得金属铝
您最近一年使用:0次
4 . 硝酸与合成氨工业密切相关,氨氧化法是工业生产中制取硝酸的主要途径。
完成下列计算:
(1)合成氨时,假设100L的氮气与氢气(体积比为1 : 3)的混合气体通过氨合成塔充分反应后,体积变为90L,则氮气的转化率为____________ 。(写出计算过程,计算结果请用百分数表示)
(2)标准状况下,将500L氨气溶于1L水中形成氨水,则此氨水质量分数为____________ 。(写出计算过程,计算结果请用百分数表示,并保留1位小数)
(3)氨氧化法是将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮(NO)。此时温度很高,水以水蒸气的形式存在,NO也不与O2反应。若氨气与氧气物质的量之比为1:1.7 时,氨的转化率可达95%,计算反应后NO的体积分数____________ 。(设氧气在空气中的体积分数为20%,写出计算过程,计算结果请用百分数表示并保留1位小数)
(4)一氧化氮继续氧化为二氧化氮,二氧化氮溶于水可得硝酸。为测定某18K金样品的组成,将2.832 g样品粉碎后投入足量的浓硝酸中,充分溶解后,收集到NO2和N2O4的混合气体224 mL(折算至标准状况,下同),将该混合气体与84 mL O2混合后缓缓通入水中,恰好被完全吸收。( 已知金不溶于浓硝酸)
填写该18K金的成分表(写出计算过程,计算结果请用百分数表示并保留1位小数,若不含该金属则填0)。
完成下列计算:
(1)合成氨时,假设100L的氮气与氢气(体积比为1 : 3)的混合气体通过氨合成塔充分反应后,体积变为90L,则氮气的转化率为
(2)标准状况下,将500L氨气溶于1L水中形成氨水,则此氨水质量分数为
(3)氨氧化法是将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮(NO)。此时温度很高,水以水蒸气的形式存在,NO也不与O2反应。若氨气与氧气物质的量之比为1:1.7 时,氨的转化率可达95%,计算反应后NO的体积分数
(4)一氧化氮继续氧化为二氧化氮,二氧化氮溶于水可得硝酸。为测定某18K金样品的组成,将2.832 g样品粉碎后投入足量的浓硝酸中,充分溶解后,收集到NO2和N2O4的混合气体224 mL(折算至标准状况,下同),将该混合气体与84 mL O2混合后缓缓通入水中,恰好被完全吸收。( 已知金不溶于浓硝酸)
填写该18K金的成分表(写出计算过程,计算结果请用百分数表示并保留1位小数,若不含该金属则填0)。
| 18K金成分 | Au | Ag | Cu |
| 含量(质量分数) | 75 % |
您最近一年使用:0次
2016-01-14更新
|
377次组卷
|
2卷引用:2015-2016学年河北省定州中学高二6月月考化学试卷
5 . 某工厂使用的煤中硫的质量分数为3.2%,假设该工厂每天燃烧煤10t,试计算:
(1)若煤中硫全部转化为 ,该厂每天产生的
,该厂每天产生的 在标况下的体积为
在标况下的体积为___ 。
(2)若用1.5mol/L、 的NaOH溶液来吸收每天产生的
的NaOH溶液来吸收每天产生的 ,则所得溶液中溶质的成分(填化学式)和物质的量为
,则所得溶液中溶质的成分(填化学式)和物质的量为____ 。
(3)若把每年(按365天计)产生的 全部用来生产硫酸,理论上可得98%的浓硫酸的质量为
全部用来生产硫酸,理论上可得98%的浓硫酸的质量为___ t。
(1)若煤中硫全部转化为
 ,该厂每天产生的
,该厂每天产生的 在标况下的体积为
在标况下的体积为(2)若用1.5mol/L、
 的NaOH溶液来吸收每天产生的
的NaOH溶液来吸收每天产生的 ,则所得溶液中溶质的成分(填化学式)和物质的量为
,则所得溶液中溶质的成分(填化学式)和物质的量为(3)若把每年(按365天计)产生的
 全部用来生产硫酸,理论上可得98%的浓硫酸的质量为
全部用来生产硫酸,理论上可得98%的浓硫酸的质量为
您最近一年使用:0次
名校
6 . 回答下列问题
(1)在标准状况下,CO和CO2混合气体的质量为36g,体积为22.4L,则CO2和CO物质的量之比为______ 。
(2)神舟十三飞船以N2H4和N2O4为动力源,发生反应: N2H4+N2O4→N2+H2O,反应温度可高达2700 °C, 回
答下列问题。
①配平方程式____N2H4+ N2O4= N2+ H2O________ 。
②氧化产物与还原产物的质量之比为________ 。
(3)将10.9g Na2O和Na2O2的固体混合物溶于水得到500mL溶液,所得溶液用100mL1.5 mol/L稀硫酸恰好完全中和。
①固体混合物中Na2O2的质量分数为_____ (保留三位有效数字)。
②固体混合物与水反应后,所得NaOH溶液的物质的量浓度______ mol/L。
③若用质量分数为98%,密度为1.84 g/mL的浓硫酸配制题中所用的稀硫酸,则需量取浓硫酸的体积为____ (保留两位有效数字)。
(1)在标准状况下,CO和CO2混合气体的质量为36g,体积为22.4L,则CO2和CO物质的量之比为
(2)神舟十三飞船以N2H4和N2O4为动力源,发生反应: N2H4+N2O4→N2+H2O,反应温度可高达2700 °C, 回
答下列问题。
①配平方程式____N2H4+ N2O4= N2+ H2O
②氧化产物与还原产物的质量之比为
(3)将10.9g Na2O和Na2O2的固体混合物溶于水得到500mL溶液,所得溶液用100mL1.5 mol/L稀硫酸恰好完全中和。
①固体混合物中Na2O2的质量分数为
②固体混合物与水反应后,所得NaOH溶液的物质的量浓度
③若用质量分数为98%,密度为1.84 g/mL的浓硫酸配制题中所用的稀硫酸,则需量取浓硫酸的体积为
您最近一年使用:0次
名校
7 . 回答问题:
(1)在标准状况下①
 ②
②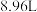
 ③
③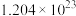 个
个 分子④
分子④
 ,所占的体积由大到小的顺序是(填序号,下同)
,所占的体积由大到小的顺序是(填序号,下同)_______ ;所含氢原子数由多到少的顺序是_______ ;密度由大到小的顺序是_______ ;质量由大到小的顺序是_______ 。
(2)标准状况下,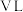 的某气体(摩尔质量为
的某气体(摩尔质量为
 )溶解在
)溶解在 水(水的密度近似为
水(水的密度近似为 )中,假设气体完全溶解且不与水发生反应,溶液的密度为
)中,假设气体完全溶解且不与水发生反应,溶液的密度为 ,则所得溶液的物质的量浓度
,则所得溶液的物质的量浓度
_______ ;质量分数
_______  。(选择以上字母表达计算式,要求化简)。
。(选择以上字母表达计算式,要求化简)。
(1)在标准状况下①

 ②
②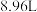
 ③
③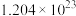 个
个 分子④
分子④
 ,所占的体积由大到小的顺序是(填序号,下同)
,所占的体积由大到小的顺序是(填序号,下同)(2)标准状况下,
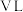 的某气体(摩尔质量为
的某气体(摩尔质量为
 )溶解在
)溶解在 水(水的密度近似为
水(水的密度近似为 )中,假设气体完全溶解且不与水发生反应,溶液的密度为
)中,假设气体完全溶解且不与水发生反应,溶液的密度为 ,则所得溶液的物质的量浓度
,则所得溶液的物质的量浓度

 。(选择以上字母表达计算式,要求化简)。
。(选择以上字母表达计算式,要求化简)。
您最近一年使用:0次
名校
8 . 某含苯环的烃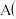 不含其他环状结构
不含其他环状结构 ,其蒸汽的相对密度是氢气的52倍,碳元素的质量分数为
,其蒸汽的相对密度是氢气的52倍,碳元素的质量分数为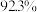 。
。
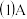 的分子式为
的分子式为______ 。
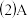 与溴的四氯化碳溶液反应的化学方程式为
与溴的四氯化碳溶液反应的化学方程式为______ 。
 已知:
已知:

 ,请写出A在冷的
,请写出A在冷的 稀碱性溶液中反应所得产物的结构简式:
稀碱性溶液中反应所得产物的结构简式:______ 。
 一定条件下,A与氢气反应,得到的化合物中碳元素的质量分数为
一定条件下,A与氢气反应,得到的化合物中碳元素的质量分数为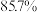 ,写出此化合物的结构简式:
,写出此化合物的结构简式:______ 。
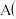 不含其他环状结构
不含其他环状结构 ,其蒸汽的相对密度是氢气的52倍,碳元素的质量分数为
,其蒸汽的相对密度是氢气的52倍,碳元素的质量分数为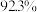 。
。 的分子式为
的分子式为 与溴的四氯化碳溶液反应的化学方程式为
与溴的四氯化碳溶液反应的化学方程式为 已知:
已知:

 ,请写出A在冷的
,请写出A在冷的 稀碱性溶液中反应所得产物的结构简式:
稀碱性溶液中反应所得产物的结构简式: 一定条件下,A与氢气反应,得到的化合物中碳元素的质量分数为
一定条件下,A与氢气反应,得到的化合物中碳元素的质量分数为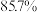 ,写出此化合物的结构简式:
,写出此化合物的结构简式:
您最近一年使用:0次
2021-05-20更新
|
617次组卷
|
3卷引用:河北省张家口市宣化第一中学2020-2021学年高二下学期期中考试化学试题
河北省张家口市宣化第一中学2020-2021学年高二下学期期中考试化学试题(已下线)专题二 烃的组成、结构、性质与转化-2020-2021学年高二《新题速递·化学》(人教版2019选择性必修3)6月刊 (期末复习必刷题)期末学业水平检测(二)-苏教版2020选择性必修3
名校
9 . 加热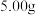 碳酸钠和碳酸氢钠的混合物,至质量不再发生变化,混合物质量减少了
碳酸钠和碳酸氢钠的混合物,至质量不再发生变化,混合物质量减少了 。
。
(1)写出上述过程发生的化学方程式_____ 。
(2)求原混合物中碳酸氢钠的质量分数_____ 。
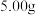 碳酸钠和碳酸氢钠的混合物,至质量不再发生变化,混合物质量减少了
碳酸钠和碳酸氢钠的混合物,至质量不再发生变化,混合物质量减少了 。
。(1)写出上述过程发生的化学方程式
(2)求原混合物中碳酸氢钠的质量分数
您最近一年使用:0次
10 . 回答下列问题:
(1)在无土栽培中,需配制500mL含有NH 、K+、Cl-、SO
、K+、Cl-、SO 的植物培养液。且要求该培养液中c(Cl-)=c(K+)=c(SO
的植物培养液。且要求该培养液中c(Cl-)=c(K+)=c(SO )=0.4mol•L-1。该培养液中,c(NH
)=0.4mol•L-1。该培养液中,c(NH )=
)=___ mol•L-1。若用K2SO4、NH4Cl、(NH4)2SO4配制培养液,则需____ g(NH4)2SO4。
(2)已知质量分数为98%的浓硫酸,其物质的量浓度为18.4mol•L-1,则该浓硫酸的密度___ g•cm-3。若某硫酸的质量分数为49%,则其物质的量浓度___ (填“大于”“小于”或“等于”,下同)9.2mol•L-1;若某硫酸的物质的量浓度为9.2mol•L-1,则其质量分数___ 49%。
(3)由CO2、H2和CO组成的混合气体在同温同压下与氮气的密度相同,则该混合气体中CO2和H2的体积比为___ 。
(4)在一定温度和压强下,3.6g石墨和6.4g氧气充分反应至固体无剩余,所得产物为___ 。若将该产物用200mL2mol•L-1NaOH溶液充分吸收,则所得溶液中c(CO )=
)=___ mol•L-1 (不考虑溶液体积的变化)。
(1)在无土栽培中,需配制500mL含有NH
 、K+、Cl-、SO
、K+、Cl-、SO 的植物培养液。且要求该培养液中c(Cl-)=c(K+)=c(SO
的植物培养液。且要求该培养液中c(Cl-)=c(K+)=c(SO )=0.4mol•L-1。该培养液中,c(NH
)=0.4mol•L-1。该培养液中,c(NH )=
)=(2)已知质量分数为98%的浓硫酸,其物质的量浓度为18.4mol•L-1,则该浓硫酸的密度
(3)由CO2、H2和CO组成的混合气体在同温同压下与氮气的密度相同,则该混合气体中CO2和H2的体积比为
(4)在一定温度和压强下,3.6g石墨和6.4g氧气充分反应至固体无剩余,所得产物为
 )=
)=
您最近一年使用:0次



