名校
1 . 质量、物质的量、物质的量浓度、气体体积等是用于化学计算的常见物理量。
(1)质量之比为16:7:6的三种气体 、
、 、
、 。分子个数之比为
。分子个数之比为___________ ;氧原子个数之比为___________ ;相同条件下的体积之比为___________ 。
(2)在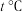 时将ag
时将ag ,完全溶于水得到VmL溶液,该溶液的密度为
,完全溶于水得到VmL溶液,该溶液的密度为 (
(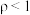 );质量分数为w,物质的量浓度为
);质量分数为w,物质的量浓度为 。下列计算结果正确的是___________。
。下列计算结果正确的是___________。
(3)将aL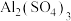 和
和 的混合溶液分成两等份,一份加入bmol
的混合溶液分成两等份,一份加入bmol 溶液使溶液中的
溶液使溶液中的 刚好完全沉淀,另一份加入足量
刚好完全沉淀,另一份加入足量 溶液并加热可得到cmol
溶液并加热可得到cmol ,则原溶液中
,则原溶液中 的物质的量浓度为
的物质的量浓度为___________ 。
(4)ag镁铝合金投入xmL2 mol∙L−1的盐酸中,一段时间后金属完全溶解,再加入ymL l mol∙L−1的 溶液,沉淀达到最大值,其质量为
溶液,沉淀达到最大值,其质量为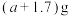 ,产生的
,产生的 在标准状况下体积为
在标准状况下体积为___________ L。
(5)汽车剧烈碰撞时,安全气囊中发生反应: 。该反应中氧化产物与还原产物的质量比为
。该反应中氧化产物与还原产物的质量比为___________ ;若氧化产物比还原产物多19.6g,则反应生成的 在标准状况下的体积为
在标准状况下的体积为___________ L。
(1)质量之比为16:7:6的三种气体
 、
、 、
、 。分子个数之比为
。分子个数之比为(2)在
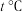 时将ag
时将ag ,完全溶于水得到VmL溶液,该溶液的密度为
,完全溶于水得到VmL溶液,该溶液的密度为 (
(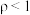 );质量分数为w,物质的量浓度为
);质量分数为w,物质的量浓度为 。下列计算结果正确的是___________。
。下列计算结果正确的是___________。A.溶质的质量分数 |
B.溶质的物质的量浓度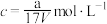 |
C.溶液密度 可表示为 可表示为 |
| D.上述溶液中再加入VmL水,所得溶液溶质的质量分数小于0.5w |
(3)将aL
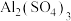 和
和 的混合溶液分成两等份,一份加入bmol
的混合溶液分成两等份,一份加入bmol 溶液使溶液中的
溶液使溶液中的 刚好完全沉淀,另一份加入足量
刚好完全沉淀,另一份加入足量 溶液并加热可得到cmol
溶液并加热可得到cmol ,则原溶液中
,则原溶液中 的物质的量浓度为
的物质的量浓度为(4)ag镁铝合金投入xmL2 mol∙L−1的盐酸中,一段时间后金属完全溶解,再加入ymL l mol∙L−1的
 溶液,沉淀达到最大值,其质量为
溶液,沉淀达到最大值,其质量为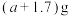 ,产生的
,产生的 在标准状况下体积为
在标准状况下体积为(5)汽车剧烈碰撞时,安全气囊中发生反应:
 。该反应中氧化产物与还原产物的质量比为
。该反应中氧化产物与还原产物的质量比为 在标准状况下的体积为
在标准状况下的体积为
您最近一年使用:0次
名校
解题方法
2 . (1)将 加入到100mL一定浓度的硝酸溶液中,两者恰好完全反应,同时产生标准状况下
加入到100mL一定浓度的硝酸溶液中,两者恰好完全反应,同时产生标准状况下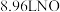 和
和 的混合气体。
的混合气体。
①写出NO生成时的离子反应方程式___________ 。
②混合气体中NO和 的体积比为
的体积比为___________ 。
③原硝酸溶液的物质的量浓度为___________ 。
(2)1.52g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0mol/LNaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀。
①该浓硝酸中HNO3的物质的量浓度为___________ 。
②该合金中铜的质量为___________ 。
③NO2和N2O4的混合气体中,N2O4的体积分数为___________ 。
④得到2.54g沉淀时,加入NaOH溶液的体积为___________ 。
 加入到100mL一定浓度的硝酸溶液中,两者恰好完全反应,同时产生标准状况下
加入到100mL一定浓度的硝酸溶液中,两者恰好完全反应,同时产生标准状况下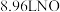 和
和 的混合气体。
的混合气体。①写出NO生成时的离子反应方程式
②混合气体中NO和
 的体积比为
的体积比为③原硝酸溶液的物质的量浓度为
(2)1.52g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0mol/LNaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀。
①该浓硝酸中HNO3的物质的量浓度为
②该合金中铜的质量为
③NO2和N2O4的混合气体中,N2O4的体积分数为
④得到2.54g沉淀时,加入NaOH溶液的体积为
您最近一年使用:0次
名校
解题方法
3 . 我国利用黄铁矿(主要成分是FeS2)为原料制取浓硫酸,其过程是:
第一步煅烧:4FeS2+11O2==2Fe2O3+8SO2;
第二步催化氧化:2SO2+O2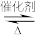 2SO3;
2SO3;
第三步吸收:SO3+H2O=H2SO4
某工厂化验室为测定某黄铁矿的纯度,取1.00g矿石样品(所含杂质不挥发且不与氧气反应),在氧气流中充分灼烧完全反应后,冷却,称量固体残留物,质量为0.75g。
(1)该黄铁矿中FeS2的质量分数为多少?___________
(2)该工厂用这种黄铁矿制硫酸,在FeS2燃烧过程中损失2%,由SO2氧化成:SO3时,SO2的利用率为80%,吸收塔中:SO3完全吸收。若煅烧10.0t上述黄铁矿,则可制得98%的硫酸多少吨?___________
第一步煅烧:4FeS2+11O2==2Fe2O3+8SO2;
第二步催化氧化:2SO2+O2
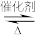 2SO3;
2SO3;第三步吸收:SO3+H2O=H2SO4
某工厂化验室为测定某黄铁矿的纯度,取1.00g矿石样品(所含杂质不挥发且不与氧气反应),在氧气流中充分灼烧完全反应后,冷却,称量固体残留物,质量为0.75g。
(1)该黄铁矿中FeS2的质量分数为多少?
(2)该工厂用这种黄铁矿制硫酸,在FeS2燃烧过程中损失2%,由SO2氧化成:SO3时,SO2的利用率为80%,吸收塔中:SO3完全吸收。若煅烧10.0t上述黄铁矿,则可制得98%的硫酸多少吨?
您最近一年使用:0次
解题方法
4 . 工业以黄铁矿为原料生产硫酸,吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐。为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00mL相同浓度的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。部分测定结果如下表:
计算:该铵盐中氮元素的质量分数_______ (计算结果保留两位小数)
| 铵盐的质量(g) | 10.00 | 20.00 | 30.00 | 50.00 |
| 浓硫酸增加的质量(g) | m | m | 1.29 | 0 |
计算:该铵盐中氮元素的质量分数
您最近一年使用:0次
5 . 根据题意完成下列空格。
(1)标准状况下,2.24L Cl2的质量为_________ g。
(2)10.8g R2O5中氧原子的数目为3.01×1023 ,则元素R的相对原子质量为___
(3)阻燃剂碱式碳酸铝镁中OH﹣与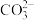 质量之比为51:300,则这两种离子的物质的量之比为
质量之比为51:300,则这两种离子的物质的量之比为_______ 。
(4)将10mL1.00mol/L Na2CO3溶液与10mL1.00mol/L CaCl2溶液相混和,则混和溶液中Na+的物质的量浓度为________ mol/L(忽略混合前后溶液体积的变化)。
(5)3.5mol Ba(OH)2中含有_____ molOH-。
(6)100g质量分数为46%的酒精(CH3CH2OH)溶液中氧原子的物质的量为_______ mol。
(1)标准状况下,2.24L Cl2的质量为
(2)10.8g R2O5中氧原子的数目为3.01×1023 ,则元素R的相对原子质量为
(3)阻燃剂碱式碳酸铝镁中OH﹣与
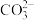 质量之比为51:300,则这两种离子的物质的量之比为
质量之比为51:300,则这两种离子的物质的量之比为(4)将10mL1.00mol/L Na2CO3溶液与10mL1.00mol/L CaCl2溶液相混和,则混和溶液中Na+的物质的量浓度为
(5)3.5mol Ba(OH)2中含有
(6)100g质量分数为46%的酒精(CH3CH2OH)溶液中氧原子的物质的量为
您最近一年使用:0次
解题方法
6 . 将某碳酸钠和碳酸氢钠混合物 2.74 g加热到质量不再变化时,剩余物质的质量为2.12 g,求混合物中碳酸钠的质量分数。(写出简要的计算过程)
(1)碳酸氢钠的质量为___________ 克?
(2)碳酸钠的质量分数为___________ ?
(1)碳酸氢钠的质量为
(2)碳酸钠的质量分数为
您最近一年使用:0次
名校
7 . (1)欲将0.10 mol.L-1的NaOH溶液和0.60 mol.L-1的NaOH溶液混合成0.20 mol.L-1的NaOH溶液(忽略混合时溶液体积变化),则两种溶液的体积比为___________ 。
(2)某温度下,40g质量分数为10%硝酸钠溶液与60g质量分数为7.5%的硝酸钠溶液混合,得到密度为1.20 g.cm-3的混合溶液,则该混合溶液中NaNO3的物质的量浓度为______ 。
(3)现有硫酸钠和碳酸钠混合溶液10.0 mL,加入足量氯化钡溶液,充分反应后,经过滤、洗涤和干燥,得到白色沉淀1.451 g。将沉淀与过量盐酸反应,得到112 mL二氧化碳气体(在标准状况下)。则原混合溶液中硫酸钠和碳酸钠的物质的量浓度分别是_____ 、____ 。
(2)某温度下,40g质量分数为10%硝酸钠溶液与60g质量分数为7.5%的硝酸钠溶液混合,得到密度为1.20 g.cm-3的混合溶液,则该混合溶液中NaNO3的物质的量浓度为
(3)现有硫酸钠和碳酸钠混合溶液10.0 mL,加入足量氯化钡溶液,充分反应后,经过滤、洗涤和干燥,得到白色沉淀1.451 g。将沉淀与过量盐酸反应,得到112 mL二氧化碳气体(在标准状况下)。则原混合溶液中硫酸钠和碳酸钠的物质的量浓度分别是
您最近一年使用:0次
名校
解题方法
8 . 在标准状况下,由一氧化碳和二氧化碳组成的混合气体为6.72 L,质量为12g,此混合物中一氧化碳和二氧化碳物质的量之比是__________ ,一氧化碳的体积分数是__________ ,一氧化碳的质量分数是__________ ,碳原子和氧原子个数比是__________ ,混合气体的平均相对分子质量是__________ ,密度是__________ g·L-1。
您最近一年使用:0次
2020-01-30更新
|
239次组卷
|
3卷引用:湖北省荆州市沙市区沙市中学2019-2020学年高一化学过关训练9《化学计量在实验中的应用》
解题方法
9 . 恒温恒容下,将2molA气体和2molB气体通入体积为2L的密闭容器中发生如下反应:2A(g)+B(g) xC(g)+2D(s),2min时反应达到平衡状态,此时剩余1.2molB,并测得C的浓度为1.2mol·L-1。
xC(g)+2D(s),2min时反应达到平衡状态,此时剩余1.2molB,并测得C的浓度为1.2mol·L-1。
(1)从开始反应至达到平衡状态,生成C的平均反应速率为___ 。
(2)x=__ 。
(3)下列各项可作为该反应达到平衡状态的标志的是__ 。
A.压强不再变化
B.气体密度不再变化
C.A的消耗速率与B的消耗速率之比为2∶1
D.A的百分含量保持不变
 xC(g)+2D(s),2min时反应达到平衡状态,此时剩余1.2molB,并测得C的浓度为1.2mol·L-1。
xC(g)+2D(s),2min时反应达到平衡状态,此时剩余1.2molB,并测得C的浓度为1.2mol·L-1。(1)从开始反应至达到平衡状态,生成C的平均反应速率为
(2)x=
(3)下列各项可作为该反应达到平衡状态的标志的是
A.压强不再变化
B.气体密度不再变化
C.A的消耗速率与B的消耗速率之比为2∶1
D.A的百分含量保持不变
您最近一年使用:0次
2021-04-20更新
|
1145次组卷
|
3卷引用:湖北i省华中师范大学潜江附属中学2020-2021学年高二上学期入学考试化学试题
湖北i省华中师范大学潜江附属中学2020-2021学年高二上学期入学考试化学试题河南省济源市第五中学2020-2021学年高二下学期6月月考化学试题(已下线)2.2.1 化学平衡状态(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)
10 . 将一定量的二氧化硫和含0.7mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应2SO2+O2 2SO3。反应达到平衡后,将容器中的混合气体通过过量氢氧化钠溶液,气体体积减小了21.28L;再将剩余气体通过一种碱性溶液吸收氧气,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留三位有效数字)请回答下列问题:
2SO3。反应达到平衡后,将容器中的混合气体通过过量氢氧化钠溶液,气体体积减小了21.28L;再将剩余气体通过一种碱性溶液吸收氧气,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留三位有效数字)请回答下列问题:
(1)判断该反应达到平衡状态的标志是______ (填字母)。
a.二氧化硫和三氧化硫浓度相等
b.三氧化硫百分含量保持不变
c.容器中气体的压强不变
d.三氧化硫的生成速率与二氧化硫的消耗速率相等
e.容器中混合气体的密度保持不变
(2)该反应达到平衡时,消耗二氧化硫的物质的量占原二氧化硫的物质的量的百分比为_______ 。
(3)若将平衡混合气体的5%通入过量的氯化钡溶液中,生成沉淀的质量是_______ 。
 2SO3。反应达到平衡后,将容器中的混合气体通过过量氢氧化钠溶液,气体体积减小了21.28L;再将剩余气体通过一种碱性溶液吸收氧气,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留三位有效数字)请回答下列问题:
2SO3。反应达到平衡后,将容器中的混合气体通过过量氢氧化钠溶液,气体体积减小了21.28L;再将剩余气体通过一种碱性溶液吸收氧气,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留三位有效数字)请回答下列问题:(1)判断该反应达到平衡状态的标志是
a.二氧化硫和三氧化硫浓度相等
b.三氧化硫百分含量保持不变
c.容器中气体的压强不变
d.三氧化硫的生成速率与二氧化硫的消耗速率相等
e.容器中混合气体的密度保持不变
(2)该反应达到平衡时,消耗二氧化硫的物质的量占原二氧化硫的物质的量的百分比为
(3)若将平衡混合气体的5%通入过量的氯化钡溶液中,生成沉淀的质量是
您最近一年使用:0次
2021-03-03更新
|
488次组卷
|
10卷引用:湖北省武汉市外国语学校2019-2020学年高一下学期期中考试化学试题
湖北省武汉市外国语学校2019-2020学年高一下学期期中考试化学试题【全国百强校】黑龙江省大庆实验中学2017-2018学年高一下学期期末考试化学试题人教版高中化学必修2第二章《化学反应与能量》测试卷3人教版高中化学必修二第二单元《化学反应与能量》测试卷2019-2020人教版高中化学必修2第二章《化学反应与能量》测试卷人教版本必修二高中化学第二章《化学反应与能量》测试卷苏教版高中化学必修2专题二《化学反应与能量转化》测试卷2019-2020学年鲁科版高中化学必修2第二章《化学键 化学反应与能量》测试卷(已下线)第五章 化工生产中的重要非金属元素(培优提升卷)-2020-2021学年高一化学必修第二册章末集训必刷卷(新教材人教版)河北省张家口市宣化第一中学2020-2021学年高一下学期期中考试化学试题



