名校
解题方法
1 . 计算:
(1)agNa2S中含b个Na+,则阿伏加德罗常数为__ (用含a、b的代数式表示)
(2)OH-与H2O数目之比为1:20的KOH水溶液中,溶质(KOH)的质量分数是__ %(结果保留一位小数)
(3)病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如图所示。利用标签所提供的信息,回答下列问题:
①葡萄糖的摩尔质量为___ ;
②该注射液中葡萄糖的物质的量浓度为___ 。(保留两位小数)
③检测人的血液中葡萄糖(简称血糖)的含量,参考指标常以两种计量单位表示,即“mmol/L”和“mg/dL”(1L=10dL;1mol=1000mmol)。以“mmol/L”表示时,人的血糖正常值在3.6~6.1mmol/L之间。如果以“mg/dL”表示,血糖正常值范围是___ 。(结果保留1位小数)
(1)agNa2S中含b个Na+,则阿伏加德罗常数为
(2)OH-与H2O数目之比为1:20的KOH水溶液中,溶质(KOH)的质量分数是
(3)病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如图所示。利用标签所提供的信息,回答下列问题:
| 5%葡萄糖注射液 1000mL [性状]本品为无色或几 乎无色的透明 晶体。味甜。 [规格] 1000mL, 50g。 [贮藏]密闭保存。 |
①葡萄糖的摩尔质量为
②该注射液中葡萄糖的物质的量浓度为
③检测人的血液中葡萄糖(简称血糖)的含量,参考指标常以两种计量单位表示,即“mmol/L”和“mg/dL”(1L=10dL;1mol=1000mmol)。以“mmol/L”表示时,人的血糖正常值在3.6~6.1mmol/L之间。如果以“mg/dL”表示,血糖正常值范围是
您最近一年使用:0次
名校
解题方法
2 . 三聚氰胺最早被李比希于1834年合成,它有毒,不可用于食品加工或食品添加剂。经李比希法分析得知,三聚氰胺分子中,氮元素的含量高达66.67%,氢元素的质量分数为4.76%,其余为碳元素。它的相对分子质量大于100,但小于150。试回答下列问题:
(1)分子式中原子个数比N(C)∶N(H)∶N(N)=_____________ 。
(2)三聚氰胺分子中碳原子数为_____________ ,理由是(写出计算式)_____________ 。
(3)三聚氰胺的分子式为_____________ 。
(4)若核磁共振氢谱显示只有1个吸收峰,红外光谱表征有1个由碳氮两种元素组成的六元杂环。则三聚氰胺的结构简式为______ 。
(1)分子式中原子个数比N(C)∶N(H)∶N(N)=
(2)三聚氰胺分子中碳原子数为
(3)三聚氰胺的分子式为
(4)若核磁共振氢谱显示只有1个吸收峰,红外光谱表征有1个由碳氮两种元素组成的六元杂环。则三聚氰胺的结构简式为
您最近一年使用:0次
2020-07-30更新
|
546次组卷
|
4卷引用:江西省南昌市外国语学校2021-2022学年高二下学期第一次月考化学(理科)试题
3 . 无机非金属材料、金属材料和有机高分子材料并称为三大材料,是发展高新技术的基石,在未来科技发展中发挥着重要的作用。
(1)Nierite是一种高熔点高硬度的陶瓷材料。Nierite的摩尔质量为140 g/mol,其中硅元素的质量分数为60%。已知1 mol NH3与足量的SiCl4充分反应后可得到35 g Nierite与3 mol HCl气体。Nierite的化学式为___________ 。
(2)K金是常见的贵金属材料,除黄金外,还含有银、铜中的一种或两种金属。为测定某18K金样品的组成,将2.832 g样品粉碎后投入足量的浓硝酸中,固体全部溶解后,收集到NO2和N2O4的混合气体224 mL(折算至标准状况,下同),将该混合气体与84 mL O2混合后缓缓通入水中,恰好被完全吸收。
填写该18K金的成分表(精确至0.01%,若不含该金属则填0)。
(1)Nierite是一种高熔点高硬度的陶瓷材料。Nierite的摩尔质量为140 g/mol,其中硅元素的质量分数为60%。已知1 mol NH3与足量的SiCl4充分反应后可得到35 g Nierite与3 mol HCl气体。Nierite的化学式为
(2)K金是常见的贵金属材料,除黄金外,还含有银、铜中的一种或两种金属。为测定某18K金样品的组成,将2.832 g样品粉碎后投入足量的浓硝酸中,固体全部溶解后,收集到NO2和N2O4的混合气体224 mL(折算至标准状况,下同),将该混合气体与84 mL O2混合后缓缓通入水中,恰好被完全吸收。
填写该18K金的成分表(精确至0.01%,若不含该金属则填0)。
| 18K金成分 | Au | Ag |
| 含量(质量分数) | 75.00% |
您最近一年使用:0次
2019-12-15更新
|
497次组卷
|
2卷引用:江西省山江湖协作体2019-2020学年高一上学期第三次月考(自招班)化学试题
名校
4 . 计算题
(1)某地产石灰石所含杂质不溶于水也不与盐酸反应。为测定该石灰石中碳酸钙的含量,现进行下列实验:称取25g石灰石放在质量为145g的烧杯中,向其中加入100g稀盐酸,反应恰好完全,此时称量烧杯及其中溶液,总质量为261.2g,求:
①石灰石中碳酸钙的质量为__________ 克。
②反应后溶液中溶质的质量分数为__________ (保留两位有效数字)。
(2)某厂的某钢样粉末28.36 g(假设只含Fe和C),在氧气流中充分反应,将产生的气体通入足量的澄清石灰水中,得到3 g白色沉淀。
①计算可得此钢样粉末中铁和碳的质量之比为__________ 。
②再取三份不同质量的钢样粉末分别加到50g质量分数相同的硫酸中,充分反应后,测得的实验数据如下表所示:(标准状况下,2克 H2的体积为22.4L)
根据表中的数据计算,硫酸溶液中H2SO4溶质的质量分数是__________
(1)某地产石灰石所含杂质不溶于水也不与盐酸反应。为测定该石灰石中碳酸钙的含量,现进行下列实验:称取25g石灰石放在质量为145g的烧杯中,向其中加入100g稀盐酸,反应恰好完全,此时称量烧杯及其中溶液,总质量为261.2g,求:
①石灰石中碳酸钙的质量为
②反应后溶液中溶质的质量分数为
(2)某厂的某钢样粉末28.36 g(假设只含Fe和C),在氧气流中充分反应,将产生的气体通入足量的澄清石灰水中,得到3 g白色沉淀。
①计算可得此钢样粉末中铁和碳的质量之比为
②再取三份不同质量的钢样粉末分别加到50g质量分数相同的硫酸中,充分反应后,测得的实验数据如下表所示:(标准状况下,2克 H2的体积为22.4L)
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 加入钢样粉末的质量 / g | 2.836 | 5.672 | 8.508 |
| 生成气体的体积(标准状况)/ L | 1.12 | 2.24 | 2.80 |
根据表中的数据计算,硫酸溶液中H2SO4溶质的质量分数是
您最近一年使用:0次
名校
5 . 无机非金属材料、金属材料和有机高分子材料并称为三大材料,是发展高新技术的基石,在未来科技发展中发挥着重要的作用。
(1)新型材料Fe粉具有超强的磁性能,用作高密度磁记录的介质以及高效催化剂等。将22.4 g Fe粉与一定量水蒸气在高温下反应一定时间后冷却,其质量变为28.8 g。
①产生的氢气的体积为_________ mL(标准状况下)。
②将冷却后的固体物质放入足量FeCl3溶液中充分反应(已知Fe3O4不溶于FeCl3溶液),计算最多消耗FeCl3的物质的量__________ mol。
(2)Nierite是一种高熔点高硬度的陶瓷材料。Nierite的摩尔质量为140 g/mol,其中硅元素的质量分数为60%。已知1 mol NH3与足量的SiCl4充分反应后可得到35 g Nierite与3 mol HCl气体。
Nierite的化学式为___________ 。
(3)K金是常见的贵金属材料,除黄金外,还含有银、铜中的一种或两种金属。为测定某18K金样品的组成,将2.832 g样品粉碎后投入足量的浓硝酸中,固体全部溶解后,收集到NO2和N2O4的混合气体224 mL(折算至标准状况,下同),将该混合气体与84 mL O2混合后缓缓通入水中,恰好被完全吸收。填写该18K金的成分表(精确至0.01%,若不含该金属则填0)。
(1)新型材料Fe粉具有超强的磁性能,用作高密度磁记录的介质以及高效催化剂等。将22.4 g Fe粉与一定量水蒸气在高温下反应一定时间后冷却,其质量变为28.8 g。
①产生的氢气的体积为
②将冷却后的固体物质放入足量FeCl3溶液中充分反应(已知Fe3O4不溶于FeCl3溶液),计算最多消耗FeCl3的物质的量
(2)Nierite是一种高熔点高硬度的陶瓷材料。Nierite的摩尔质量为140 g/mol,其中硅元素的质量分数为60%。已知1 mol NH3与足量的SiCl4充分反应后可得到35 g Nierite与3 mol HCl气体。
Nierite的化学式为
(3)K金是常见的贵金属材料,除黄金外,还含有银、铜中的一种或两种金属。为测定某18K金样品的组成,将2.832 g样品粉碎后投入足量的浓硝酸中,固体全部溶解后,收集到NO2和N2O4的混合气体224 mL(折算至标准状况,下同),将该混合气体与84 mL O2混合后缓缓通入水中,恰好被完全吸收。填写该18K金的成分表(精确至0.01%,若不含该金属则填0)。
| 18K金成分 | Au | Ag |
| 含量(质量分数) | 75.00% |
您最近一年使用:0次
11-12高一上·江西宜春·阶段练习
6 . 下图是某厂生产的某种加钙食盐包装标签上的部分文字,请阅读后回答以下问题:

(1)为了检验此盐中是否含有碘酸钾,可用KI-淀粉溶液和稀盐酸作试剂进行检测。加入KI-淀粉溶液和稀盐酸后,若盐中含有碘酸钾,则会发生如下反应:KIO3+5KI+6HCl = 6KCl+3I2+3H2O,生成的I2遇淀粉变蓝。在上述反应中氧化剂与还原剂物质的量之比为______________ 。
(2)为了测定此盐的钙元素含量,取10克此盐溶于水,加入足量盐酸,生成标准状况下67.2ml二氧化碳气体。请计算此加钙食盐中钙元素的质量分数______ (取2位有效数字)。

(1)为了检验此盐中是否含有碘酸钾,可用KI-淀粉溶液和稀盐酸作试剂进行检测。加入KI-淀粉溶液和稀盐酸后,若盐中含有碘酸钾,则会发生如下反应:KIO3+5KI+6HCl = 6KCl+3I2+3H2O,生成的I2遇淀粉变蓝。在上述反应中氧化剂与还原剂物质的量之比为
(2)为了测定此盐的钙元素含量,取10克此盐溶于水,加入足量盐酸,生成标准状况下67.2ml二氧化碳气体。请计算此加钙食盐中钙元素的质量分数
您最近一年使用:0次
7 . 将一定量 通入
通入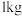 质量分数为
质量分数为 的
的 溶液中,制成含有
溶液中,制成含有 和
和 的混合溶液。用此溶液吸收标准状况下
的混合溶液。用此溶液吸收标准状况下 ,恰好形成中性溶液(假设气体均完全反应),请计算:
,恰好形成中性溶液(假设气体均完全反应),请计算:
(1) 溶液中
溶液中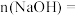
___________  。
。
(2)已知混合溶液中 ,则混合溶液中
,则混合溶液中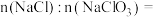
___________ 。
(3)所通 在标准状况下的体积为
在标准状况下的体积为___________ L。
 通入
通入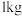 质量分数为
质量分数为 的
的 溶液中,制成含有
溶液中,制成含有 和
和 的混合溶液。用此溶液吸收标准状况下
的混合溶液。用此溶液吸收标准状况下 ,恰好形成中性溶液(假设气体均完全反应),请计算:
,恰好形成中性溶液(假设气体均完全反应),请计算:(1)
 溶液中
溶液中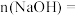
 。
。(2)已知混合溶液中
 ,则混合溶液中
,则混合溶液中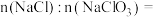
(3)所通
 在标准状况下的体积为
在标准状况下的体积为
您最近一年使用:0次
2022-05-04更新
|
907次组卷
|
4卷引用:江西省丰城市第九中学2022-2023学年高三上学期入学考化学试题
名校
8 . 完成以下填空。
(1)有下列物质:①石墨②硫酸③ ④
④ ⑤熔融
⑤熔融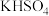 ⑥
⑥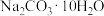 ⑦氨气⑧生石灰⑨食盐水⑩
⑦氨气⑧生石灰⑨食盐水⑩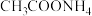 ,以上物质中属于电解质的是:
,以上物质中属于电解质的是:_______ ;属于非电解质的是:______ (均填序号)。
(2)标准状况下,和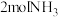 含有相同氢原子数的
含有相同氢原子数的 的体积为
的体积为_________ 。
(3)从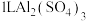 溶液中取出
溶液中取出 ,向其中加入
,向其中加入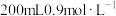 的
的 溶液恰好使
溶液恰好使 完全沉淀,则原溶液中
完全沉淀,则原溶液中 的物质的量浓度为
的物质的量浓度为___________  。
。
(4)用质量分数为 ,密度为
,密度为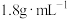 浓硫酸配制
浓硫酸配制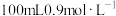 的稀硫酸,需用量筒量取浓硫酸的体积为
的稀硫酸,需用量筒量取浓硫酸的体积为___________  。
。
(1)有下列物质:①石墨②硫酸③
 ④
④ ⑤熔融
⑤熔融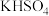 ⑥
⑥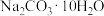 ⑦氨气⑧生石灰⑨食盐水⑩
⑦氨气⑧生石灰⑨食盐水⑩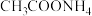 ,以上物质中属于电解质的是:
,以上物质中属于电解质的是:(2)标准状况下,和
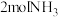 含有相同氢原子数的
含有相同氢原子数的 的体积为
的体积为(3)从
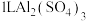 溶液中取出
溶液中取出 ,向其中加入
,向其中加入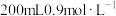 的
的 溶液恰好使
溶液恰好使 完全沉淀,则原溶液中
完全沉淀,则原溶液中 的物质的量浓度为
的物质的量浓度为 。
。(4)用质量分数为
 ,密度为
,密度为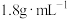 浓硫酸配制
浓硫酸配制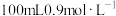 的稀硫酸,需用量筒量取浓硫酸的体积为
的稀硫酸,需用量筒量取浓硫酸的体积为 。
。
您最近一年使用:0次
9 . 利用相关知识填空。
(1)等质量的SO2和SO3的物质的量之比是_____ ,所含氧原子个数之比是_______ 。
(2)4.8gCH4中所含氢原子数与________ g水所含氢原子数相等。
(3)在定温度和压强下,0.4mol某气体的体积为9.8L,则该条件下的气体摩尔体积为______ 。若此时压强为101kPa,则温度________ 0℃(填“高于”“低于”或“等于”)。
(4)在一密闭容器中充入amolNO和bmolO2,可发生如下反应:2NO+O2=2NO2,充分反应后容器中氮原子和氧原子的个数之比为________ 。
(5)有一种由Na2S、Na2SO3、Na2SO4组成的混合物,经测定含硫的质量分数为25.6%,则混合物中含氧的质量分数为______ 。
(6)某同学为测定份NaHCO3和Na2CO3混合固体中NaHCO3的纯度,称取m1g混合物,加热至质量不变时,称其质量为m2g,则原混合物中NaHCO3的质量分数为______ (用含m1、m2的代数式表示)。
(1)等质量的SO2和SO3的物质的量之比是
(2)4.8gCH4中所含氢原子数与
(3)在定温度和压强下,0.4mol某气体的体积为9.8L,则该条件下的气体摩尔体积为
(4)在一密闭容器中充入amolNO和bmolO2,可发生如下反应:2NO+O2=2NO2,充分反应后容器中氮原子和氧原子的个数之比为
(5)有一种由Na2S、Na2SO3、Na2SO4组成的混合物,经测定含硫的质量分数为25.6%,则混合物中含氧的质量分数为
(6)某同学为测定份NaHCO3和Na2CO3混合固体中NaHCO3的纯度,称取m1g混合物,加热至质量不变时,称其质量为m2g,则原混合物中NaHCO3的质量分数为
您最近一年使用:0次
名校
解题方法
10 . 重铬酸钾(K2Cr2O7)具有强氧化性,在实验室和工业中都有很广泛的应用。其主要应用之一是配制铬酸洗液(重铬酸钾、水和浓硫酸按照一定比例配制成的溶液)。根据所学知识,回答下列问题:
(1) K2Cr2O7中Cr的化合价为_______ 价,属于_______ (填“酸”、“碱”或“盐”)。
(2)当铬酸洗液变绿[溶液中K2Cr2O7转化成Cr2(SO4)3]失效时,将失效的铬酸洗液进行加热浓缩,冷却后加入KMnO4粉末氧化,滤去MnO2后可实现铬酸洗液的再生,其中加入KMnO4粉末氧化时发生反应的离子方程式为_______ (用单线桥法标明电子转移的方向和数目);滤去MnO2时,可采用过滤操作,过滤需要用到的玻璃仪器有_______ 。
(3)当铬酸洗液变黑失效时,可在酸性条件下加入铁屑将残留的K2Cr2O7转化成Cr2(SO4)3,铁屑自身转化成Fe3+,再用石灰石将铬元素转化成Cr(OH)3沉淀,其中铁屑将 转化成Cr3+的离子方程式为
转化成Cr3+的离子方程式为_______ ;若黑色铬酸洗液中 ,则处理1L该黑色铬酸洗液时,所需的铁屑的质量为
,则处理1L该黑色铬酸洗液时,所需的铁屑的质量为_______ g。
(4)酸性 K2Cr2O7溶液还可以用来测定铁矿石中铁(以+2价形式存在,铁的含量为x%)的含量,称取铁矿石试样(含Fe2+,设其他物质不与K2Cr2O7反应)0.4g,若加入的酸性K2Cr2O7溶液的体积为x mL,则K2Cr2O7的浓度为_______ g∙L-1。
(1) K2Cr2O7中Cr的化合价为
(2)当铬酸洗液变绿[溶液中K2Cr2O7转化成Cr2(SO4)3]失效时,将失效的铬酸洗液进行加热浓缩,冷却后加入KMnO4粉末氧化,滤去MnO2后可实现铬酸洗液的再生,其中加入KMnO4粉末氧化时发生反应的离子方程式为
(3)当铬酸洗液变黑失效时,可在酸性条件下加入铁屑将残留的K2Cr2O7转化成Cr2(SO4)3,铁屑自身转化成Fe3+,再用石灰石将铬元素转化成Cr(OH)3沉淀,其中铁屑将
 转化成Cr3+的离子方程式为
转化成Cr3+的离子方程式为 ,则处理1L该黑色铬酸洗液时,所需的铁屑的质量为
,则处理1L该黑色铬酸洗液时,所需的铁屑的质量为(4)酸性 K2Cr2O7溶液还可以用来测定铁矿石中铁(以+2价形式存在,铁的含量为x%)的含量,称取铁矿石试样(含Fe2+,设其他物质不与K2Cr2O7反应)0.4g,若加入的酸性K2Cr2O7溶液的体积为x mL,则K2Cr2O7的浓度为
您最近一年使用:0次
2022-11-11更新
|
377次组卷
|
2卷引用:江西省吉安市2022-2023学年高一上学期11月期中联考化学试题



