解题方法
1 . 试回答下列问题
(1)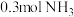 ,分子中所含质子数与
,分子中所含质子数与___________ 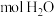 分子中所含质子数相等。
分子中所含质子数相等。
(2)正常人的血液中葡萄糖(简称血糖,分子式为 )的浓度在
)的浓度在 之间,今测得某病人1mL血液中含葡萄糖0.60mg,相当于
之间,今测得某病人1mL血液中含葡萄糖0.60mg,相当于___________ 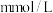 。
。
(3)质量分数为36.5%浓盐酸(密度为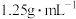 )的物质的量浓度为
)的物质的量浓度为___________ ,若配制250mL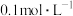 的盐酸,需要量取浓盐酸的体积为
的盐酸,需要量取浓盐酸的体积为___________ mL。
(1)
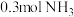 ,分子中所含质子数与
,分子中所含质子数与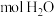 分子中所含质子数相等。
分子中所含质子数相等。(2)正常人的血液中葡萄糖(简称血糖,分子式为
 )的浓度在
)的浓度在 之间,今测得某病人1mL血液中含葡萄糖0.60mg,相当于
之间,今测得某病人1mL血液中含葡萄糖0.60mg,相当于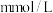 。
。(3)质量分数为36.5%浓盐酸(密度为
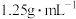 )的物质的量浓度为
)的物质的量浓度为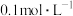 的盐酸,需要量取浓盐酸的体积为
的盐酸,需要量取浓盐酸的体积为
您最近一年使用:0次
名校
2 . “84消毒液”能有效杀灭甲型H1N1病毒,某同学购买了一瓶84消毒液,该消毒液通常稀释到100倍(体积比)使用。查阅相关资料和消毒液包装说明得到如图信息:
(1)该84消毒液NaClO物质的量浓度约为_______ (保留1位小数)。
(2)该同学参阅该84消毒液的配方,欲用NaClO固体配制480mL该种84消毒液。下列说法不正确的是_______ (填字母)。
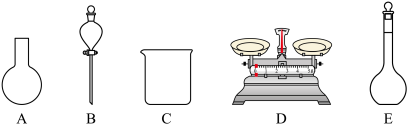
A.如图所示的仪器中,有三种是不需要的,还另需要一种玻璃仪器
B.使用前要检查容量瓶是否漏液
C.容量瓶上标有容积、温度和浓度
D.需要称量NaClO固体的质量为149.0g
E.容量瓶用蒸馏水洗净后,须烘干后再使用
(3)一瓶上述84消毒液理论上能吸收空气中_______ L的CO2(标准状况下)而变质。(已知:CO2+NaClO+H2O=NaHCO3+HClO)
(4)84消毒液与稀硫酸混合使用可增强消毒能力,请用化学方程式解释其原因_______ ,某消毒小组人员用18.4mol·L-1的浓硫酸配制500mL2.3mol·L-1的稀硫酸用于增强84消毒液的消毒能力,需取用浓硫酸的体积为_______ mL。
(5)在配制过程中,下列操作中能使所配溶液的浓度偏高的有_______ (填代号)。
①用量筒量取98%的硫酸时俯视
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③转移前,容量瓶中含有少量蒸馏水
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤定容时,俯视刻度线
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
| 84消毒液 (有效成分)NaClO (规格)1000mL (质量分数)25% (密度)1.19g/cm3 |
(1)该84消毒液NaClO物质的量浓度约为
(2)该同学参阅该84消毒液的配方,欲用NaClO固体配制480mL该种84消毒液。下列说法不正确的是

A.如图所示的仪器中,有三种是不需要的,还另需要一种玻璃仪器
B.使用前要检查容量瓶是否漏液
C.容量瓶上标有容积、温度和浓度
D.需要称量NaClO固体的质量为149.0g
E.容量瓶用蒸馏水洗净后,须烘干后再使用
(3)一瓶上述84消毒液理论上能吸收空气中
(4)84消毒液与稀硫酸混合使用可增强消毒能力,请用化学方程式解释其原因
(5)在配制过程中,下列操作中能使所配溶液的浓度偏高的有
①用量筒量取98%的硫酸时俯视
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③转移前,容量瓶中含有少量蒸馏水
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤定容时,俯视刻度线
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
您最近一年使用:0次
2023-08-26更新
|
284次组卷
|
2卷引用:辽宁省大连市第八中学2022-2023学年高一上学期12月月考化学试题
3 . 回答下列问题:
(1)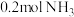 分子中所含氢原子数与
分子中所含氢原子数与_______ 个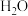 分子中所含氢原子数相等。
分子中所含氢原子数相等。
(2)在25℃、101KPa的条件下,同质量的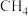 和A气体的体积之比是15:8则A的摩尔质量为
和A气体的体积之比是15:8则A的摩尔质量为_______
(3)阿伏加德罗曾做过这样一个实验:一个抽空的密闭容器中Mg,在标准状况下,盛满以相同物质的量混合的NO和 的混合气体后,称量为
的混合气体后,称量为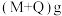 ,把混合气体排尽,再充满
,把混合气体排尽,再充满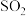 气体,为使天平平衡,应在托盘天平的
气体,为使天平平衡,应在托盘天平的_______ 边托盘上放置_______ g的砝码
(4)将1mol的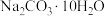 晶体溶于
晶体溶于_______ g水中,可使10个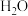 分子中溶有1个
分子中溶有1个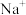
(5)已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中的信息,回答下列问题:
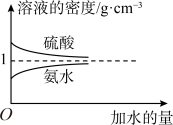
①表中硫酸的质量分数为_______ (不写单位,用含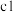 、
、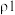 的代数式表示)。
的代数式表示)。
②物质的量浓度为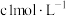 的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为
的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为_______  。
。
③物质的量浓度为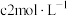 的氨水与水等质量混合,所得溶液的密度
的氨水与水等质量混合,所得溶液的密度_______ (填“大于”、“小于”或“等于”,下同)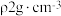 。所得溶液的物质的量浓度
。所得溶液的物质的量浓度_______ 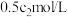 (混合后溶液体积变化忽略不计)
(混合后溶液体积变化忽略不计)
(1)
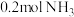 分子中所含氢原子数与
分子中所含氢原子数与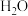 分子中所含氢原子数相等。
分子中所含氢原子数相等。(2)在25℃、101KPa的条件下,同质量的
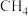 和A气体的体积之比是15:8则A的摩尔质量为
和A气体的体积之比是15:8则A的摩尔质量为(3)阿伏加德罗曾做过这样一个实验:一个抽空的密闭容器中Mg,在标准状况下,盛满以相同物质的量混合的NO和
 的混合气体后,称量为
的混合气体后,称量为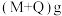 ,把混合气体排尽,再充满
,把混合气体排尽,再充满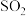 气体,为使天平平衡,应在托盘天平的
气体,为使天平平衡,应在托盘天平的(4)将1mol的
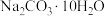 晶体溶于
晶体溶于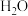 分子中溶有1个
分子中溶有1个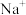
(5)已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中的信息,回答下列问题:

溶质的物质的量浓度/ | 溶液的密度/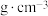 | ||
| 硫酸 | 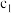 | 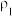 | |
| 氨水 | 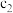 | 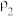 |
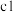 、
、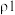 的代数式表示)。
的代数式表示)。②物质的量浓度为
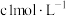 的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为
的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为 。
。③物质的量浓度为
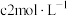 的氨水与水等质量混合,所得溶液的密度
的氨水与水等质量混合,所得溶液的密度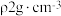 。所得溶液的物质的量浓度
。所得溶液的物质的量浓度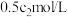 (混合后溶液体积变化忽略不计)
(混合后溶液体积变化忽略不计)
您最近一年使用:0次
名校
4 . 在一定温度下,向体积为2L的恒容密闭容器中充入一定量的A、B发生化学反应(除物质D为固体外,其余的物质均为气体),各物质的含量随时间的变化情况如图所示,请回答下列问题:
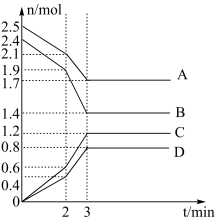
(1)写出该反应的化学方程式:___________ ,0~2min内用C表示的化学反应速率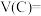
___ 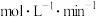 。
。
(2)该反应在2min时改变了某一条件,则该条件可能为___________ 。
(3)下列能说明反应达到平衡的是___________(填标号)。
(4)反应至某时刻,此时压强与初始压强的比值为43:49,则此时B物质的转化率为_________ %(保留三位有效数字),此时该反应________ (填“是”或“否”)达到平衡。

(1)写出该反应的化学方程式:
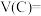
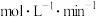 。
。(2)该反应在2min时改变了某一条件,则该条件可能为
(3)下列能说明反应达到平衡的是___________(填标号)。
| A.反应体系内气体的压强不再发生变化 |
| B.反应体系内气体的密度不再发生变化 |
| C.A与C的浓度之比为6:4 |
D.当有 被消耗的同时有 被消耗的同时有 被消耗 被消耗 |
您最近一年使用:0次
2022-07-28更新
|
585次组卷
|
2卷引用:辽宁省营口市普通高中2021-2022学年高一下学期期末化学试题
解题方法
5 . I.水中溶解氧气的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置;加入适量稀H2SO4,待MnO(OH)2与I-完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,反应方程式为2S2O +I2=S4O
+I2=S4O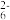 +2I-,测定过程中物质的转化关系如下:O2
+2I-,测定过程中物质的转化关系如下:O2 2MnO(OH)2
2MnO(OH)2 I2
I2 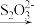 S4O
S4O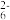 。
。
(1)写出O2将Mn2+氧化成MnO(OH)2的离子方程式:____________________ 。
(2)取池塘水样100.00 mL,按上述方法测定水中溶解的氧气浓度,消耗0.01000 mol·L-1 Na2S2O3标准溶液13.50 mL。计算该水样中溶解的氧气浓度为_________ mg·L-1。
Ⅱ.益源生(药品名叫复方硫酸亚铁叶酸片)是一种治疗缺铁性贫血的药物其主要成分有硫酸亚铁、叶酸、干酵母、当归、黄芪、白术等,下面是测定益源生中硫酸亚铁质量分数的实验。取10片复方硫酸亚铁片(每片a毫克)研成粉末,加水溶解,过滤,再将滤液配成100 mL溶液,取出25 mL与双氧水反应(假设叶酸、干酵母、当归、黄芪、白术均不与双氧水反应)。
(1)配制一定浓度的双氧水溶液用质量分数30%、密度1.l g/cm3)的双氧水配制1.0 mol/L的双氧水100 mL,则30%双氧水物质的量浓度为________ mol/L(保留一位小数),需用量筒量取30%的双氧水_________ mL。
(2)该实验在酸性条件下进行,则实验设计的反应原理是_____________ (用离子方程式表示)。
(3)若上述实验消耗1.0 mol/L的双氧水b mL,则每片复方硫酸亚铁叶酸片中硫酸亚铁的质量分数为_________ (用含a、b的式子表示)。
 +I2=S4O
+I2=S4O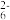 +2I-,测定过程中物质的转化关系如下:O2
+2I-,测定过程中物质的转化关系如下:O2 2MnO(OH)2
2MnO(OH)2 I2
I2 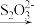 S4O
S4O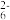 。
。(1)写出O2将Mn2+氧化成MnO(OH)2的离子方程式:
(2)取池塘水样100.00 mL,按上述方法测定水中溶解的氧气浓度,消耗0.01000 mol·L-1 Na2S2O3标准溶液13.50 mL。计算该水样中溶解的氧气浓度为
Ⅱ.益源生(药品名叫复方硫酸亚铁叶酸片)是一种治疗缺铁性贫血的药物其主要成分有硫酸亚铁、叶酸、干酵母、当归、黄芪、白术等,下面是测定益源生中硫酸亚铁质量分数的实验。取10片复方硫酸亚铁片(每片a毫克)研成粉末,加水溶解,过滤,再将滤液配成100 mL溶液,取出25 mL与双氧水反应(假设叶酸、干酵母、当归、黄芪、白术均不与双氧水反应)。
(1)配制一定浓度的双氧水溶液用质量分数30%、密度1.l g/cm3)的双氧水配制1.0 mol/L的双氧水100 mL,则30%双氧水物质的量浓度为
(2)该实验在酸性条件下进行,则实验设计的反应原理是
(3)若上述实验消耗1.0 mol/L的双氧水b mL,则每片复方硫酸亚铁叶酸片中硫酸亚铁的质量分数为
您最近一年使用:0次
名校
解题方法
6 . 物质的量是高中化学常用的物理量,请完成以下有关计算。
(1)将3.22g芒硝(Na2SO4·10H2O)溶于水中,要使每100个水分子中溶有1个Na+,则需水的质量为___ g。
(2)人造空气(氧气和氦气的混合气)可用于减轻某些疾病或供深水潜水员使用。在标准状况下,11.2L人造空气的质量是4.8g,其中氧气和氦气的分子数之比是___ ,氧气的质量是___ 。
(3)25.4g某二价金属A的氯化物中含有0.4molCl-,则A的摩尔质量为___ 。
(4)现有M、N两种气态化合物,其摩尔质量之比为2:1,将M、N两种气体分别溶于水(M、N与水均不反应)配成溶液,当两种溶液的质量分数相同时,其密度分别为d1和d2,则两种溶液的物质的量浓度之比为___ 。
(1)将3.22g芒硝(Na2SO4·10H2O)溶于水中,要使每100个水分子中溶有1个Na+,则需水的质量为
(2)人造空气(氧气和氦气的混合气)可用于减轻某些疾病或供深水潜水员使用。在标准状况下,11.2L人造空气的质量是4.8g,其中氧气和氦气的分子数之比是
(3)25.4g某二价金属A的氯化物中含有0.4molCl-,则A的摩尔质量为
(4)现有M、N两种气态化合物,其摩尔质量之比为2:1,将M、N两种气体分别溶于水(M、N与水均不反应)配成溶液,当两种溶液的质量分数相同时,其密度分别为d1和d2,则两种溶液的物质的量浓度之比为
您最近一年使用:0次
11-12高一上·辽宁抚顺·阶段练习
名校
解题方法
7 . 常温下,将20.0g质量分数为14.0%的KNO3溶液跟30.0g质量分数为24.0%的KNO3溶液混合,得到密度为1.15g•cm-3的混合溶液。计算:
(1)混合后溶液中溶质的质量分数为____ 。
(2)混合后溶液中溶质的物质的量浓度为___ 。
(3)在1000g水中需溶解____ molKNO3才能使其浓度恰好与上述混合后溶液的浓度相等。
(1)混合后溶液中溶质的质量分数为
(2)混合后溶液中溶质的物质的量浓度为
(3)在1000g水中需溶解
您最近一年使用:0次
2020-08-31更新
|
1444次组卷
|
35卷引用:2011-2012学年辽宁省抚顺县高中高一9月月考理科综合试题(化学部分)
(已下线)2011-2012学年辽宁省抚顺县高中高一9月月考理科综合试题(化学部分)(已下线)2014-2015学年云南省玉溪市一中高一上学期期中化学试卷2016-2017学年北大附中河南分校高一上第一次月考化学卷2016-2017学年湖南省双峰县第一中学高一上第一次月考化学试卷2016-2017学年湖南省湘潭县第一中学高一下学期第一次模块考试化学试卷河北省定州中学2017-2018学年高一上学期开学考试化学试题河南省林州市第一中学2017-2018学年高一(普通班)10月调研化学试题甘肃省武威第五中学2017-2018学年高一上学期第一次月考化学试题四川省乐山沫若中学2017-2018学年高一上学期第一次月考化学试题河北省石家庄市第一中学2017-2018学年高一上学期期中考试化学试题广东省仲元中学2017-2018学年高一上学期期中考试化学试题福建省晋江市季延中学2017-2018学年高一上学期期中考试化学试题云南省峨山彝族自治县第一中学2017-2018学年高一上学期11月考试化学试题河北省辛集市第一中学2017-2018学年高二上学期第三次月考化学试题江苏省南通市、盐城市六校联盟2017-2018学年高一上学期期中联考(通泰)化学试题(已下线)2018年9月7日 《每日一题》人教必修1-溶液稀释或混合的计算(已下线)2018年9月16日《每日一题》人教必修1- 每周一测(已下线)2018年10月20日 《每日一题》人教必修1 - 周末培优四川省三台中学实验学校2018-2019学年高一上学期第一次月考化学试题(已下线)第16天 溶解度、溶质质量分数和物质的量浓度之间的关系——《2019年暑假作业总动员》高一化学(已下线)2019年9月6日《每日一题》 必修1 溶液稀释或混合的计算(已下线)2019年9月15日 《每日一题》必修1 —— 每周一测2019年10月19日《每日一题》2019-2020学年高一化学人教必修1——周末培优吉林省榆树市第一高级中学2019-2020学年高一上学期期中考试化学试卷四川省成都市成都外国语学校2019-2020学年高一上学期期中考试化学试题四川省成都三中2019-2020学年高一11月月考化学试题(已下线)期中模拟卷(二)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)苏教版(2020)高一必修第一册专题2第二单元突破1 物质的量浓度的有关计算人教版(2019)高一必修第一册 第二章 专题2 物质的量浓度的有关计算鲁科版(2019)高一必修第一册第1章 认识化学科学 第3节 物质的量 专题1 物质的量浓度的有关计算高一必修第一册(鲁科2019)第1章 章末综合检测卷甘肃省武威八中2020-2021学年高一上学期10月月考化学试题甘肃省民勤县第一中学2020-2021学年高一上学期第一次月考化学试题安徽桐城重点中学2021-2022学年高一上学期开学教学质量检测化学试题(已下线)【南昌新东方】2019 湾里一中 高一上第一次月考
名校
8 . 将金属M的样品2.5g放入50g 19.6%的硫酸溶液中,恰好完全反应(样品中的杂质既不溶于硫酸,也不与其发生反应),生成硫酸盐。实验测知,此硫酸盐中硫、氧元素的质量分数之和为80 %。试求:
(1)原金属样品中,金属M的质量分数_____
(2)M的相对原子质量__________
(3)反应所得的硫酸盐溶液中溶质的质量分数___________
(1)原金属样品中,金属M的质量分数
(2)M的相对原子质量
(3)反应所得的硫酸盐溶液中溶质的质量分数
您最近一年使用:0次
名校
9 . 某铝合金中含有镁、铜、铝三种金属,现取10.0g 该铝合金,向其中加入100mL 3.0mol/L 氢氧化钠溶液,氢氧化钠溶液恰好完全反应,请计算:
(1)该铝合金中铝的质量分数________
(2)生成标准状况下的氢气的体积是_________
(1)该铝合金中铝的质量分数
(2)生成标准状况下的氢气的体积是
您最近一年使用:0次
2019-12-22更新
|
189次组卷
|
3卷引用:辽宁师范大学附属中学2019-2020学年高一上学期第二次模块考试化学试题
名校
10 . 将1.95g由Na2SO4和Na2CO3组成的混合物溶于水得溶液A,在A中加入10mL未知的BaCl2溶液恰好完全反应,过滤得沉淀B,向B中加入足量稀盐酸,充分反应后剩余沉淀2.33g。计算:
(1)原混合物中Na2CO3的质量分数_______________ 。
(2)BaCl2溶液的物质的量浓度_______________ 。
(1)原混合物中Na2CO3的质量分数
(2)BaCl2溶液的物质的量浓度
您最近一年使用:0次
2017-12-22更新
|
797次组卷
|
14卷引用:【全国校级联考】辽宁省葫芦岛市普通高中2017-2018学年高一教学质量监测(期末)化学试题
【全国校级联考】辽宁省葫芦岛市普通高中2017-2018学年高一教学质量监测(期末)化学试题宁夏育才中学勤行校区2017-2018学年高一12月月考化学试题广西陆川县中学2017-2018学年高一12月月考化学试题黑龙江省大庆中学2017-2018学年高一上学期期末化学试题甘肃省武威第二中学2017-2018学年高一上学期期末考试化学试题山东省泰安市2017-2018学年高一上学期期末考试化学试题【校级联考】江西省南昌市八一中学、洪都中学2018-2019学年高一10月联考化学试题山西省忻州市第二中学2019届高三上学期期中考试化学试题福建省晋江市季延中学2018-2019学年高一上学期期末考试化学试题黑龙江省海林市朝鲜族中学2019-2020学年高一上学期期末考试化学试题(已下线)第02章 海水中的重要元素——钠和氯(A卷基础强化篇)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)(已下线)专题02 物质的量(核心素养卷)——【新教材精创】2019-2020学年高中化学新教材知识讲学广东东莞松山湖学校2019-2020学年度高一上学期期中考试化学试题甘肃省甘南州夏河中学2020-2021学年高一上学期期中考试化学试题



