将1.95g由Na2SO4和Na2CO3组成的混合物溶于水得溶液A,在A中加入10mL未知的BaCl2溶液恰好完全反应,过滤得沉淀B,向B中加入足量稀盐酸,充分反应后剩余沉淀2.33g。计算:
(1)原混合物中Na2CO3的质量分数_______________ 。
(2)BaCl2溶液的物质的量浓度_______________ 。
(1)原混合物中Na2CO3的质量分数
(2)BaCl2溶液的物质的量浓度
17-18高一上·宁夏·阶段练习 查看更多[14]
甘肃省甘南州夏河中学2020-2021学年高一上学期期中考试化学试题广东东莞松山湖学校2019-2020学年度高一上学期期中考试化学试题(已下线)专题02 物质的量(核心素养卷)——【新教材精创】2019-2020学年高中化学新教材知识讲学(已下线)第02章 海水中的重要元素——钠和氯(A卷基础强化篇)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)黑龙江省海林市朝鲜族中学2019-2020学年高一上学期期末考试化学试题福建省晋江市季延中学2018-2019学年高一上学期期末考试化学试题山西省忻州市第二中学2019届高三上学期期中考试化学试题【校级联考】江西省南昌市八一中学、洪都中学2018-2019学年高一10月联考化学试题【全国校级联考】辽宁省葫芦岛市普通高中2017-2018学年高一教学质量监测(期末)化学试题山东省泰安市2017-2018学年高一上学期期末考试化学试题甘肃省武威第二中学2017-2018学年高一上学期期末考试化学试题黑龙江省大庆中学2017-2018学年高一上学期期末化学试题广西陆川县中学2017-2018学年高一12月月考化学试题宁夏育才中学勤行校区2017-2018学年高一12月月考化学试题
更新时间:2017-12-22 06:19:00
|
相似题推荐
计算题
|
适中
(0.65)
【推荐1】用15.8g高锰酸钾氧化密度为1.19g/cm3、质量分数为36.5%的盐酸以制取氯气。反应如下:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
求:(1)生成Cl2在标况下的体积?____
(2)求盐酸的浓度?____
(3)如果恰好完全反应,求所需盐酸的体积?____
求:(1)生成Cl2在标况下的体积?
(2)求盐酸的浓度?
(3)如果恰好完全反应,求所需盐酸的体积?
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
解题方法
【推荐2】将12.6g无水亚硫酸钠固体加入100mL 8mol·L-1的硫酸中以制取SO2气体,反应完全后,若溶液中含+4价硫元素的物质的总浓度为0.2mol·L-1,假定溶液体积不变,忽略容器及导管中的气体体积,求:
(1)溶液中硫元素的质量_________ 。
(2)收集到SO2气体_________ 毫升(标准状况下)?
(1)溶液中硫元素的质量
(2)收集到SO2气体
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐3】根据所学知识,回答下列问题:
(1)同温同压下,同体积的气体甲烷(CH4)和二氧化碳的密度之比为___________ 。
(2)在Na2SO4和Fe(SO4)3的混合溶液中,Na+的物质的量浓度为0.1 mol/L, 的物质的量浓度为0.5 mol/L,则混合溶液中Fe3+的物质的量浓度为
的物质的量浓度为0.5 mol/L,则混合溶液中Fe3+的物质的量浓度为___________ mol/L。
(3)实验室将11.7 g氯化钠溶于水配制成500 mL溶液,取出50 mL该溶液,取出的溶液中n(Cl-)=___________ mol,c(Na+)=___________ mol/L。
(4)已知反应: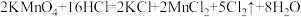 。若产生的Cl2在标准状况下的体积为5.6 L,则反应中被氧化的HCl的物质的量为
。若产生的Cl2在标准状况下的体积为5.6 L,则反应中被氧化的HCl的物质的量为___________ mol。
(1)同温同压下,同体积的气体甲烷(CH4)和二氧化碳的密度之比为
(2)在Na2SO4和Fe(SO4)3的混合溶液中,Na+的物质的量浓度为0.1 mol/L,
 的物质的量浓度为0.5 mol/L,则混合溶液中Fe3+的物质的量浓度为
的物质的量浓度为0.5 mol/L,则混合溶液中Fe3+的物质的量浓度为(3)实验室将11.7 g氯化钠溶于水配制成500 mL溶液,取出50 mL该溶液,取出的溶液中n(Cl-)=
(4)已知反应:
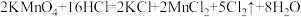 。若产生的Cl2在标准状况下的体积为5.6 L,则反应中被氧化的HCl的物质的量为
。若产生的Cl2在标准状况下的体积为5.6 L,则反应中被氧化的HCl的物质的量为
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐1】为测定某氟化稀土样品中氟元素的质量分数,某化学兴趣小组进行了如下实验。利用高氯酸(高沸点酸)将mg样品中的氟元素转化为氟化氢(低沸点酸)蒸出,再进行酸碱滴定来测定含量。实验装置如图所示。
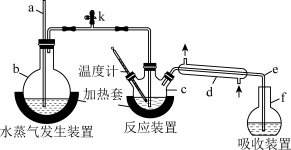
定量测定:将f中得到的馏出液配成 溶液,取其中
溶液,取其中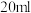 加入
加入
 溶液,得到
溶液,得到 沉淀(不考虑其他沉淀的生成),再用
沉淀(不考虑其他沉淀的生成),再用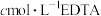 标准溶液滴定剩余
标准溶液滴定剩余 (
( 与
与 按
按 配合),消耗
配合),消耗 标准溶液
标准溶液 ,则氟化稀土样品中氟的质量分数为
,则氟化稀土样品中氟的质量分数为___ 。

定量测定:将f中得到的馏出液配成
 溶液,取其中
溶液,取其中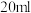 加入
加入
 溶液,得到
溶液,得到 沉淀(不考虑其他沉淀的生成),再用
沉淀(不考虑其他沉淀的生成),再用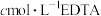 标准溶液滴定剩余
标准溶液滴定剩余 (
( 与
与 按
按 配合),消耗
配合),消耗 标准溶液
标准溶液 ,则氟化稀土样品中氟的质量分数为
,则氟化稀土样品中氟的质量分数为
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐2】(1)24.8 g Na2R含有Na+ 0.8 mol则R的摩尔质量为_________________ 。
(2)质量都为a g的镁和铝,物质的量之比为___________ ;将它们分别放入适量的盐酸溶液中恰好完全反应,则消耗的HCl的物质的量之比为___________ 。
(3)在标准状况下,CO和CO2混合气体的质量为36 g,体积为22.4 L,则其中CO2所占的体积为_________ ,CO所占的质量为_________ 。
(2)质量都为a g的镁和铝,物质的量之比为
(3)在标准状况下,CO和CO2混合气体的质量为36 g,体积为22.4 L,则其中CO2所占的体积为
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐3】某氮肥NH4HCO3中混有少量的(NH4)2CO3,现采用下列方案测定该氮肥中(NH4)2CO3的质量分数:称取5.7 g上述样品与2.0 mol/L NaOH溶液混合,完全溶解后,低温加热使其充分反应(该温度下铵盐不分解),并使生成的氨气全部被硫酸吸收,测得氨气的质量与所用NaOH溶液体积的关系如图所示:

请回答下列问题:
(1)A点前样品与NaOH反应的离子方程式为______________________ 。
(2)为使生成的氨气被硫酸吸收时不发生倒吸,可以选用下列装置中的_________ (填编号)。
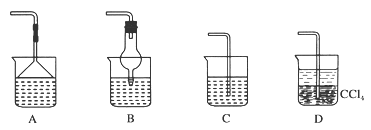
(3)样品中(NH4)2CO3的质量分数是________ %(保留一位小数)。
(4)当V[NaOH(aq)]=50 mL时,生成NH3的质量为________ 。

请回答下列问题:
(1)A点前样品与NaOH反应的离子方程式为
(2)为使生成的氨气被硫酸吸收时不发生倒吸,可以选用下列装置中的

(3)样品中(NH4)2CO3的质量分数是
(4)当V[NaOH(aq)]=50 mL时,生成NH3的质量为
您最近一年使用:0次



