解题方法
1 . SO2在生产生活中有重要的应用,处理不当会造成环境污染。回答下列问题:
(1)标准状况下16.0gSO2的体积为______ L,与______ molH2O中所含氧原子数相等。
(2)为测定某工厂废气中SO2的含量,课外小组的同学将废气样品经过管道通入密闭容器中的100mL0.1000mol•L-1的酸性高锰酸钾溶液。反应原理为:5SO2+2MnO +2H2O=5SO
+2H2O=5SO +2Mn2++4H+。
+2Mn2++4H+。
①该反应中被还原的元素是_____ 。
②100mL该酸性高锰酸钾溶液恰好完全反应时,转移电子的数目为______ 。
③若通入管道的废气样品为am3时,酸性高锰酸钾溶液恰好褪色,则该废气样品中SO2的含量为______ g•m-3(用含a的表达式表示,假定样品中其它气体均不参与反应,SO2可被溶液充分吸收)。
④实验需240mL0.500mol•L-1的硫酸溶液,使用的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管、_____ ;需用量筒量取密度为1.84g•cm-3,质量分数为98%的浓硫酸_____ mL;若定容时俯视刻度线,则所配溶液的浓度______ (填“偏高”、“偏低”或“不变”)。
(1)标准状况下16.0gSO2的体积为
(2)为测定某工厂废气中SO2的含量,课外小组的同学将废气样品经过管道通入密闭容器中的100mL0.1000mol•L-1的酸性高锰酸钾溶液。反应原理为:5SO2+2MnO
 +2H2O=5SO
+2H2O=5SO +2Mn2++4H+。
+2Mn2++4H+。①该反应中被还原的元素是
②100mL该酸性高锰酸钾溶液恰好完全反应时,转移电子的数目为
③若通入管道的废气样品为am3时,酸性高锰酸钾溶液恰好褪色,则该废气样品中SO2的含量为
④实验需240mL0.500mol•L-1的硫酸溶液,使用的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管、
您最近一年使用:0次
名校
解题方法
2 . 完成下列小题
(1) 溶液含中,含
溶液含中,含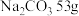 ,则该溶液中
,则该溶液中 的物质的量浓度
的物质的量浓度_____  。
。
(2)对于反应: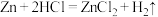 ,现有
,现有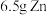 放入
放入 的
的 溶液中充分反应后,溶液中存在的溶质有
溶液中充分反应后,溶液中存在的溶质有_____ 。
(3)对于反应: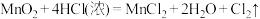 。
。
①用双线桥法表示上述反应电子转移的方向和数目_____ 。
②上述反应中还原剂是_____ ,若该反应有中有 电子转移,实际参加反应的
电子转移,实际参加反应的 质量
质量_____ g,生成氯在气在STP时体积是_____ L。
③若使用浓盐酸的质量分数0.365、密度 ,该浓盐酸物质的量浓度是
,该浓盐酸物质的量浓度是_____  。
。
(1)
 溶液含中,含
溶液含中,含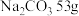 ,则该溶液中
,则该溶液中 的物质的量浓度
的物质的量浓度 。
。(2)对于反应:
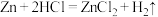 ,现有
,现有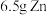 放入
放入 的
的 溶液中充分反应后,溶液中存在的溶质有
溶液中充分反应后,溶液中存在的溶质有(3)对于反应:
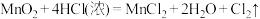 。
。①用双线桥法表示上述反应电子转移的方向和数目
②上述反应中还原剂是
 电子转移,实际参加反应的
电子转移,实际参加反应的 质量
质量③若使用浓盐酸的质量分数0.365、密度
 ,该浓盐酸物质的量浓度是
,该浓盐酸物质的量浓度是 。
。
您最近一年使用:0次
名校
3 . “84消毒液”能有效杀灭甲型H1N1病毒,某同学购买了一瓶84消毒液,该消毒液通常稀释到100倍(体积比)使用。查阅相关资料和消毒液包装说明得到如图信息:
(1)该84消毒液NaClO物质的量浓度约为_______ (保留1位小数)。
(2)该同学参阅该84消毒液的配方,欲用NaClO固体配制480mL该种84消毒液。下列说法不正确的是_______ (填字母)。
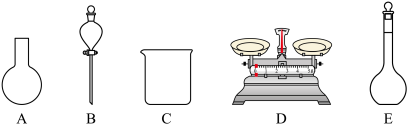
A.如图所示的仪器中,有三种是不需要的,还另需要一种玻璃仪器
B.使用前要检查容量瓶是否漏液
C.容量瓶上标有容积、温度和浓度
D.需要称量NaClO固体的质量为149.0g
E.容量瓶用蒸馏水洗净后,须烘干后再使用
(3)一瓶上述84消毒液理论上能吸收空气中_______ L的CO2(标准状况下)而变质。(已知:CO2+NaClO+H2O=NaHCO3+HClO)
(4)84消毒液与稀硫酸混合使用可增强消毒能力,请用化学方程式解释其原因_______ ,某消毒小组人员用18.4mol·L-1的浓硫酸配制500mL2.3mol·L-1的稀硫酸用于增强84消毒液的消毒能力,需取用浓硫酸的体积为_______ mL。
(5)在配制过程中,下列操作中能使所配溶液的浓度偏高的有_______ (填代号)。
①用量筒量取98%的硫酸时俯视
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③转移前,容量瓶中含有少量蒸馏水
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤定容时,俯视刻度线
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
| 84消毒液 (有效成分)NaClO (规格)1000mL (质量分数)25% (密度)1.19g/cm3 |
(1)该84消毒液NaClO物质的量浓度约为
(2)该同学参阅该84消毒液的配方,欲用NaClO固体配制480mL该种84消毒液。下列说法不正确的是

A.如图所示的仪器中,有三种是不需要的,还另需要一种玻璃仪器
B.使用前要检查容量瓶是否漏液
C.容量瓶上标有容积、温度和浓度
D.需要称量NaClO固体的质量为149.0g
E.容量瓶用蒸馏水洗净后,须烘干后再使用
(3)一瓶上述84消毒液理论上能吸收空气中
(4)84消毒液与稀硫酸混合使用可增强消毒能力,请用化学方程式解释其原因
(5)在配制过程中,下列操作中能使所配溶液的浓度偏高的有
①用量筒量取98%的硫酸时俯视
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③转移前,容量瓶中含有少量蒸馏水
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤定容时,俯视刻度线
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
您最近一年使用:0次
2023-08-26更新
|
284次组卷
|
2卷引用:福建省福州市九师教学联盟2023-2024学年高一上学期期末学业联考化学试题
4 . 工业上通常采用将氯气通入消石灰或石灰乳的方法制取漂白粉。消石灰要含略少于1%(质量分数)的水,因为极为干燥的消石灰是不跟氯气反应的。生产漂白粉的反应过程比较复杂,可发生如下反应:
①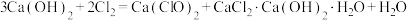 ;
;
②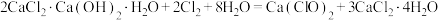 。
。
回答下列问题:
(1) 的摩尔质量为
的摩尔质量为__________ , 中质量分数最大的元素为
中质量分数最大的元素为__________ (填元素符号)。
(2)所含氢原子总数为 的
的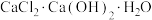 的物质的量为
的物质的量为__________ ,该化合物中Ca元素的物质的量为__________ 。
(3)反应②中,每转移 电子,此时消耗
电子,此时消耗 的体积约为
的体积约为__________ (标准状况下)。
(4)同温同压下,氯化氢与氯气两种气体的密度之比为__________ 。
①
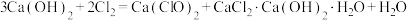 ;
;②
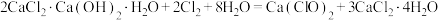 。
。回答下列问题:
(1)
 的摩尔质量为
的摩尔质量为 中质量分数最大的元素为
中质量分数最大的元素为(2)所含氢原子总数为
 的
的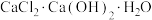 的物质的量为
的物质的量为(3)反应②中,每转移
 电子,此时消耗
电子,此时消耗 的体积约为
的体积约为(4)同温同压下,氯化氢与氯气两种气体的密度之比为
您最近一年使用:0次
5 . 将质量为15g锌片浸入100.2克硫酸铜溶液中,一段时间后,取出锌片,洗涤、干燥、称量,锌片的质量为14.8克。(写出计算过程)
(1)生成铜的质量为多少?_______
(2)剩余的溶液中生成硫酸锌的质量分数为多少?_________
(1)生成铜的质量为多少?
(2)剩余的溶液中生成硫酸锌的质量分数为多少?
您最近一年使用:0次
名校
解题方法
6 . 完成下列问题
(1)8 g CH4在标准状况下所占的体积约为_______ L。
(2)20g重水(D2O)中所含中子数目为_______ 。
(3)10.8g R2O5中氧原子数目为3.01×1023 ,则元素R的相对原子质量为_______ 。
(4)向10.0mL1.00mol·L-1 Na2CO3溶液加水稀释至100mL溶液,此时溶液中Na+的物质的量浓度为_______ 。
(5)实验室常用邻苯二甲酸氢钾(KHC8H4O4)来标定氢氧化钠溶液的浓度,其操作过程为:准确称取4.080g邻苯二甲酸氢钾,加水配成溶液,向溶液中加入1~2滴指示剂,用氢氧化钠溶液滴定至终点,消耗氢氧化钠溶液19.60mL。该氢氧化钠溶液的物质的量浓度为_______ 。(已知:KHC8H4O4+NaOH=KNaC8H4O4+H2O)
(6)100g质量分数为46%的酒精(CH3CH2OH)溶液中氧原子的物质的量为_______ 。
(1)8 g CH4在标准状况下所占的体积约为
(2)20g重水(D2O)中所含中子数目为
(3)10.8g R2O5中氧原子数目为3.01×1023 ,则元素R的相对原子质量为
(4)向10.0mL1.00mol·L-1 Na2CO3溶液加水稀释至100mL溶液,此时溶液中Na+的物质的量浓度为
(5)实验室常用邻苯二甲酸氢钾(KHC8H4O4)来标定氢氧化钠溶液的浓度,其操作过程为:准确称取4.080g邻苯二甲酸氢钾,加水配成溶液,向溶液中加入1~2滴指示剂,用氢氧化钠溶液滴定至终点,消耗氢氧化钠溶液19.60mL。该氢氧化钠溶液的物质的量浓度为
(6)100g质量分数为46%的酒精(CH3CH2OH)溶液中氧原子的物质的量为
您最近一年使用:0次
7 . Ⅰ.氧化还原反应在生产生活中普遍存在。
(1)工业上制取 的原理为:
的原理为: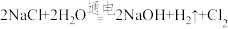 ↑ 。当收集到标准状况下224
↑ 。当收集到标准状况下224
 时,生成的
时,生成的 为
为_______ g。
(2)激光雷达的核心部件需要一种氮化铝( )导热陶瓷片。现取氮化铝样品5.0g(假设杂质只含有炭黑)与50
)导热陶瓷片。现取氮化铝样品5.0g(假设杂质只含有炭黑)与50 2.0
2.0 的
的 溶液恰好完全反应,求氮化铝样品中
溶液恰好完全反应,求氮化铝样品中 的质量分数
的质量分数_______ 已知: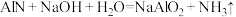 。
。
Ⅱ. 的减排已经引起国际社会的广泛关注,近日我国科学家实现了
的减排已经引起国际社会的广泛关注,近日我国科学家实现了 高选择性、高稳定性加氢合成甲醇(
高选择性、高稳定性加氢合成甲醇( )。回答下列问题:
)。回答下列问题:
(3) 的摩尔质量是
的摩尔质量是______  。
。
(4)2
 中所含原子的物质的量为
中所含原子的物质的量为_______  。
。
(5)_______ g的氢气中所含H原子的数目与1
 相同。
相同。
(6)含0.1 个O的
个O的 中有
中有_______ 个电子,标况下该 的体积为
的体积为_______ L。
(1)工业上制取
 的原理为:
的原理为: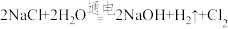 ↑ 。当收集到标准状况下224
↑ 。当收集到标准状况下224
 时,生成的
时,生成的 为
为(2)激光雷达的核心部件需要一种氮化铝(
 )导热陶瓷片。现取氮化铝样品5.0g(假设杂质只含有炭黑)与50
)导热陶瓷片。现取氮化铝样品5.0g(假设杂质只含有炭黑)与50 2.0
2.0 的
的 溶液恰好完全反应,求氮化铝样品中
溶液恰好完全反应,求氮化铝样品中 的质量分数
的质量分数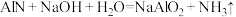 。
。Ⅱ.
 的减排已经引起国际社会的广泛关注,近日我国科学家实现了
的减排已经引起国际社会的广泛关注,近日我国科学家实现了 高选择性、高稳定性加氢合成甲醇(
高选择性、高稳定性加氢合成甲醇( )。回答下列问题:
)。回答下列问题:(3)
 的摩尔质量是
的摩尔质量是 。
。(4)2

 中所含原子的物质的量为
中所含原子的物质的量为 。
。(5)

 相同。
相同。(6)含0.1
 个O的
个O的 中有
中有 的体积为
的体积为
您最近一年使用:0次
8 . 物质的量是高中化学常用的物理量,请完成以下有关计算:
(1)标准状况下,含有相同氧原子数的 和
和 的体积之比为
的体积之比为_____ 。
(2)某气体氧化物的化学式为 ,在标准状况下,
,在标准状况下,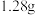 该气体的体积为
该气体的体积为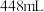 ,则该氧化物的摩尔质量为
,则该氧化物的摩尔质量为_____ 。
(3)某混合溶液中含有离子: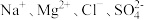 ,测得
,测得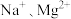 和
和 的物质的量浓度依次为:
的物质的量浓度依次为: ,则
,则
_____  。
。
(4)一瓶 的某品牌矿泉水中部分天然矿物质含量如下:
的某品牌矿泉水中部分天然矿物质含量如下: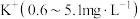 ,
, ,
, ,
, ,一瓶合格的这种矿泉水中
,一瓶合格的这种矿泉水中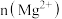 不能超过
不能超过_____  。
。
(1)标准状况下,含有相同氧原子数的
 和
和 的体积之比为
的体积之比为(2)某气体氧化物的化学式为
 ,在标准状况下,
,在标准状况下,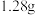 该气体的体积为
该气体的体积为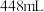 ,则该氧化物的摩尔质量为
,则该氧化物的摩尔质量为(3)某混合溶液中含有离子:
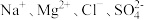 ,测得
,测得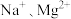 和
和 的物质的量浓度依次为:
的物质的量浓度依次为: ,则
,则
 。
。(4)一瓶
 的某品牌矿泉水中部分天然矿物质含量如下:
的某品牌矿泉水中部分天然矿物质含量如下: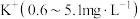 ,
, ,
, ,
, ,一瓶合格的这种矿泉水中
,一瓶合格的这种矿泉水中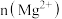 不能超过
不能超过 。
。
您最近一年使用:0次
9 . (1)同温同压下的氧气和氢气,若体积相同时,两种气体的质量比为________ ,若质量相等时,两种气体的体积比________ 。
(2)Cl‒浓度为0.4mol•L‒1的MgCl2溶液的物质的量浓度为________ ,200mL该MgCl2溶液中含Mg2+的数目为____________ 。
(3)50mL质量分数为98%,密度为1.84g·cm-3的硫酸中,H2SO4的物质的量浓度为_____________ 。
(2)Cl‒浓度为0.4mol•L‒1的MgCl2溶液的物质的量浓度为
(3)50mL质量分数为98%,密度为1.84g·cm-3的硫酸中,H2SO4的物质的量浓度为
您最近一年使用:0次
解题方法
10 . (1)用KMnO4氧化盐酸溶液,反应方程式如下:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,若产生的Cl2在标准状况下体积为56L,计算:参加反应的HCl的物质的量_______ 反应中被氧化的HCl的物质的量_______
(2)向某硝酸银溶液中,逐滴加入密度为1.10g·mL-1的盐酸溶液,恰好完全反应时,过滤所得沉淀的质量恰好与盐酸溶液的质量相等。求盐酸的质量分数_______ (需要过程)。
(2)向某硝酸银溶液中,逐滴加入密度为1.10g·mL-1的盐酸溶液,恰好完全反应时,过滤所得沉淀的质量恰好与盐酸溶液的质量相等。求盐酸的质量分数
您最近一年使用:0次



