1 . 防治环境污染,改善生态环境已成为全球共识。十九大报告提出“要像对待生命一样对待生态环境”。回答下列问题:
I.大气污染
(1)汽车尾气:空气中的 、
、 在高温条件下反应生成NO的化学方程式为
在高温条件下反应生成NO的化学方程式为__________ 。
(2)工业上消除氮氧化物的污染可用如下反应: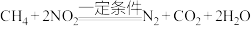 。反应中还原剂为
。反应中还原剂为__________ (填化学式);若反应中消耗 ,则转移电子的物质的量为
,则转移电子的物质的量为__________  。
。
Ⅱ.水体污染
(3)过量排放含氮元素的废水,会引起水华等水体污染问题。含有大量 的废水脱氮可以用
的废水脱氮可以用 氧化法。一定条件下,溶液pH对
氧化法。一定条件下,溶液pH对 去除
去除 能力的影响如图所示。
能力的影响如图所示。
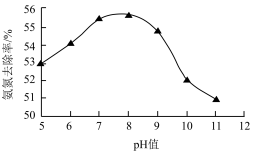
① 时,将
时,将 溶液氧化
溶液氧化 的离子方程式补充完整:
的离子方程式补充完整:_______ 。









②去除氨氮废水适宜的pH约为__________ 。
(4)测定废水中的氮含量:取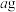 废水,将所含氮完全转化为
废水,将所含氮完全转化为 ,所得
,所得 用过量的
用过量的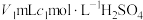 溶液吸收完全,剩余
溶液吸收完全,剩余 用
用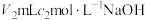 溶液恰好中和,则废水中氮元素的质量分数是
溶液恰好中和,则废水中氮元素的质量分数是__________ 。
I.大气污染
(1)汽车尾气:空气中的
 、
、 在高温条件下反应生成NO的化学方程式为
在高温条件下反应生成NO的化学方程式为(2)工业上消除氮氧化物的污染可用如下反应:
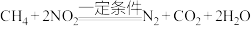 。反应中还原剂为
。反应中还原剂为 ,则转移电子的物质的量为
,则转移电子的物质的量为 。
。Ⅱ.水体污染
(3)过量排放含氮元素的废水,会引起水华等水体污染问题。含有大量
 的废水脱氮可以用
的废水脱氮可以用 氧化法。一定条件下,溶液pH对
氧化法。一定条件下,溶液pH对 去除
去除 能力的影响如图所示。
能力的影响如图所示。
①
 时,将
时,将 溶液氧化
溶液氧化 的离子方程式补充完整:
的离子方程式补充完整:








②去除氨氮废水适宜的pH约为
(4)测定废水中的氮含量:取
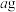 废水,将所含氮完全转化为
废水,将所含氮完全转化为 ,所得
,所得 用过量的
用过量的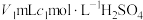 溶液吸收完全,剩余
溶液吸收完全,剩余 用
用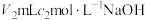 溶液恰好中和,则废水中氮元素的质量分数是
溶液恰好中和,则废水中氮元素的质量分数是
您最近一年使用:0次
名校
解题方法
2 . 工业上用 和碱制漂白粉、漂粉精及漂白液。请回答下列问题:
和碱制漂白粉、漂粉精及漂白液。请回答下列问题:
(1) Ca(ClO)2中Cl元素的化合价是___________ ;工业上将氯气制成漂白粉的主要目的是___________ 。工业上制成漂白粉的化学方程式:___________ 。
(2)下列物质露置在空气中会变质,在变质过程中既有非氧化还原反应发生,又有氧化还原反应发生的是___________(填字母)。
(3)浸泡衣物时加入漂粉精(有效成分Ca(ClO)2)在空气中放置一段时间漂白效果更好,请用化学方程式解释原因:___________ 。
(4)若将漂白液(有效成分NaClO)与洁厕灵(主要成分是盐酸)混合使用,则会产生有毒气体,其反应的离子方程式是___________ 。
(5)有效氯是漂白粉中有效成分Ca(ClO)2含量大小的标志。
已知:①Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O;
②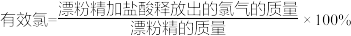 。
。
若某漂粉精的有效氯为60%,该漂粉精中Ca(ClO)2的质量分数为___________ (计算结果保留一位小数)。
 和碱制漂白粉、漂粉精及漂白液。请回答下列问题:
和碱制漂白粉、漂粉精及漂白液。请回答下列问题:(1) Ca(ClO)2中Cl元素的化合价是
(2)下列物质露置在空气中会变质,在变质过程中既有非氧化还原反应发生,又有氧化还原反应发生的是___________(填字母)。
| A.生石灰 | B.漂白粉 |
| C.NaOH | D. |
(4)若将漂白液(有效成分NaClO)与洁厕灵(主要成分是盐酸)混合使用,则会产生有毒气体,其反应的离子方程式是
(5)有效氯是漂白粉中有效成分Ca(ClO)2含量大小的标志。
已知:①Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O;
②
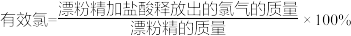 。
。若某漂粉精的有效氯为60%,该漂粉精中Ca(ClO)2的质量分数为
您最近一年使用:0次
名校
解题方法
3 . 某铝合金(硬铝)中含有铝、镁、铜、硅,为了测定该合金中铝的含量,有人设计了如下实验:

(1)补全上述①②④各步反应的离子方程式:
①Mg+2H+═Mg2++H2↑,_______ ;
②_______ ,_______ ,Mg2++2OH-═Mg(OH)2↓;
③OH﹣+CO2= ,CO2+2H2O+AlO
,CO2+2H2O+AlO ═Al(OH)3↓+
═Al(OH)3↓+  ;
;
④_______ 。
(2)该样品中铝的质量分数是_______ 。
(3)第②步中加入NaOH溶液不足时,会使测定结果_______ (填“偏高”、“ 偏低”、“无影响”,下同);第④步中的沉淀没有用蒸馏水洗涤时,会使测定结果_______ ;第④步对沉淀灼烧不充分时,会使测定结果_______ 。

(1)补全上述①②④各步反应的离子方程式:
①Mg+2H+═Mg2++H2↑,
②
③OH﹣+CO2=
 ,CO2+2H2O+AlO
,CO2+2H2O+AlO ═Al(OH)3↓+
═Al(OH)3↓+  ;
;④
(2)该样品中铝的质量分数是
(3)第②步中加入NaOH溶液不足时,会使测定结果
您最近一年使用:0次
名校
4 . 大苏打 、苏打、小苏打被称为“苏氏三兄弟”。它们在生活、生产中有广泛应用。
、苏打、小苏打被称为“苏氏三兄弟”。它们在生活、生产中有广泛应用。
(1)工业上,将 和
和 以
以 的物质的量之比配成溶液。再通入
的物质的量之比配成溶液。再通入 可制取
可制取 ,同时放出
,同时放出 ,写出该反应的化学方程
,写出该反应的化学方程___________ 。 溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过氧化钠相似的结构,该物质的电子式为
溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过氧化钠相似的结构,该物质的电子式为___________ 。
(2) 标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高。用离子方程式表示其原因
标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高。用离子方程式表示其原因___________ 。
(3)下列关于苏打和小苏打的说法正确的是___________ (选填字母序号)。
A.纯碱是一种重要的化工原料,在玻璃、肥皂、造纸等工业中都有重要的应用
B.苏打和小苏打的相互转化属于可逆反应
C.苏打(含氯化钠杂质)可用滴定法测苏打的质量分数,使用石蕊溶液做指示剂更准确
D.牙膏中加入小苏打可以让小苏打颗粒直接摩擦牙齿,帮助清洁牙垢
(4)向 的氢氧化钠溶液中通入一定量的二氧化碳,充分反应后再向溶液中逐滴滴入
的氢氧化钠溶液中通入一定量的二氧化碳,充分反应后再向溶液中逐滴滴入 的稀盐酸,产生气体体积(标况)如图所示。
的稀盐酸,产生气体体积(标况)如图所示。

请回答下列问题
①通入二氧化碳后形成溶液的溶质成分是___________ (填写化学式)
②滴入 稀盐酸过程中,溶液导电性
稀盐酸过程中,溶液导电性___________ (填“增强”或“减弱”),试解释其原因___________ 。
③原 氢氧化钠溶液的浓度为
氢氧化钠溶液的浓度为___________ 。
 、苏打、小苏打被称为“苏氏三兄弟”。它们在生活、生产中有广泛应用。
、苏打、小苏打被称为“苏氏三兄弟”。它们在生活、生产中有广泛应用。(1)工业上,将
 和
和 以
以 的物质的量之比配成溶液。再通入
的物质的量之比配成溶液。再通入 可制取
可制取 ,同时放出
,同时放出 ,写出该反应的化学方程
,写出该反应的化学方程 溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过氧化钠相似的结构,该物质的电子式为
溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过氧化钠相似的结构,该物质的电子式为(2)
 标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高。用离子方程式表示其原因
标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高。用离子方程式表示其原因(3)下列关于苏打和小苏打的说法正确的是
A.纯碱是一种重要的化工原料,在玻璃、肥皂、造纸等工业中都有重要的应用
B.苏打和小苏打的相互转化属于可逆反应
C.苏打(含氯化钠杂质)可用滴定法测苏打的质量分数,使用石蕊溶液做指示剂更准确
D.牙膏中加入小苏打可以让小苏打颗粒直接摩擦牙齿,帮助清洁牙垢
(4)向
 的氢氧化钠溶液中通入一定量的二氧化碳,充分反应后再向溶液中逐滴滴入
的氢氧化钠溶液中通入一定量的二氧化碳,充分反应后再向溶液中逐滴滴入 的稀盐酸,产生气体体积(标况)如图所示。
的稀盐酸,产生气体体积(标况)如图所示。
请回答下列问题
①通入二氧化碳后形成溶液的溶质成分是
②滴入
 稀盐酸过程中,溶液导电性
稀盐酸过程中,溶液导电性③原
 氢氧化钠溶液的浓度为
氢氧化钠溶液的浓度为
您最近一年使用:0次
2021-02-09更新
|
1019次组卷
|
7卷引用:河北省武安市第一中学2021-2022学年高三上学期第五次调研考试化学试题
河北省武安市第一中学2021-2022学年高三上学期第五次调研考试化学试题河南省信阳市2021届高三上学期第二次教学质量检测化学试题(已下线)专题06 钠及其化合物(限时精练)-2022届高考化学一轮复习热点题型归纳与变式训练(已下线)第07讲 钠及其重要化合物(精练)-2022年高考化学一轮复习讲练测(已下线)第07讲 钠及其重要化合物(练)-2023年高考化学一轮复习讲练测(全国通用)新疆维吾尔自治区伊犁哈萨克自治州新源县第二中学2021-2022学年上学期高三第一次月考化学试题(已下线)第1讲 钠及其重要化合物
5 . (1)一定温度下,向1 L 0.1mol·L-1CH3COOH溶液中加入0.1molCH3COONa固体,溶液中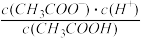
__________________ (填“增大”、“减小”或“不变”)。
(2)常温下,将VmL、0.1000mol·L-1氢氧化钠溶液逐滴加入到20.00mL、0.1000mol·L-1醋酸溶液中,充分反应。回答下列问题。(忽略溶液体积的变化)
① 如果溶液pH=7,此时V的取值___________ 20.00(填“>”、“<”或“=”),而溶液中c(Na+)、c(CH3COO-)、c(H+)、c(OH-)的大小关系为___________________ 。
② 如果V=40.00,则此时溶液中c(OH-)-c(H+)-c(CH3COOH)=_________ mol·L-1。
(3)常温下,向20 ml 0.1mol·L-1Na2CO3溶液中逐滴加入0.1mol·L-1HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的情况如下图,回答下列问题:

① 若将Na2CO3和NaHCO3混合物配成溶液,则此溶液的pH的取值范围是________________ ;为测定Na2CO3和NaHCO3混合物中Na2CO3的质量分数,下列方案可行的是_________________
A.取a克混合物充分加热,减重b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体
② 所得溶液中含量最多的三种离子的物质的量浓度的大小关系为_________________
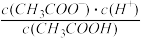
(2)常温下,将VmL、0.1000mol·L-1氢氧化钠溶液逐滴加入到20.00mL、0.1000mol·L-1醋酸溶液中,充分反应。回答下列问题。(忽略溶液体积的变化)
① 如果溶液pH=7,此时V的取值
② 如果V=40.00,则此时溶液中c(OH-)-c(H+)-c(CH3COOH)=
(3)常温下,向20 ml 0.1mol·L-1Na2CO3溶液中逐滴加入0.1mol·L-1HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的情况如下图,回答下列问题:

① 若将Na2CO3和NaHCO3混合物配成溶液,则此溶液的pH的取值范围是
A.取a克混合物充分加热,减重b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体
② 所得溶液中含量最多的三种离子的物质的量浓度的大小关系为
您最近一年使用:0次
2016-12-09更新
|
792次组卷
|
3卷引用:【全国百强校】河北省武邑中学2019届高三上学期期中考试化学试题
2013·河北石家庄·一模
6 . 许多硫的含氧酸盐在医药、化工等方面有着重要的用途。
(1)重晶石(BaSO4)常做胃肠道造影剂。
已知:常温下,Ksp(BaSO4)=1.1×10-10。向BaSO4悬浊液中加入硫酸,当溶液的pH=2时,溶液中c(Ba2+)=_____ 。
(2)硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]常做分析剂。
①检验晶体中含有NH4+的方法为_______________ 。
②等物质的量浓度的四种稀溶液:
a.(NH4)2Fe(SO4)2 b.NH4HSO4
c.(NH4) 2SO4 d.(NH4)2SO3,
其中c(NH4+)由大到小的顺序为_____ (填选项字母)。
(3)过二硫酸钾(K2S2O8)常做强氧化剂,Na2S2O3常做还原剂。
①K2S2O8溶液与酸性MnSO4溶液混合,在催化剂作用下,可以观察到溶液变为紫色,该反应的离子方程式为_____ 。
②用铂做电极,电解H2SO4和K2SO4的混合溶液可以制备K2S2O8,其阳极的电极反应式为_____ ,电解过程中阴极附近溶液的pH将_____ (填“增大”“减小”或“不变”)。
③产品中K2S2O8的含量可用碘量法测定。操作步骤为称取0.3000 g产品于碘量瓶中,加50 mL水溶解;加入4.000 g KI固体(稍过量),振荡使其充分反应;加入适量醋酸溶液酸化,以_____ 为指示剂,用0.1000 mol·L-1 Na2S2O3标准液滴定至终点(已知:I2+2S2O32-=2I-+S4O62-)。重复2次,测得平均消耗标准液21.00 mL。该产品中K2S2O8的质量分数为(杂质不参加反应)_____ (列式并计算)。
(1)重晶石(BaSO4)常做胃肠道造影剂。
已知:常温下,Ksp(BaSO4)=1.1×10-10。向BaSO4悬浊液中加入硫酸,当溶液的pH=2时,溶液中c(Ba2+)=
(2)硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]常做分析剂。
①检验晶体中含有NH4+的方法为
②等物质的量浓度的四种稀溶液:
a.(NH4)2Fe(SO4)2 b.NH4HSO4
c.(NH4) 2SO4 d.(NH4)2SO3,
其中c(NH4+)由大到小的顺序为
(3)过二硫酸钾(K2S2O8)常做强氧化剂,Na2S2O3常做还原剂。
①K2S2O8溶液与酸性MnSO4溶液混合,在催化剂作用下,可以观察到溶液变为紫色,该反应的离子方程式为
②用铂做电极,电解H2SO4和K2SO4的混合溶液可以制备K2S2O8,其阳极的电极反应式为
③产品中K2S2O8的含量可用碘量法测定。操作步骤为称取0.3000 g产品于碘量瓶中,加50 mL水溶解;加入4.000 g KI固体(稍过量),振荡使其充分反应;加入适量醋酸溶液酸化,以
您最近一年使用:0次
名校
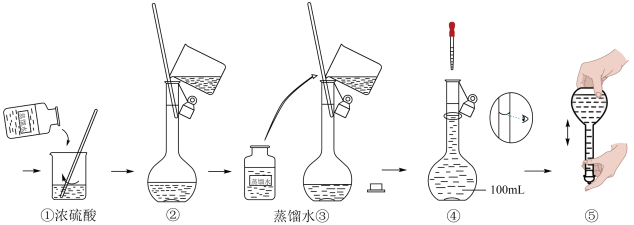
7 . 如图是硫酸试剂标签上的内容。
(1)该硫酸的物质的量浓度为_____ 。
(2)实验室用该硫酸配制 的稀硫酸,则
的稀硫酸,则
①需要用量筒量取该浓硫酸的体积为_____ mL。
②为完成实验,现有仪器:烧杯、10mL量筒、胶头滴管、玻璃棒,还必需的玻璃仪器有_____ 。
(3)下列操作中,容量瓶所具备的功能有_____。
(4)在下列配制过程示意图中,有错误的是(填写序号)_____ 。
(5)在定容操作时,因不慎加水至凹液面最低处超过了刻度线,该如何处理:_____ 。
(6)下列说法正确的是_____ 。
A.洗涤烧杯和玻璃棒2-3次,并将洗涤液移入容量瓶以减少误差
B.将浓硫酸稀释后未冷却至室温便将溶液转移至容量瓶,所配溶液浓度会偏低
C.定容时仰视观察,所配溶液浓度会偏低
D.容量瓶使用前先要检查是否漏液,具体操作是向容量瓶中加蒸馏水,倒置不漏液即可
E.容量瓶在使用前未干燥,里面有少量蒸馏水,所配溶液浓度会偏低
硫酸化学纯(CP) (500 mL) 品名:硫酸 化学式:H2SO4 相对分子质量:98 密度:1.84 g/cm3 质量分数:98% |
(1)该硫酸的物质的量浓度为
(2)实验室用该硫酸配制
 的稀硫酸,则
的稀硫酸,则①需要用量筒量取该浓硫酸的体积为
②为完成实验,现有仪器:烧杯、10mL量筒、胶头滴管、玻璃棒,还必需的玻璃仪器有
(3)下列操作中,容量瓶所具备的功能有_____。
| A.配制一定体积准确浓度的标准溶液 |
| B.长期贮存溶液 |
| C.用来溶解固体溶质 |
| D.常用来代替烧杯作为反应容器 |
(4)在下列配制过程示意图中,有错误的是(填写序号)

(5)在定容操作时,因不慎加水至凹液面最低处超过了刻度线,该如何处理:
(6)下列说法正确的是
A.洗涤烧杯和玻璃棒2-3次,并将洗涤液移入容量瓶以减少误差
B.将浓硫酸稀释后未冷却至室温便将溶液转移至容量瓶,所配溶液浓度会偏低
C.定容时仰视观察,所配溶液浓度会偏低
D.容量瓶使用前先要检查是否漏液,具体操作是向容量瓶中加蒸馏水,倒置不漏液即可
E.容量瓶在使用前未干燥,里面有少量蒸馏水,所配溶液浓度会偏低
您最近一年使用:0次
名校
解题方法
8 . 回答下列问题
(1)二氧化氯具有杀菌、漂白、除臭、消毒、保鲜的功能。电解法制取ClO2的新工艺如图所示。
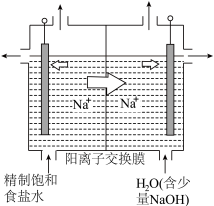
①用石墨作电极,在一定条件下电解饱和食盐水制取ClO2(如图所示),阳极产生ClO2的电极反应式为___________ 。
②电解一段时间,当阴极产生的气体体积为224mL(标准状况)时,停止电解,则通过阳离子交换膜的阳离子的物质的量为___________ mol。
(2)工业上用PbSiF6、H2SiF6混合溶液作电解液,用电解法实现粗铅(主要杂质为Cu、Ag、Fe、Zn,杂质总质量分数约为4%)提纯,装置示意图如图所示。
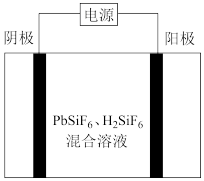
①阳极发生的主要电极反应式为:___________ 。
②电解产生的阳极泥的主要成分为___________ 。
③工作一段时间后,溶液中c(Pb2+)___________ (填“增大”“减小”或“不变”)。
(3)一种用于心脏起搏器的微型电池具有容量大、寿命长和电压稳定等特点。该电池的电极材料是石墨和锂,电解质溶液为等物质的量的LiCl、AlCl3溶解在SOCl2中形成的溶液。这种电池的总反应为8Li+3SOCl2=6LiCl+Li2SO3+2S
①锂电极的电势比石墨电极的___________ (填“低”或“高”)。
②放电时,石墨电极发生___________ (填“氧化”或“还原”)反应。
③电池的正极反应为___________ 。
(1)二氧化氯具有杀菌、漂白、除臭、消毒、保鲜的功能。电解法制取ClO2的新工艺如图所示。

①用石墨作电极,在一定条件下电解饱和食盐水制取ClO2(如图所示),阳极产生ClO2的电极反应式为
②电解一段时间,当阴极产生的气体体积为224mL(标准状况)时,停止电解,则通过阳离子交换膜的阳离子的物质的量为
(2)工业上用PbSiF6、H2SiF6混合溶液作电解液,用电解法实现粗铅(主要杂质为Cu、Ag、Fe、Zn,杂质总质量分数约为4%)提纯,装置示意图如图所示。

①阳极发生的主要电极反应式为:
②电解产生的阳极泥的主要成分为
③工作一段时间后,溶液中c(Pb2+)
(3)一种用于心脏起搏器的微型电池具有容量大、寿命长和电压稳定等特点。该电池的电极材料是石墨和锂,电解质溶液为等物质的量的LiCl、AlCl3溶解在SOCl2中形成的溶液。这种电池的总反应为8Li+3SOCl2=6LiCl+Li2SO3+2S
①锂电极的电势比石墨电极的
②放电时,石墨电极发生
③电池的正极反应为
您最近一年使用:0次
名校
9 . Ⅰ.X、Y、Z三种可溶性盐,其阳离子分别是 、
、 、
、 中的某一种,阴离子分别是
中的某一种,阴离子分别是 、
、 、
、 ,中的某一种。现进行以下实验:
,中的某一种。现进行以下实验:
①将三种盐各取少量,分别溶于盛有5mL蒸馏水的三支试管中,只有X盐溶液呈蓝色。
②分别向三支试管中加入2mL稀盐酸,发现Y盐溶液中产生白色沉淀,Z盐溶液无明显现象。
回答下列问题:
(1)根据上述事实,推断这三种盐的化学式:X_______ ,Y_______ ,Z_______ 。
(2)写出下列反应的离子方程式。
X与氢氧化钡溶液反应:_______ 。
Y与盐酸反应:_______ 。
Ⅱ.有关物质的量的计算
(3) 和
和 一定条件下可以发生反应
一定条件下可以发生反应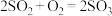 ,若有a mol
,若有a mol  与b mol
与b mol  充分反应,则反应后硫原子与氧原子的个数比为
充分反应,则反应后硫原子与氧原子的个数比为_______ (用含a、b的代数式表示)。
(4)36g CO与 的混合气体与足量
的混合气体与足量 充分反应后,将所得气体通入过量的澄清石灰水中,生成白色沉淀的质量为100g,则36g CO与
充分反应后,将所得气体通入过量的澄清石灰水中,生成白色沉淀的质量为100g,则36g CO与 的混合气体的总物质的量为
的混合气体的总物质的量为_______ mol,其中的CO在标准状况下的体积为_______ L。
(5)用质量分数为98%,密度为1.84g/mL的浓硫酸配制1mol/L的稀硫酸500mL,则需用量筒量取浓硫酸的体积为_______ 。
 、
、 、
、 中的某一种,阴离子分别是
中的某一种,阴离子分别是 、
、 、
、 ,中的某一种。现进行以下实验:
,中的某一种。现进行以下实验:①将三种盐各取少量,分别溶于盛有5mL蒸馏水的三支试管中,只有X盐溶液呈蓝色。
②分别向三支试管中加入2mL稀盐酸,发现Y盐溶液中产生白色沉淀,Z盐溶液无明显现象。
回答下列问题:
(1)根据上述事实,推断这三种盐的化学式:X
(2)写出下列反应的离子方程式。
X与氢氧化钡溶液反应:
Y与盐酸反应:
Ⅱ.有关物质的量的计算
(3)
 和
和 一定条件下可以发生反应
一定条件下可以发生反应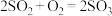 ,若有a mol
,若有a mol  与b mol
与b mol  充分反应,则反应后硫原子与氧原子的个数比为
充分反应,则反应后硫原子与氧原子的个数比为(4)36g CO与
 的混合气体与足量
的混合气体与足量 充分反应后,将所得气体通入过量的澄清石灰水中,生成白色沉淀的质量为100g,则36g CO与
充分反应后,将所得气体通入过量的澄清石灰水中,生成白色沉淀的质量为100g,则36g CO与 的混合气体的总物质的量为
的混合气体的总物质的量为(5)用质量分数为98%,密度为1.84g/mL的浓硫酸配制1mol/L的稀硫酸500mL,则需用量筒量取浓硫酸的体积为
您最近一年使用:0次
名校
解题方法
10 . 现有一份 溶液,向其中通入一定量
溶液,向其中通入一定量 ,得到一份混合溶液,为测定溶液的成分,某小组同学做了以下实验:
,得到一份混合溶液,为测定溶液的成分,某小组同学做了以下实验:
Ⅰ.配制 的标准盐酸
的标准盐酸
实验室现有密度为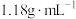 ,质量分数为36.5%的浓盐酸,若要配制
,质量分数为36.5%的浓盐酸,若要配制 标准盐酸,据此回答下列问题:
标准盐酸,据此回答下列问题:
(1)该浓盐酸的物质的量浓度为_____  ;应选用的容量瓶的规格为
;应选用的容量瓶的规格为_____ 。
(2)在配制稀盐酸溶液时,有如下操作,正确的操作顺序是_____ 。
A.用量筒量取浓盐酸注入烧杯中,再向烧杯中加入少量蒸馏水,慢慢搅动,使其混合均匀
B.用蒸馏水洗涤烧杯内壁及玻璃棒仪器各2~3次,将洗涤液全部注入容量瓶中,轻轻摇动容量瓶
C.盖好瓶塞,反复上下颠倒摇匀
D.将已恢复至室温的盐酸转移注入所选用的容量瓶中
E.用胶头滴管滴加蒸馏水,使溶液的凹液面恰好与容量瓶上的刻度线相切
F.继续往容量瓶中加蒸馏水,直到液面接近瓶颈上的刻度线1~2cm处
(3)若是定容时俯视容量瓶瓶颈上的刻度线会使所配制的溶液浓度_____ (填“偏低”“偏高”“无影响”,下同);容量瓶用蒸馏水洗净后,没烘干直接使用对实验的结果_____ 。
Ⅱ、测定混合溶液成分
向混合溶液中滴入上述配制的稀盐酸,滴入盐酸体积与产生气体体积(标准状况)如图所示:
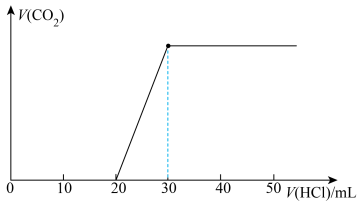
(4)混合溶液的溶质为_____ (填化学式)。
(5)原 溶液的物质的量浓度为
溶液的物质的量浓度为_____ 。
 溶液,向其中通入一定量
溶液,向其中通入一定量 ,得到一份混合溶液,为测定溶液的成分,某小组同学做了以下实验:
,得到一份混合溶液,为测定溶液的成分,某小组同学做了以下实验:Ⅰ.配制
 的标准盐酸
的标准盐酸实验室现有密度为
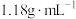 ,质量分数为36.5%的浓盐酸,若要配制
,质量分数为36.5%的浓盐酸,若要配制 标准盐酸,据此回答下列问题:
标准盐酸,据此回答下列问题:(1)该浓盐酸的物质的量浓度为
 ;应选用的容量瓶的规格为
;应选用的容量瓶的规格为(2)在配制稀盐酸溶液时,有如下操作,正确的操作顺序是
A.用量筒量取浓盐酸注入烧杯中,再向烧杯中加入少量蒸馏水,慢慢搅动,使其混合均匀
B.用蒸馏水洗涤烧杯内壁及玻璃棒仪器各2~3次,将洗涤液全部注入容量瓶中,轻轻摇动容量瓶
C.盖好瓶塞,反复上下颠倒摇匀
D.将已恢复至室温的盐酸转移注入所选用的容量瓶中
E.用胶头滴管滴加蒸馏水,使溶液的凹液面恰好与容量瓶上的刻度线相切
F.继续往容量瓶中加蒸馏水,直到液面接近瓶颈上的刻度线1~2cm处
(3)若是定容时俯视容量瓶瓶颈上的刻度线会使所配制的溶液浓度
Ⅱ、测定混合溶液成分
向混合溶液中滴入上述配制的稀盐酸,滴入盐酸体积与产生气体体积(标准状况)如图所示:

(4)混合溶液的溶质为
(5)原
 溶液的物质的量浓度为
溶液的物质的量浓度为
您最近一年使用:0次



