名校
1 . 铜是生物必需的微量元素,也是人类最早使用的金属之一。铜的生产和使用对国计民生各个方面都产生了深远的影响。
(1)写出铜与稀硝酸反应的化学方程式_____________________________ 。
(2)为了保护环境和节约资源,通常先用 和稀硫酸的混合溶液溶出废旧卬刷电路板中的铜,最终实现铜的回收利用,写出溶出铜的离子方程式
和稀硫酸的混合溶液溶出废旧卬刷电路板中的铜,最终实现铜的回收利用,写出溶出铜的离子方程式__________________________ 。
(3)工业上以黄铜矿为原料,采用火法溶炼工艺生产铜,该工艺的中间过程会发生反应: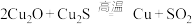 ,该反应的氧化剂是
,该反应的氧化剂是________ ;当生成 时,反应中转移的电子为
时,反应中转移的电子为______  。
。
(4)研究性学习小组用“间接碘量法”测定某试样中 (不含能与I-反应的氧化性杂质)的含量,取
(不含能与I-反应的氧化性杂质)的含量,取 试样配成
试样配成 溶液,每次取
溶液,每次取 ,滴加
,滴加 溶液后有白色碘化物沉淀生成,写出该反应的离子方程式
溶液后有白色碘化物沉淀生成,写出该反应的离子方程式__________________________ 。
(5)继续滴加KI溶液至沉淀不再产生,溶液中的I2用硫化硫酸钠标准溶液滴定,发生反应的化学方程式为: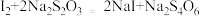 ,平均消耗
,平均消耗 的
的 溶液
溶液 。则试样中
。则试样中 的质量分数为
的质量分数为______________________ 。
(1)写出铜与稀硝酸反应的化学方程式
(2)为了保护环境和节约资源,通常先用
 和稀硫酸的混合溶液溶出废旧卬刷电路板中的铜,最终实现铜的回收利用,写出溶出铜的离子方程式
和稀硫酸的混合溶液溶出废旧卬刷电路板中的铜,最终实现铜的回收利用,写出溶出铜的离子方程式(3)工业上以黄铜矿为原料,采用火法溶炼工艺生产铜,该工艺的中间过程会发生反应:
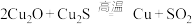 ,该反应的氧化剂是
,该反应的氧化剂是 时,反应中转移的电子为
时,反应中转移的电子为 。
。(4)研究性学习小组用“间接碘量法”测定某试样中
 (不含能与I-反应的氧化性杂质)的含量,取
(不含能与I-反应的氧化性杂质)的含量,取 试样配成
试样配成 溶液,每次取
溶液,每次取 ,滴加
,滴加 溶液后有白色碘化物沉淀生成,写出该反应的离子方程式
溶液后有白色碘化物沉淀生成,写出该反应的离子方程式(5)继续滴加KI溶液至沉淀不再产生,溶液中的I2用硫化硫酸钠标准溶液滴定,发生反应的化学方程式为:
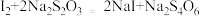 ,平均消耗
,平均消耗 的
的 溶液
溶液 。则试样中
。则试样中 的质量分数为
的质量分数为
您最近一年使用:0次
2020-04-29更新
|
125次组卷
|
2卷引用:天津市滨海新区塘沽一中2020届高三第一次月考
2 . 已知: ①亚硝酸钠(NaNO2)是一种食品添加剂,为无色、无气味的同体,具有防腐和抗氧化作用。②AgNO2 是一种微溶于水、易溶于酸的浅黄色固体。
I.问题探究
(1)人体正常的血红蛋白中应含Fe2+,误食亚硝酸盐(如NaNO2)会致使机体组织缺氧,出现青紫而中毒,原因是___________ 。若发生中毒时,你认为下列物质有助于解毒的是____ (填字母)。
A.牛奶 B.Mg(OH)2 C.维生素C D.小苏打
(2)由于亚硝酸钠和食盐性状相似,曾多次发生过将NaNO2误当食盐食用的事件。要区别NaNO2和NaCl 两种固体,你需用的试剂是_______________ 。
II.实验测定
为了测定某样品中NaNO2的含量,某同学进行如下实验:
①称取样品ag,加水溶解,配制成100 mL 溶液。
②取25.00mL 溶液于锥形瓶中,用0.0200mol/LKMnO4标准溶液(酸性)进行滴定,滴定结束后消耗KMnO4溶液VmL。
(1)上述实验①所需玻璃仪器除玻璃棒、胶头滴管之外还有________ 。
(2)在进行滴定操作时,KMnO4溶液盛装在______ (填“酸式”或“碱式”)滴定管中。当滴入最后一滴溶液,________ 时达到滴定终点。
(3) 滴定过程中发生反应的离子方程式是________ ;测得该样品中NaNO2的质量分数为_____ 。
(4)若滴定管未用KMnO4标准溶液润洗就直接注入,则测定结果______ (填“偏大”、“偏小”或“无影响”,下同);若滴定过程中刚出现颜色变化就停止滴定,则测定结果________ 。
I.问题探究
(1)人体正常的血红蛋白中应含Fe2+,误食亚硝酸盐(如NaNO2)会致使机体组织缺氧,出现青紫而中毒,原因是
A.牛奶 B.Mg(OH)2 C.维生素C D.小苏打
(2)由于亚硝酸钠和食盐性状相似,曾多次发生过将NaNO2误当食盐食用的事件。要区别NaNO2和NaCl 两种固体,你需用的试剂是
II.实验测定
为了测定某样品中NaNO2的含量,某同学进行如下实验:
①称取样品ag,加水溶解,配制成100 mL 溶液。
②取25.00mL 溶液于锥形瓶中,用0.0200mol/LKMnO4标准溶液(酸性)进行滴定,滴定结束后消耗KMnO4溶液VmL。
(1)上述实验①所需玻璃仪器除玻璃棒、胶头滴管之外还有
(2)在进行滴定操作时,KMnO4溶液盛装在
(3) 滴定过程中发生反应的离子方程式是
(4)若滴定管未用KMnO4标准溶液润洗就直接注入,则测定结果
您最近一年使用:0次
3 . X、Y、Z、W、L、M六种短周期主族元素的原子序数依次增大,其中X、M的单质在常温下呈气态,Y的原子最外层电子数是其电子层数的2倍,Z在同周期的主族元素中原子半径最大,W是地壳中含量最多的金属元素,L的单质晶体熔点高、硬度大,是一种重要的半导体材料.用化学用语回答下列问题:
(1)M的离子结构示意图__________ ;L在元素周期表中的位置为__________ .
(2)Y、L、M的最高价含氧酸的酸性由弱到强的顺序是_______________ .
(3)Y的最高价氧化物的电子式为___________ .原子序数比Y多2的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是_______________ .
(4)Z、W各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为________ .
(5)R与Y同周期,R的单质分子R2中有3个共价键,R与X形成化合物甲,1mol甲含18mol电子,请写出甲的结构式____________ .
(6)用亚硝酸氧化化合物甲,可生成氮的另一种氢化物,该氢化物的相对分子质量为43,其中氮原子的质量分数为97.7%,该氢化物的分子式为________ .该氢化物受撞击时完全分解为氮气和氢气,则2.15g该氢化物受撞击后产生的气体在标况下的体积为_________ L.
(1)M的离子结构示意图
(2)Y、L、M的最高价含氧酸的酸性由弱到强的顺序是
(3)Y的最高价氧化物的电子式为
(4)Z、W各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为
(5)R与Y同周期,R的单质分子R2中有3个共价键,R与X形成化合物甲,1mol甲含18mol电子,请写出甲的结构式
(6)用亚硝酸氧化化合物甲,可生成氮的另一种氢化物,该氢化物的相对分子质量为43,其中氮原子的质量分数为97.7%,该氢化物的分子式为
您最近一年使用:0次
名校
解题方法
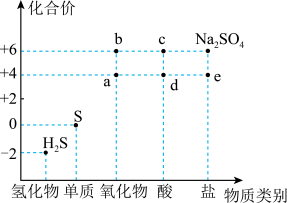
4 . 如图是硫元素的常见化合价与部分物质类别的对应关系。回答下列问题:_____ ,体现了c的_____ 性。
(2)仅从硫元素化合价变化的角度分析,图中只有还原性的物质是_____ (填化学式)。
(3)将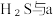 混合可生成淡黄色沉淀,该反应中氧化产物与还原产物的物质的量之比为
混合可生成淡黄色沉淀,该反应中氧化产物与还原产物的物质的量之比为_____ 。
(4)配平下列反应:_____ 。
_____
(5)为防止多余的a气体污染环境,应将尾气通入_____ 溶液中;
(6)将足量的 溶液中,下列说法正确的是
溶液中,下列说法正确的是_____ (填字母)。
A.溶液中出现白色沉淀
B.溶液没有明显变化
C.若再通入 ,则溶液中均会出现白色沉淀
,则溶液中均会出现白色沉淀

(7)将 片浸在不同质量分数的c溶液中,经4小时腐蚀后的质量损失情况如图所示,当c的浓度大于63%时,
片浸在不同质量分数的c溶液中,经4小时腐蚀后的质量损失情况如图所示,当c的浓度大于63%时, 被腐蚀的速率逐渐降低的可能原因为
被腐蚀的速率逐渐降低的可能原因为_____ 。 的污染并变废为宝,我国正在探索在一定条件下,用
的污染并变废为宝,我国正在探索在一定条件下,用 还原,
还原, 得到单质硫的方法来除去
得到单质硫的方法来除去 。写出该反应的化学方程式:
。写出该反应的化学方程式:_____ 。
(2)仅从硫元素化合价变化的角度分析,图中只有还原性的物质是
(3)将
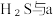 混合可生成淡黄色沉淀,该反应中氧化产物与还原产物的物质的量之比为
混合可生成淡黄色沉淀,该反应中氧化产物与还原产物的物质的量之比为(4)配平下列反应:
_____

(5)为防止多余的a气体污染环境,应将尾气通入
(6)将足量的
 溶液中,下列说法正确的是
溶液中,下列说法正确的是A.溶液中出现白色沉淀
B.溶液没有明显变化
C.若再通入
 ,则溶液中均会出现白色沉淀
,则溶液中均会出现白色沉淀
(7)将
 片浸在不同质量分数的c溶液中,经4小时腐蚀后的质量损失情况如图所示,当c的浓度大于63%时,
片浸在不同质量分数的c溶液中,经4小时腐蚀后的质量损失情况如图所示,当c的浓度大于63%时, 被腐蚀的速率逐渐降低的可能原因为
被腐蚀的速率逐渐降低的可能原因为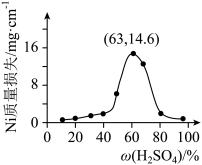
 的污染并变废为宝,我国正在探索在一定条件下,用
的污染并变废为宝,我国正在探索在一定条件下,用 还原,
还原, 得到单质硫的方法来除去
得到单质硫的方法来除去 。写出该反应的化学方程式:
。写出该反应的化学方程式:
您最近一年使用:0次
名校
5 . Ⅰ.700℃时,若向2L恒容的密闭容器中充入一定量N2和CO2发生反应:N2(g)+CO2(g) C(s)+2NO(g);其中N2、NO物质的量随时间变化的曲线如图所示。
C(s)+2NO(g);其中N2、NO物质的量随时间变化的曲线如图所示。

(1)0~10min 内的 CO2平均反应速率v( CO2)=___________
(2)图中A点v正___________ v逆(填“>”“<”或“=”)。
(3)下列叙述中能说明上述反应达到平衡状态的是___________ 。
A.反应中CO2与N2的物质的量之比为1∶1
B.混合气体的总物质的量不随时间的变化而变化
C.单位时间内每消耗a mol N2,同时消耗2a mol NO
D.N2的质量分数在混合气体中保持不变
E.混合气体的密度不随时间的变化而变化
Ⅱ.氢氧燃料电池的电解质溶液为KOH溶液,电池总反应为2H2+O2=2H2O。回答下列问题:
(4)该电池的负极反应式为___________ 。
(5)电池工作一段时间后电解质溶液的
___________ (填“增大”“减小”或“不变”)。
 C(s)+2NO(g);其中N2、NO物质的量随时间变化的曲线如图所示。
C(s)+2NO(g);其中N2、NO物质的量随时间变化的曲线如图所示。
(1)0~10min 内的 CO2平均反应速率v( CO2)=
(2)图中A点v正
(3)下列叙述中能说明上述反应达到平衡状态的是
A.反应中CO2与N2的物质的量之比为1∶1
B.混合气体的总物质的量不随时间的变化而变化
C.单位时间内每消耗a mol N2,同时消耗2a mol NO
D.N2的质量分数在混合气体中保持不变
E.混合气体的密度不随时间的变化而变化
Ⅱ.氢氧燃料电池的电解质溶液为KOH溶液,电池总反应为2H2+O2=2H2O。回答下列问题:
(4)该电池的负极反应式为
(5)电池工作一段时间后电解质溶液的

您最近一年使用:0次
名校
6 . 用现代分析仪器测定 粒子的大小。用氧化还原滴定法测定
粒子的大小。用氧化还原滴定法测定 的质量分数:一定条件下,将
的质量分数:一定条件下,将 溶解并还原为
溶解并还原为 ,再以KSCN溶液作指示剂,用
,再以KSCN溶液作指示剂,用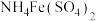 标准溶液滴定
标准溶液滴定 至全部生成
至全部生成 。
。
(1)滴定终点颜色变化为___________ 。
(2)滴定分析时,称取 (摩尔质量为Mg/mol)试样wg,消耗cmol/L
(摩尔质量为Mg/mol)试样wg,消耗cmol/L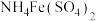 标准溶液VmL,则
标准溶液VmL,则 质量分数表达式为
质量分数表达式为___________ 。
(3)下列操作对 质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)
质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)
①若在配制标准溶液过程中,烧杯中的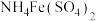 溶液有少量溅出,使测定结果
溶液有少量溅出,使测定结果___________ 。
②若在滴定开始滴定管尖嘴处无气泡,滴定后滴定管尖嘴产生气泡,则测定结果___________ 。
 粒子的大小。用氧化还原滴定法测定
粒子的大小。用氧化还原滴定法测定 的质量分数:一定条件下,将
的质量分数:一定条件下,将 溶解并还原为
溶解并还原为 ,再以KSCN溶液作指示剂,用
,再以KSCN溶液作指示剂,用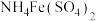 标准溶液滴定
标准溶液滴定 至全部生成
至全部生成 。
。(1)滴定终点颜色变化为
(2)滴定分析时,称取
 (摩尔质量为Mg/mol)试样wg,消耗cmol/L
(摩尔质量为Mg/mol)试样wg,消耗cmol/L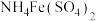 标准溶液VmL,则
标准溶液VmL,则 质量分数表达式为
质量分数表达式为(3)下列操作对
 质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)
质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)①若在配制标准溶液过程中,烧杯中的
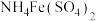 溶液有少量溅出,使测定结果
溶液有少量溅出,使测定结果②若在滴定开始滴定管尖嘴处无气泡,滴定后滴定管尖嘴产生气泡,则测定结果
您最近一年使用:0次
2023-12-20更新
|
93次组卷
|
2卷引用:天津市第四十七中学2023-2024学年高二上学期12月月考化学试题
7 . 硫及其化合物在工业上有广泛的用途。回答下列问题:
(1)硫是一种黄色晶体,化学性质比较活泼,能与许多金属单质反应,硫与铜在加热条件下反应的产物为_______ 。
(2)不同价态含硫物质在一定条件下能够相互转化,标准状况下11.2 LH2S与足量SO2反应,转移的电子数为_______ ,H2S分子中化学键的类型为_______ (填 “离子键”、“极性共价键”或“非极性共价键”)。
(3)黄铁矿(FeS2)是工业上制硫酸的重要原料,在氧气中煅烧生成Fe2O3和SO2,其煅烧的化学方程式为_______ 。
(4)在实验室中,几位同学围绕浓硫酸的化学性质进行了如下实验探究:将适量的蔗糖放入烧杯中,加入几滴水,搅拌均匀;然后再加入适量浓硫酸,迅速搅拌。
①可以观察到的现象为_______ 。
②上述实验现象表明浓硫酸具有_______ (填字母)。
a.酸性 b.吸水性 c.脱水性 d.强氧化性
(5)二氧化硫及其在大气中发生反应后的生成物溶于水会形成酸雨。简述证明酸雨中含有硫酸根的实验操作步骤:_______ 。
(6)某工厂每天燃烧含硫质量分数为0.64%的煤100 t,如果煤中的硫全部转化为SO2,且产生的SO2全部用来生产硫酸,理论上每年(按365天计)可得到98%的浓硫酸的质量为_______ 。
(1)硫是一种黄色晶体,化学性质比较活泼,能与许多金属单质反应,硫与铜在加热条件下反应的产物为
(2)不同价态含硫物质在一定条件下能够相互转化,标准状况下11.2 LH2S与足量SO2反应,转移的电子数为
(3)黄铁矿(FeS2)是工业上制硫酸的重要原料,在氧气中煅烧生成Fe2O3和SO2,其煅烧的化学方程式为
(4)在实验室中,几位同学围绕浓硫酸的化学性质进行了如下实验探究:将适量的蔗糖放入烧杯中,加入几滴水,搅拌均匀;然后再加入适量浓硫酸,迅速搅拌。
①可以观察到的现象为
②上述实验现象表明浓硫酸具有
a.酸性 b.吸水性 c.脱水性 d.强氧化性
(5)二氧化硫及其在大气中发生反应后的生成物溶于水会形成酸雨。简述证明酸雨中含有硫酸根的实验操作步骤:
(6)某工厂每天燃烧含硫质量分数为0.64%的煤100 t,如果煤中的硫全部转化为SO2,且产生的SO2全部用来生产硫酸,理论上每年(按365天计)可得到98%的浓硫酸的质量为
您最近一年使用:0次
名校
8 . 现有反应aA(g)+bB(g) pC(g),达到平衡后,当升高温度时,B的浓度减小;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的浓度减小;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应是___________ 热反应,且a+b___________ p(填“>”“<”或“=”)。
(2)减压时,A的质量分数___________ (填“增大”“减小”或“不变”,下同),正反应速率___________ 。
(3)若降低温度,则平衡时,B、C的浓度之比c(B)/c(C) 将___________ 。
(4)若加入催化剂,平衡时气体混合物的总物质的量___________ 。
(5)若B是有色物质,A、C均为无色物质,则加入C(体积不变)时混合物的颜色___________ ,而维持容器内气体的压强不变,充入氖气时,混合物的颜色___________ 。(填“变浅”“变深”或“不变”)
 pC(g),达到平衡后,当升高温度时,B的浓度减小;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的浓度减小;当减小压强时,混合体系中C的质量分数也减小,则:(1)该反应是
(2)减压时,A的质量分数
(3)若降低温度,则平衡时,B、C的浓度之比c(B)/c(C) 将
(4)若加入催化剂,平衡时气体混合物的总物质的量
(5)若B是有色物质,A、C均为无色物质,则加入C(体积不变)时混合物的颜色
您最近一年使用:0次
名校
解题方法
9 . 按要求回答下列问题:
(1)已知氧化性:Cl2>Br2>Fe3+。向200mLcmol·L-1FeBr2溶液中逐渐通入Cl2,其中n(Fe2+)、n(Br-)随通入Cl2的物质的量[n(Cl2)]变化如图所示:

①曲线①为___________ ,c=___________ ;
②n(Cl2)=0.35 mol时,溶液中c(Fe3+)___________ c(Br-) (填“>”、“<”或“=”);
③n(Cl2)=0.45 mol时,总的离子方程式为___________ 。
(2)实验测得Fe2(SO4)3、CuSO4的混合溶液中,n(Fe3+): n(Cu2+)=1:2,n(Fe3+)=0.1mol/L。则c(SO )为
)为___________ mol/L。
(3)70%的硫酸与等体积的水混合后,所得溶液的质量分数___________ 35%。
(1)已知氧化性:Cl2>Br2>Fe3+。向200mLcmol·L-1FeBr2溶液中逐渐通入Cl2,其中n(Fe2+)、n(Br-)随通入Cl2的物质的量[n(Cl2)]变化如图所示:

①曲线①为
②n(Cl2)=0.35 mol时,溶液中c(Fe3+)
③n(Cl2)=0.45 mol时,总的离子方程式为
(2)实验测得Fe2(SO4)3、CuSO4的混合溶液中,n(Fe3+): n(Cu2+)=1:2,n(Fe3+)=0.1mol/L。则c(SO
 )为
)为(3)70%的硫酸与等体积的水混合后,所得溶液的质量分数
您最近一年使用:0次
10 . 利用物质类别及核心元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系。回答下列问题:

(1)质量相同的a和b的物质的量之比为_______ 。
(2)c的浓溶液能与S反应产生一种含硫元素的气体,该气体的化学式为_______ 。
(3)将足量的a通入 溶液中,下列说法正确的是
溶液中,下列说法正确的是_______ (填字母)。
A.溶液中出现白色沉淀
B.溶液没有明显变化
C.若再通入 或
或 ,则溶液中均会出现白色沉淀
,则溶液中均会出现白色沉淀
(4)将c的浓溶液滴到白纸上,白纸变黑体现了c的_______ 性。
(5)将Ni片浸在不同质量分数的c溶液中,经4小时腐蚀后的质量损失情况如图所示,当c的浓度大于63%时,Ni被腐蚀的速率逐渐降低的可能原因为_______ 。

(6)“银针验毒”的原理: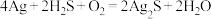 。
。 在该反应中_______(填字母)。
在该反应中_______(填字母)。
(7)为进一步减少 的污染并变废为宝,我国正在探索在一定条件下,用CO还原
的污染并变废为宝,我国正在探索在一定条件下,用CO还原 得到单质硫的方法来除去
得到单质硫的方法来除去 。写出该反应的化学方程式:
。写出该反应的化学方程式:_______ 。

(1)质量相同的a和b的物质的量之比为
(2)c的浓溶液能与S反应产生一种含硫元素的气体,该气体的化学式为
(3)将足量的a通入
 溶液中,下列说法正确的是
溶液中,下列说法正确的是A.溶液中出现白色沉淀
B.溶液没有明显变化
C.若再通入
 或
或 ,则溶液中均会出现白色沉淀
,则溶液中均会出现白色沉淀(4)将c的浓溶液滴到白纸上,白纸变黑体现了c的
(5)将Ni片浸在不同质量分数的c溶液中,经4小时腐蚀后的质量损失情况如图所示,当c的浓度大于63%时,Ni被腐蚀的速率逐渐降低的可能原因为

(6)“银针验毒”的原理:
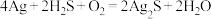 。
。 在该反应中_______(填字母)。
在该反应中_______(填字母)。| A.是氧化剂 | B.是还原剂 |
| C.既是氧化剂也是还原剂 | D.既不是氧化剂也不是还原剂 |
 的污染并变废为宝,我国正在探索在一定条件下,用CO还原
的污染并变废为宝,我国正在探索在一定条件下,用CO还原 得到单质硫的方法来除去
得到单质硫的方法来除去 。写出该反应的化学方程式:
。写出该反应的化学方程式:
您最近一年使用:0次
2023-03-27更新
|
192次组卷
|
2卷引用:天津市西青区杨柳青一中2022-2023学年高一下学期第一次适应性测试化学试题



