1 . 利用物质的结构与性质对周期表进行研究,有助于我们更好地掌握同类知识。
I.2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。
(1)In在周期表中的位置是_______ 。
(2)In的最高价氧化物对应的水化物的碱性_______ Ba(OH)2的碱性(填“>”或“<”)。
(3)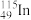 的中子数与电子数的差值为
的中子数与电子数的差值为_______ 。
II.硒(34Se)是动物和人体所必需的微量元素之一,也是重要的工业原料,与氧同族。
(4)Se原子结构示意图可表示为_______ 。
(5)下列说法合理的是_______ 。
a.SeO2既有氧化性又有还原性 b.沸点:H2O < H2S < H2Se
c.热稳定性:H2Se<HCl<H2S d.酸性:H2SeO4<HBrO4<HClO4
I.2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。
(1)In在周期表中的位置是
(2)In的最高价氧化物对应的水化物的碱性
(3)
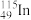 的中子数与电子数的差值为
的中子数与电子数的差值为II.硒(34Se)是动物和人体所必需的微量元素之一,也是重要的工业原料,与氧同族。
(4)Se原子结构示意图可表示为
(5)下列说法合理的是
a.SeO2既有氧化性又有还原性 b.沸点:H2O < H2S < H2Se
c.热稳定性:H2Se<HCl<H2S d.酸性:H2SeO4<HBrO4<HClO4
您最近一年使用:0次
2 . 已知砒霜(As2O3)与锌可以发生如下反应:As2O3+6Zn+6H2SO4=2AsH3+6ZnSO4+3H2O。
(1)请用“双线桥法”标出电子转移的方向和数目:____________ 。
(2)砒霜在上述反应中显示出来的性质是_______ (填字母)。
A.氧化性 B.还原性 C.酸性 D.碱性
(3)该反应的氧化产物是___ ,还原产物是___ 。
(1)请用“双线桥法”标出电子转移的方向和数目:
(2)砒霜在上述反应中显示出来的性质是
A.氧化性 B.还原性 C.酸性 D.碱性
(3)该反应的氧化产物是
您最近一年使用:0次
2019-11-17更新
|
143次组卷
|
2卷引用:天津市静海区瀛海学校等四校2019-2020学年高一11月联考化学试题
3 . (1)5 mol的CO2与8 mol的SO2的分子数之比是________ ;原子数之比是________ ;质量比是________ 。
(2)KClO3和浓HCl在一定温度下反应会生成黄绿色的易爆物二氧化氯。其反应可表述为:________ KClO3+________HCl(浓)===________KCl+________ClO2↑+________Cl2↑+________H2O
①配平以上化学方程式(化学计量数填入划线上)。
②ClO2是反应的________ (填“氧化”或“还原”)产物。浓盐酸在反应中显示出来的性质是(填写号码)________ 。
a.还原性 b.氧化性 c.酸性 d.碱性
③反应产生0.1 mol Cl2,则转移的电子的物质的量为________ mol。
④ClO2具有很强的氧化性,因此可被用来做消毒剂,若ClO2作消毒剂后其自身转化为Cl-,则其消毒的效率(以单位质量得到电子数表示)是Cl2的________ 倍(保留2位小数)。
(2)KClO3和浓HCl在一定温度下反应会生成黄绿色的易爆物二氧化氯。其反应可表述为:
①配平以上化学方程式(化学计量数填入划线上)。
②ClO2是反应的
a.还原性 b.氧化性 c.酸性 d.碱性
③反应产生0.1 mol Cl2,则转移的电子的物质的量为
④ClO2具有很强的氧化性,因此可被用来做消毒剂,若ClO2作消毒剂后其自身转化为Cl-,则其消毒的效率(以单位质量得到电子数表示)是Cl2的
您最近一年使用:0次
13-14高三上·天津南开·阶段练习
4 . 加碘食盐中通常加入的是KIO3,该物质在酸性条件下表现出较强的氧化性,可以和碘化物、亚硫酸盐等还原性物质发生反应。
(1)写出KIO3与KI在稀硫酸介质中发生反应的离子方程式______________________
(2)为测定菜加碘盐中碘元素的含量,某学生甲设计了如下实验:
A.准确称取wg食盐,使其完全溶解在适量的蒸馏水中;
B.用稀硫酸酸化所得溶液,加入过量的KI溶液,使其充分反应;
C.以___________________ 为指示剂,运滴加入物质的量浓度为 的硫代硫酸钠溶液10.0mL,恰好完全反应,判断反应完全的实验现象为
的硫代硫酸钠溶液10.0mL,恰好完全反应,判断反应完全的实验现象为____________________________________ ,则该加碘盐样品中碘元素的含量为______________________ mg/kg(用含w的代数式表示)。
(已知: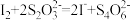 )
)
(3)某学生乙又进行了下列实验:
A.准确称取1.0g纯净的NaCl,加3mL蒸馏水配成溶液,溶液为无色;
B.滴入5滴指示剂和1mL 0.lmol/L Kl溶液,充分振荡,溶液不变化;
C.继续滴加l滴1mol/L的硫酸溶液,充分振荡,溶液变蓝色
推测实验中产生蓝色现象的原因,用离子方程式表示________________________
根据学生乙的实验结果,请对学生甲的实验结果进行分________________________ (偏大、偏小、正确),其原因是________________________________________________ .
(1)写出KIO3与KI在稀硫酸介质中发生反应的离子方程式
(2)为测定菜加碘盐中碘元素的含量,某学生甲设计了如下实验:
A.准确称取wg食盐,使其完全溶解在适量的蒸馏水中;
B.用稀硫酸酸化所得溶液,加入过量的KI溶液,使其充分反应;
C.以
 的硫代硫酸钠溶液10.0mL,恰好完全反应,判断反应完全的实验现象为
的硫代硫酸钠溶液10.0mL,恰好完全反应,判断反应完全的实验现象为(已知:
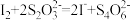 )
)(3)某学生乙又进行了下列实验:
A.准确称取1.0g纯净的NaCl,加3mL蒸馏水配成溶液,溶液为无色;
B.滴入5滴指示剂和1mL 0.lmol/L Kl溶液,充分振荡,溶液不变化;
C.继续滴加l滴1mol/L的硫酸溶液,充分振荡,溶液变蓝色
推测实验中产生蓝色现象的原因,用离子方程式表示
根据学生乙的实验结果,请对学生甲的实验结果进行分
您最近一年使用:0次
5 . 烃类物质是整个有机化学的基础,烃及其衍生物共同构成了庞大的有机物世界。
(1)实验室中用如图所示的装置进行甲烷与氯气在光照下反应的实验。___________ 。___________ (填化学式)。
③甲烷与氯气反应生成的产物最多的是___________ (填化学式)。
④若将1molCH4与一定量的 反应,得到等物质的量的4种有机产物,则消耗
反应,得到等物质的量的4种有机产物,则消耗 的物质的量为
的物质的量为___________ mol。
(2)我国已对酒驾实行了“醉驾入刑”,酒的主要成分是乙醇。乙醇的官能团名称是___________ 。使用酸性 溶液可以检测酒驾,利用了乙醇的
溶液可以检测酒驾,利用了乙醇的___________ (填“氧化性”或“还原性”),其原理是:司机口中呼出的乙醇可以使检测仪中的橙色重铬酸钾(K2Cr2O)转变为绿色的硫酸铬[Cr2(SO4)3],上述反应涉及的乙醇性质有___________ 。
A.无色液体 B.密度比水的小 C.易挥发 D.具有还原性
(1)实验室中用如图所示的装置进行甲烷与氯气在光照下反应的实验。

A. B.
B. C.
C. D.
D.
③甲烷与氯气反应生成的产物最多的是
④若将1molCH4与一定量的
 反应,得到等物质的量的4种有机产物,则消耗
反应,得到等物质的量的4种有机产物,则消耗 的物质的量为
的物质的量为(2)我国已对酒驾实行了“醉驾入刑”,酒的主要成分是乙醇。乙醇的官能团名称是
 溶液可以检测酒驾,利用了乙醇的
溶液可以检测酒驾,利用了乙醇的A.无色液体 B.密度比水的小 C.易挥发 D.具有还原性
您最近一年使用:0次
解题方法
6 . 完成下列问题
Ⅰ.现有下列十种物质:①蔗糖②熔融NaCl③盐酸④铜丝⑤NaOH固体⑥氧气⑦ 固体⑧乙醇⑨
固体⑧乙醇⑨ 溶液⑩液态
溶液⑩液态
(1)上述状态下物质中可导电的是___________ (填序号,下同)。
(2)上述状态下物质中不能导电,但属于电解质的是___________
(3)上述物质中属于非电解质的是___________ 。
Ⅱ.储氢纳米碳管研究成功体现了科技的进步,但用电弧法合成的纳米碳管常伴有大量的杂质碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,反应的化学方程式为: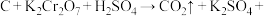
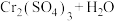 (未配平)。回答下列问题。
(未配平)。回答下列问题。
(4)该反应中,还原剂是___________ (填化学式),被还原的元素是___________ (填元素符号)。
(5) 在该反应中表现出___________(填字母)。
在该反应中表现出___________(填字母)。
(6)配平上述方程式:___________ 。每生成2分子 ,该反应转移
,该反应转移___________ 个电子。
Ⅰ.现有下列十种物质:①蔗糖②熔融NaCl③盐酸④铜丝⑤NaOH固体⑥氧气⑦
 固体⑧乙醇⑨
固体⑧乙醇⑨ 溶液⑩液态
溶液⑩液态
(1)上述状态下物质中可导电的是
(2)上述状态下物质中不能导电,但属于电解质的是
(3)上述物质中属于非电解质的是
Ⅱ.储氢纳米碳管研究成功体现了科技的进步,但用电弧法合成的纳米碳管常伴有大量的杂质碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,反应的化学方程式为:
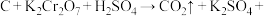
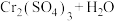 (未配平)。回答下列问题。
(未配平)。回答下列问题。(4)该反应中,还原剂是
(5)
 在该反应中表现出___________(填字母)。
在该反应中表现出___________(填字母)。| A.只有酸性 | B.只有氧化性 | C.酸性和氧化性 | D.酸性和还原性 |
 ,该反应转移
,该反应转移
您最近一年使用:0次
7 . 铁是人体内含量最多的必需微量元素,缺铁性贫血患者应补充含Fe2+的亚铁盐。“速力菲”(主要成分:琥珀酸亚铁)是一种常见的补铁药物。某兴趣小组为了检验“速力菲”药片中Fe2+的存在并测定铁元素的含量,设计如下实验(假设反应过程无铁元素损耗):

请回答下列问题:
(1)操作I的名称是____________ ,试剂1是___________________ 。
(2)证明药片中含有Fe2+的依据________________ 。
(3)加入试剂1后溶液为淡红色,说明“速力菲”中的Fe2+已部分被氧化。通常在服用“速力菲”同时服用维生素C,说明维生素C具有________________ (填“氧化性”或“还原性”)。
(4)淡红色溶液中加入氯水,发生反应的离子方程式为__________________ 。
(5)Fe(OH)2沉淀也易被O2氧化,写出该反应的化学方程式_____________________ 。
(6)“速力菲”药片中铁元素的含量为_________________ (用含有a、b的式子表示)。

请回答下列问题:
(1)操作I的名称是
(2)证明药片中含有Fe2+的依据
(3)加入试剂1后溶液为淡红色,说明“速力菲”中的Fe2+已部分被氧化。通常在服用“速力菲”同时服用维生素C,说明维生素C具有
(4)淡红色溶液中加入氯水,发生反应的离子方程式为
(5)Fe(OH)2沉淀也易被O2氧化,写出该反应的化学方程式
(6)“速力菲”药片中铁元素的含量为
您最近一年使用:0次
2021-02-21更新
|
497次组卷
|
5卷引用:天津市第三中学2022-2023学年高三上学期12月月考化学试题
名校
8 . 回答下列问题。
I.实验室可用 和浓盐酸反应制取氯气,其变化可表述为
和浓盐酸反应制取氯气,其变化可表述为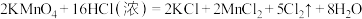 。
。
(1)请将上述化学方程式改写为离子方程式:___________ 。
(2)用双线桥法表示该反应电子转移的方向和数目___________
(3)浓盐酸在反应中显示出来的性质是(填序号)___________ 。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
II.把通入浓氨水中,发生反应: 。
。
(4)其中发生化学反应的 与
与 的分子数之比为
的分子数之比为___________ ,氧化剂与还原剂分子数之比为___________ 。
I.实验室可用
 和浓盐酸反应制取氯气,其变化可表述为
和浓盐酸反应制取氯气,其变化可表述为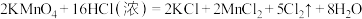 。
。(1)请将上述化学方程式改写为离子方程式:
(2)用双线桥法表示该反应电子转移的方向和数目
(3)浓盐酸在反应中显示出来的性质是(填序号)
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
II.把通入浓氨水中,发生反应:
 。
。(4)其中发生化学反应的
 与
与 的分子数之比为
的分子数之比为
您最近一年使用:0次
9 . I.化学兴趣小组对以下实验进行探究:
(1)牙膏摩擦剂由碳酸钙、氢氧化铝组成;写出氢氧化铝与NaOH溶液反应的离子方程式______ 。
II.现欲探究铁及其化合物的氧化性或还原性,请完成以下实验报告:
(2)称取用磨砂纸打磨后的铁钉2.8g放入50.0mL稀硫酸中,充分反应后若2.8g纯净的Fe全部参加反应。反应中转移______ mol电子。
(3)下列有关Fe2+的说法不正确的是_______ (选填序号)。
III.卤族元素是典型的非金属元素,已知稀溴水与稀铁盐(含Fe3+)溶液的颜色相近;Cl2能将Fe2+氧化为Fe3+;Fe3+能将I-氧化为I2。请完成以下实验报告:
(4)关于F、Cl、Br、I的比较,不正确的是_______ (选填序号)。
(5)稀溴水的颜色为_______ 。
(6)将Fe2+逐滴滴加到稀溴水溶液中,再加入几滴淀粉碘化钾溶液。溶液变为蓝色,不能证明证明Br2能将Fe2+氧化为Fe3+,因为Br2与I-作用产生的碘可以使淀粉变蓝,写出Br2与I-作用的离子方程式_______ 。另将Fe2+逐滴滴加到另一份稀溴水溶液中,加入几滴______ 溶液,溶液变为红色,证明Br2能将Fe2+氧化为Fe3+。
(7)另取20mLFeSO4溶液,向其中通入Cl2。若Fe2+恰好完全转化为Fe3+,消耗的Cl2在标准状况下的体积为0.336L,则该FeSO4溶液的物质的量浓度为______ mol/L。
(1)牙膏摩擦剂由碳酸钙、氢氧化铝组成;写出氢氧化铝与NaOH溶液反应的离子方程式
II.现欲探究铁及其化合物的氧化性或还原性,请完成以下实验报告:
(2)称取用磨砂纸打磨后的铁钉2.8g放入50.0mL稀硫酸中,充分反应后若2.8g纯净的Fe全部参加反应。反应中转移
(3)下列有关Fe2+的说法不正确的是
| A.可以先加KSCN溶液再加氯水来检验Fe2+ |
| B.可以先加铁粉再加KSCN溶液来检验Fe2+ |
| C.能使酸性KMnO4溶液紫色褪去 |
| D.能观察到溶液颜色为浅绿色 |
III.卤族元素是典型的非金属元素,已知稀溴水与稀铁盐(含Fe3+)溶液的颜色相近;Cl2能将Fe2+氧化为Fe3+;Fe3+能将I-氧化为I2。请完成以下实验报告:
(4)关于F、Cl、Br、I的比较,不正确的是
| A.它们的原子核外电子层数随核电荷数的增加而增多 |
| B.单质(F2、Cl2、Br2、I2)的氧化性随核电荷数的增加而减弱 |
| C.被其他卤素单质从卤化物中置换出来的可能性随原子序数的增加而增大 |
| D.它们的氢化物的稳定性随原子序数的增加而增强 |
(6)将Fe2+逐滴滴加到稀溴水溶液中,再加入几滴淀粉碘化钾溶液。溶液变为蓝色,不能证明证明Br2能将Fe2+氧化为Fe3+,因为Br2与I-作用产生的碘可以使淀粉变蓝,写出Br2与I-作用的离子方程式
(7)另取20mLFeSO4溶液,向其中通入Cl2。若Fe2+恰好完全转化为Fe3+,消耗的Cl2在标准状况下的体积为0.336L,则该FeSO4溶液的物质的量浓度为
您最近一年使用:0次
10 . 醋酸在日常生活和生产中的应用很广泛。
(1) pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 (填“酸性”、“中性”或“碱性”),溶液中c(Na+) c(CH3COO-)(填“>”、“=”或“<”)。
(2) 25℃时,向0.l mol·L-1的醋酸中加入少量醋酸钠固体,当固体溶解后,测得溶液pH增大,主要原因是 。
(3)室温下,如果将0.lmol CH3COONa固体和0.05mol HCl全部溶于水形成混合溶液中: 和 两种粒子的物质的量之和等于0.lmol。
(4)用标准的NaOH溶液滴定未知浓度的醋酸,选用酚酞为指示剂,下列能造成测定结果偏高的是 。
(5)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。资料:AgSCN是白色沉淀,相同温度下,溶解度:AgSCN > AgI。
① 写出步骤2中溶液变红色的离子方程式
② 步骤3中现象a是
③ 用化学平衡原理解释步骤4的实验现象
(1) pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 (填“酸性”、“中性”或“碱性”),溶液中c(Na+) c(CH3COO-)(填“>”、“=”或“<”)。
(2) 25℃时,向0.l mol·L-1的醋酸中加入少量醋酸钠固体,当固体溶解后,测得溶液pH增大,主要原因是 。
(3)室温下,如果将0.lmol CH3COONa固体和0.05mol HCl全部溶于水形成混合溶液中: 和 两种粒子的物质的量之和等于0.lmol。
(4)用标准的NaOH溶液滴定未知浓度的醋酸,选用酚酞为指示剂,下列能造成测定结果偏高的是 。
| A.未用标准液润洗碱式滴定管 |
| B.滴定终点读数时,俯视滴定管的刻度 |
| C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗 |
| D.滴定达终点时,发现滴定管尖嘴部分有气泡 |
(5)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。资料:AgSCN是白色沉淀,相同温度下,溶解度:AgSCN > AgI。
| 操作步骤 | 现象 |
| 步骤1:向2 mL 0.005 mol·L-1 AgNO3溶液中加入2 mL 0.005 mol·L-1 KSCN溶液,静置。 | 出现白色沉淀。 |
| 步骤2:取1 mL上层清液于试管中,滴加1滴2 mol·L-1 Fe(NO3)3溶液。 | 溶液变红色。 |
| 步骤3:向步骤2的溶液中,继续加入5滴3 mol·L-1 AgNO3溶液。 | ,溶液红色变浅。 |
| 步骤4:向步骤1余下的浊液中加入5滴3 mol·L-1 KI溶液。 | 出现黄色沉淀。 |
① 写出步骤2中溶液变红色的离子方程式
② 步骤3中现象a是
③ 用化学平衡原理解释步骤4的实验现象
您最近一年使用:0次



