解题方法
1 . 铅(Pb)及其化合物广泛用于冶金、蓄电池、印刷、颜料、油漆等领域,常见铅的化合物主要以+2价和+4价的形态存在。经查阅资料:
已知:①Pb与酸反应都得到+2价的化合物。
②PbCl4不稳定,易分解为PbCl2和Cl2。
回答下列问题:
(1)Pb是较活泼金属,但在实验室或化工厂常用Pb作为某些酸(如稀硫酸)的耐酸反应器的衬里和贮存、输送的管道设备。请解释其原因___________ 。
(2)PbSO4可用于制造蓄电池、白色颜料等。写出用钠盐制备PbSO4的化学方程式___________ 。
(3)PbO2在强酸性条件下能与Mn2+反应生成Pb2+和 ,反应的离子方程式为
,反应的离子方程式为 ___________ ,该反应说明PbO2具有 ___________ (填“氧化性”或“还原性”)。
(4)经查阅,PbO2是两性氧化物,设计实验并验证
| 物质 | PbO | PbO2 | PbCl2 | PbCl+4 |
| 在水中的溶解性(常温) | 难溶于水的黄色固体 | 难溶于水的棕黑色固体 | 微溶于水的白色固体 | 易溶于水的黄色油状液体 |
| 物质 | PbSO4 | Pb(NO3)2 | Na2PbO2 | Na2PbO3 |
| 在水中的溶解性(常温) | 难溶于水的白色固体 | 易溶于水形成无色溶液 | 易溶于水形成无色溶液 | 易溶于水形成无色溶液 |
②PbCl4不稳定,易分解为PbCl2和Cl2。
回答下列问题:
(1)Pb是较活泼金属,但在实验室或化工厂常用Pb作为某些酸(如稀硫酸)的耐酸反应器的衬里和贮存、输送的管道设备。请解释其原因
(2)PbSO4可用于制造蓄电池、白色颜料等。写出用钠盐制备PbSO4的化学方程式
(3)PbO2在强酸性条件下能与Mn2+反应生成Pb2+和
 ,反应的离子方程式为
,反应的离子方程式为 (4)经查阅,PbO2是两性氧化物,设计实验并验证
| 实验步骤 | 实验现象 | 反应的化学方程式 |
| ①向盛有PbO2固体的试管中滴加NaOH溶液 | 棕黑色固体逐渐溶解 | |
| ②向盛有PbO2固体的试管中滴加稀盐酸 |
您最近一年使用:0次
名校
解题方法
2 . 人体必需的一些元素在周期表中的分布情况如下:___________ 。H2O2是一种绿色氧化剂,电子式为___________ 。
(2)钠离子和氯离子可以帮助我们维持机体的电解质平衡。常温下,将Cl2通入NaOH溶液中,可以得到一种漂白液,上述反应的化学方程式为___________ 。
(3)铁、铬、锰在人体内含量微乎其微,但对维持内分泌平衡和身体基础代谢有重要作用。向少量酸性H2O2溶液中加入FeSO4溶液,发生反应的离子方程式为___________ 。
(4)前四周期同族元素的某种性质X随核电荷数的变化趋势如图所示,则下列说法正确的是___________ 。

(2)钠离子和氯离子可以帮助我们维持机体的电解质平衡。常温下,将Cl2通入NaOH溶液中,可以得到一种漂白液,上述反应的化学方程式为
(3)铁、铬、锰在人体内含量微乎其微,但对维持内分泌平衡和身体基础代谢有重要作用。向少量酸性H2O2溶液中加入FeSO4溶液,发生反应的离子方程式为
(4)前四周期同族元素的某种性质X随核电荷数的变化趋势如图所示,则下列说法正确的是
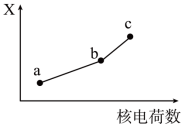
| A.若a、b、c表示氧族元素,则X表示对应氢化物的稳定性 |
| B.若a、b、c表示卤族元素,则X表示对应简单离子的还原性 |
| C.若a、b、c表示第IA族元素,则X表示对应离子的氧化性 |
| D.若a、b、c表示第IIA族元素,则X表示最高价氧化物对应水化物的碱性 |
您最近一年使用:0次
3 . 利用图,可以从不同角度研究含氯物质的性质及其转化关系,图中甲~辛均含氯元素。回答下列问题:

(1)丙的化学式为______ ;丁属于______ (“酸性”或“碱性”)氧化物。
(2)图中甲、乙、丁、戊中,属于电解质的是_____ (填化学式);根据氯元素的化合价判断,乙物质的性质______ (填标号)。
a.只有氧化性 b.既有氧化性又有还原性 c.只有还原性
(3)物质己的化学式为HClO4,电解甲溶液制备己的化学反应为:甲+H2O 己+H2↑(未配平),配平后参与反应的甲与H2O的微粒个数之比是
己+H2↑(未配平),配平后参与反应的甲与H2O的微粒个数之比是_____ 。
(4)庚是家庭中常用消毒液的有效成分NaClO,用乙制取庚的化学方程式为_____ 。NaClO溶液中显碱性原因:______ (用离子方程式表示)。
(5)辛在MnO2催化下受热分解可用于制备氧气,每生成1.204×1024氧气分子,转移e-的个数为______ 。

(1)丙的化学式为
(2)图中甲、乙、丁、戊中,属于电解质的是
a.只有氧化性 b.既有氧化性又有还原性 c.只有还原性
(3)物质己的化学式为HClO4,电解甲溶液制备己的化学反应为:甲+H2O
 己+H2↑(未配平),配平后参与反应的甲与H2O的微粒个数之比是
己+H2↑(未配平),配平后参与反应的甲与H2O的微粒个数之比是(4)庚是家庭中常用消毒液的有效成分NaClO,用乙制取庚的化学方程式为
(5)辛在MnO2催化下受热分解可用于制备氧气,每生成1.204×1024氧气分子,转移e-的个数为
您最近一年使用:0次
名校
解题方法
4 . 硝酸是一种具有强氧化性、腐蚀性的强酸,其还原产物因硝酸浓度的不同而有变化,从总体上说,硝酸浓度越高,平均每分子硝酸得到的电子数越少,浓硝酸的还原产物主要为NO2、稀硝酸的还原产物为NO。实验室中,常用Cu与浓HNO3反应制取NO2,用Cu与稀HNO3反应制取NO。
(1)浓硝酸具有以下性质:
①强氧化性 ②酸性 ③还原性 ④不稳定性 ⑤挥发性
下列反应或者现象主要体现了硝酸的什么性质:
①久置浓硝酸显黄色_____ (填序号,下同),请写出反应的化学方程式_____ 。
②用稀硝酸清洗试管壁上的银_____ 。
③稀硝酸清洗石灰水试剂瓶壁上的固体_____ 。
(2)请写出实验室中用Cu与稀HNO3反应制取NO的化学方程式并用双线桥标明电子的转移方向及数目______ 。
(3)64gCu与适量的浓HNO3反应,铜全部作用后,共收集到22.4L气体(标准状况下),反应中消耗的HNO3的物质的量是______ (填字母代号)。
(4)硝酸的还原产物NO、NO2、N2O等对环境均有副作用,为了可持续发展,当今社会提出的一个新概念:“绿色化学”,它要求从经济、环保和技术上设计可行的化学反应,则下列由单质铜制取硝酸铜的方法可行且符合“绿色化学”的是______ (填字母代号)。
(5)实际上硝酸不仅可被还原为NO2或NO,浓度更稀时硝酸还可以被还原为NO2、N2、NH4NO3等,锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水,写出该反应的化学方程式_____ ,当生成amol硝酸锌时,被还原的硝酸的物质的量为_____ 。
(1)浓硝酸具有以下性质:
①强氧化性 ②酸性 ③还原性 ④不稳定性 ⑤挥发性
下列反应或者现象主要体现了硝酸的什么性质:
①久置浓硝酸显黄色
②用稀硝酸清洗试管壁上的银
③稀硝酸清洗石灰水试剂瓶壁上的固体
(2)请写出实验室中用Cu与稀HNO3反应制取NO的化学方程式并用双线桥标明电子的转移方向及数目
(3)64gCu与适量的浓HNO3反应,铜全部作用后,共收集到22.4L气体(标准状况下),反应中消耗的HNO3的物质的量是
| A.0.5mol | B.1mol | C.2mol | D.3mol |
A.Cu Cu(NO3)2 Cu(NO3)2 |
B.Cu CuO CuO Cu(NO3)2 Cu(NO3)2 |
C.Cu CuO CuO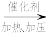 Cu(OH)2 Cu(OH)2 Cu(NO3)2 Cu(NO3)2 |
D.Cu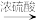 CuSO4 CuSO4 Cu(NO3)2 Cu(NO3)2 |
您最近一年使用:0次
解题方法
5 . 回答下列问题:
(1)书写下列反应的离子方程式:
①NaOH溶液和H2SO4溶液:___ 。
②NaCl溶液和AgNO3溶液:___ 。
③Ba(OH)2溶液和H2SO4溶液:___ 。
④Fe与CuSO4溶液反应:___ 。
⑤Na2CO3溶液与Ca(OH)2溶液反应:___ 。
(2)写出下列离子方程式表示的化学方程式。
①CO +2H+=CO2↑+H2O:
+2H+=CO2↑+H2O:___ 。
②Cu2++2OH-=Cu(OH)2↓:___ 。
③SO2+2OH-=CO +H2O:
+H2O:___ 。
④Fe2O3+6H+=2Fe3++3H2O:___ 。
⑤Ba2++ CO =BaCO3↓:
=BaCO3↓:___ 。
(3)已知As2O3与Zn可以发生如下反应:As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O。
①请用双线桥法标出电子转移的方向和数目___ 。
②As2O3在上述反应中显示出来的性质是___ (填序号)。
A.氧化性 B.还原性 C.酸性 D.碱性
③该反应的氧化产物是___ ,还原产物是___ 。
(1)书写下列反应的离子方程式:
①NaOH溶液和H2SO4溶液:
②NaCl溶液和AgNO3溶液:
③Ba(OH)2溶液和H2SO4溶液:
④Fe与CuSO4溶液反应:
⑤Na2CO3溶液与Ca(OH)2溶液反应:
(2)写出下列离子方程式表示的化学方程式。
①CO
 +2H+=CO2↑+H2O:
+2H+=CO2↑+H2O:②Cu2++2OH-=Cu(OH)2↓:
③SO2+2OH-=CO
 +H2O:
+H2O:④Fe2O3+6H+=2Fe3++3H2O:
⑤Ba2++ CO
 =BaCO3↓:
=BaCO3↓:(3)已知As2O3与Zn可以发生如下反应:As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O。
①请用双线桥法标出电子转移的方向和数目
②As2O3在上述反应中显示出来的性质是
A.氧化性 B.还原性 C.酸性 D.碱性
③该反应的氧化产物是
您最近一年使用:0次
6 . 氧化剂和还原剂在生产生活中广泛使用。
(1)高锰酸钾和氢溴酸溶液可以发生如下反应:2KMnO4+16HBr=5Br2+2MnBr2+2KBr+8H2O
①用单线桥表示电子转移的方向和数目_______ 。
②若有8个Br-离子参加反应,则转移电子的数目是_______ 个。
③HBr在上述反应中显示出来的性质是_______ 。
A.氧化性 B.还原性 C.酸性 D.碱性
(2)①请配平化学方程式______ 。
_______KClO3+_______HCl(浓)=_______KCl+_______ClO2+_______Cl2↑+_______H2O
②写出NaClO与酸性FeSO4溶液混合发生氧化还原反应的离子方程式:_______
(3)H3PO2和NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银。利用H3PO2进行化学镀银反应中,氧化剂与还原剂物质的量之比为4∶1,则氧化产物为_______ 。
(1)高锰酸钾和氢溴酸溶液可以发生如下反应:2KMnO4+16HBr=5Br2+2MnBr2+2KBr+8H2O
①用单线桥表示电子转移的方向和数目
②若有8个Br-离子参加反应,则转移电子的数目是
③HBr在上述反应中显示出来的性质是
A.氧化性 B.还原性 C.酸性 D.碱性
(2)①请配平化学方程式
_______KClO3+_______HCl(浓)=_______KCl+_______ClO2+_______Cl2↑+_______H2O
②写出NaClO与酸性FeSO4溶液混合发生氧化还原反应的离子方程式:
(3)H3PO2和NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银。利用H3PO2进行化学镀银反应中,氧化剂与还原剂物质的量之比为4∶1,则氧化产物为
您最近一年使用:0次
名校
7 . 双氧水和84消毒液是生活中常用的两种消毒剂,某同学设计如下实验研究 的性质。
的性质。
(1)①已知淀粉遇碘会变蓝,能证明 具有还原性的实验是
具有还原性的实验是_______ (填序号)。
②试写出实验i中反应的离子方程式_______ 。
③依据表格信息,将 、
、 、
、 按氧化性由强到弱依次排序:
按氧化性由强到弱依次排序:_______ 。(写化学式)
(2)某届奥运会期间,由于工作人员将84消毒液(有效成分NaClO)与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO与 反应产生
反应产生 促进藻类快速生长。该反应说明氧化性:NaClO
促进藻类快速生长。该反应说明氧化性:NaClO_______  (填“>”或“<”);当参加反应的NaClO和
(填“>”或“<”);当参加反应的NaClO和 的个数比为1:1时,该反应的还原产物为
的个数比为1:1时,该反应的还原产物为_______ (填字母序号)。
A. B.
B. C.
C. D.NaCl E.
D.NaCl E.
(3)饮用水中的 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,可以在碱性条件下用铝粉将
的浓度,可以在碱性条件下用铝粉将 还原为
还原为 ,Al被氧化为
,Al被氧化为 ,写出该反应的离子方程式:
,写出该反应的离子方程式:_______ 。上述反应中,被氧化的物质是_______ (写化学式),还原产物是_______ (写化学式)。
 的性质。
的性质。| 序号 | 实验 | 实验现象 |
| i | 向5%  溶液中滴加酸性 溶液中滴加酸性 溶液 溶液 | a.溶液紫色褪去 b.有大量气泡产生 |
| ii | 向5%  溶液中滴加淀粉碘化钾溶液 溶液中滴加淀粉碘化钾溶液 | c.溶液变蓝 |
 具有还原性的实验是
具有还原性的实验是②试写出实验i中反应的离子方程式
③依据表格信息,将
 、
、 、
、 按氧化性由强到弱依次排序:
按氧化性由强到弱依次排序:(2)某届奥运会期间,由于工作人员将84消毒液(有效成分NaClO)与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO与
 反应产生
反应产生 促进藻类快速生长。该反应说明氧化性:NaClO
促进藻类快速生长。该反应说明氧化性:NaClO (填“>”或“<”);当参加反应的NaClO和
(填“>”或“<”);当参加反应的NaClO和 的个数比为1:1时,该反应的还原产物为
的个数比为1:1时,该反应的还原产物为A.
 B.
B. C.
C. D.NaCl E.
D.NaCl E.
(3)饮用水中的
 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,可以在碱性条件下用铝粉将
的浓度,可以在碱性条件下用铝粉将 还原为
还原为 ,Al被氧化为
,Al被氧化为 ,写出该反应的离子方程式:
,写出该反应的离子方程式:
您最近一年使用:0次
2023-10-10更新
|
253次组卷
|
2卷引用:广东省广州市真光中学2023-2024学年高一上学期期中考试化学试题
8 . 已知砒霜As2O3与Zn可以发生如下反应:As2O3+6Zn + 6H2SO4 = 2AsH3↑+ 6ZnSO4+ 3H2O (AsH3中As为-3价)
(1)用双线桥法标明上述反应方程式中电子转移的方向和数目_______ 。
(2)As2O3在上述反应中显示出来的性质是_______。
(3)该反应的还原剂是_______ ,还原产物是_______ 。
(4)若生成0.2 mol AsH3,则转移的电子为_______ mol。
(1)用双线桥法标明上述反应方程式中电子转移的方向和数目
(2)As2O3在上述反应中显示出来的性质是_______。
| A.氧化性 | B.还原性 | C.酸性 | D.碱性 |
(4)若生成0.2 mol AsH3,则转移的电子为
您最近一年使用:0次
9 . 硫是重要的非金属元素,也是人类较早认识的元素之一、下图为硫及其化合物在自然界中的部分转化关系。根据信息,完成下列填空。

(1)下列关于SO2的说法正确的是_______(填字母)
(2)过程①发生了两种不同价态的含硫气体的反应,该反应的化学方程式为_______ 。
(3)浓硫酸是一种重要的无机酸
①浓硫酸在空气中放置一段时间后浓度变小,体现了浓硫酸的_______ (填字母)。
A.吸水性 B.挥发性 C.脱水性 D.强酸性
②利用钝化现象,工业上用_______ (填名称,只写一种)制容器盛装冷的浓硫酸。
③实验室常用浓硫酸与金属铜反应来制备SO2,写出其化学方程式_______ 。
(4)兴趣小组设计实验处理含SO2的废气。先将废气通入 酸性溶液中,充分吸收后,再向所得溶液中鼓入空气,得到溶液X。
酸性溶液中,充分吸收后,再向所得溶液中鼓入空气,得到溶液X。
①该实验利用SO2的_______ (填字母)。
A.氧化性 B.还原性 C.漂白性 D.酸性
②溶液X中可能含 和
和 ,为了探究其成分设计以下实验。请完成表中内容。
,为了探究其成分设计以下实验。请完成表中内容。
③在处理过程中,可替代空气的最佳试剂是_______ (填字母)。
A. B.Fe C.
B.Fe C. D.
D.

(1)下列关于SO2的说法正确的是_______(填字母)
| A.SO2是无色无味的有毒气体 | B.SO2与 反应生成不稳定的 反应生成不稳定的 |
| C.SO2有毒,不能用作食品加工 | D.SO2和氯气的混合使用可以增强漂白性 |
(3)浓硫酸是一种重要的无机酸
①浓硫酸在空气中放置一段时间后浓度变小,体现了浓硫酸的
A.吸水性 B.挥发性 C.脱水性 D.强酸性
②利用钝化现象,工业上用
③实验室常用浓硫酸与金属铜反应来制备SO2,写出其化学方程式
(4)兴趣小组设计实验处理含SO2的废气。先将废气通入
 酸性溶液中,充分吸收后,再向所得溶液中鼓入空气,得到溶液X。
酸性溶液中,充分吸收后,再向所得溶液中鼓入空气,得到溶液X。①该实验利用SO2的
A.氧化性 B.还原性 C.漂白性 D.酸性
②溶液X中可能含
 和
和 ,为了探究其成分设计以下实验。请完成表中内容。
,为了探究其成分设计以下实验。请完成表中内容。| 实验 | 操作 | 现象结论 |
| 取少量溶液X于试管中,滴加酸性高锰酸钾溶液 | 高锰酸钾紫色褪去 | a. |
| 另取少量溶液X于试管中,滴加硫氰化钾溶液 | b. | 溶液X含 |
A.
 B.Fe C.
B.Fe C. D.
D.
您最近一年使用:0次
10 . 利用下图,可以从不同角度研究含氯物质的性质及其转化关系,图中甲~辛均含氯元素。回答下列问题:

(1)丙的化学式为_______ ;丁属于_______ “酸性”或”碱性”)氧化物。
(2)图中甲、乙、丁、戊中,属于电解质的是_____ (填化学式);根据氯元素的化合价判断,乙物质_____________ 。
a 只有氧化性
b 既有氧化性又有还原性
c 只有还原性
(3)电解甲溶液制备己的化学反应为 (未配平),配平后参与反应的甲与
(未配平),配平后参与反应的甲与 的物质的量之比是
的物质的量之比是________ 。
(4)庚是漂白粉的有效成分,用乙制取庚的化学方程式为_______ 。
(5)辛在 催化下受热分解可用于制备一种常见气体,这种气体的化学式是
催化下受热分解可用于制备一种常见气体,这种气体的化学式是______ 。

(1)丙的化学式为
(2)图中甲、乙、丁、戊中,属于电解质的是
a 只有氧化性
b 既有氧化性又有还原性
c 只有还原性
(3)电解甲溶液制备己的化学反应为
 (未配平),配平后参与反应的甲与
(未配平),配平后参与反应的甲与 的物质的量之比是
的物质的量之比是(4)庚是漂白粉的有效成分,用乙制取庚的化学方程式为
(5)辛在
 催化下受热分解可用于制备一种常见气体,这种气体的化学式是
催化下受热分解可用于制备一种常见气体,这种气体的化学式是
您最近一年使用:0次
2020-09-15更新
|
144次组卷
|
3卷引用:广东省广州市番禺区洛城中学2022-2023学年高一上学期第一次月考化学试题



