1 . 化学为疫情防控提供了强有力的支撑。许多含氯物质既是重要化工原料,又是高效、广谱的灭菌消毒剂。
(1)舍勒用软锰矿(主要成分为二氧化锰)为原料得到氯气,反应的化学方程式为_______ 。
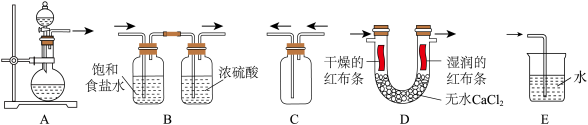
(2)应用以上原理制备、净化、收集氯气并进行性质检验和尾气处理,下列装置(“→”表示气流方向)不能达到实验目的的是_______ 。
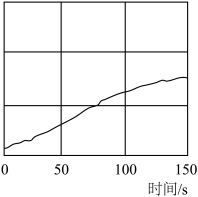
(3)为验证氯水中HClO分解的产物,现用强光照射氯水,并用氯离子浓度传感器、氧气传感器(测体积分数)、pH传感器等仪器进行数据采集,获得相关变化曲线如图。图中纵坐标可表示的物理量是_______ (任写两个)。
(4)下列物质常用于杀菌消毒,其中消毒原理与HClO相同的是_______
(5)84消毒液的主要成分为NaClO和NaCl,不能与酸性清洁剂混合使用,其原因是_______ 。
(6)二氧化氯( )是常用消毒剂,但其稳定性差,通常把它通入
)是常用消毒剂,但其稳定性差,通常把它通入 和NaOH的混合溶液中,使之转化成
和NaOH的混合溶液中,使之转化成 ,便于运输储存。写出对应的离子方程式
,便于运输储存。写出对应的离子方程式_______ 。
(7)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,是指每克含氯消毒剂的氧化能力相当于多少克 的氧化能力,NaClO、
的氧化能力,NaClO、 、
、 作为消毒剂,还原产物相同,这三种消毒剂的有效氯含量由大到小的顺序为
作为消毒剂,还原产物相同,这三种消毒剂的有效氯含量由大到小的顺序为_______ 。
(1)舍勒用软锰矿(主要成分为二氧化锰)为原料得到氯气,反应的化学方程式为
(2)应用以上原理制备、净化、收集氯气并进行性质检验和尾气处理,下列装置(“→”表示气流方向)不能达到实验目的的是

(3)为验证氯水中HClO分解的产物,现用强光照射氯水,并用氯离子浓度传感器、氧气传感器(测体积分数)、pH传感器等仪器进行数据采集,获得相关变化曲线如图。图中纵坐标可表示的物理量是

(4)下列物质常用于杀菌消毒,其中消毒原理与HClO相同的是_______
A. | B.酒精 | C.熟石灰 | D. |
(6)二氧化氯(
 )是常用消毒剂,但其稳定性差,通常把它通入
)是常用消毒剂,但其稳定性差,通常把它通入 和NaOH的混合溶液中,使之转化成
和NaOH的混合溶液中,使之转化成 ,便于运输储存。写出对应的离子方程式
,便于运输储存。写出对应的离子方程式(7)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,是指每克含氯消毒剂的氧化能力相当于多少克
 的氧化能力,NaClO、
的氧化能力,NaClO、 、
、 作为消毒剂,还原产物相同,这三种消毒剂的有效氯含量由大到小的顺序为
作为消毒剂,还原产物相同,这三种消毒剂的有效氯含量由大到小的顺序为
您最近一年使用:0次
名校
解题方法
2 . 钠、碳及它们的化合物在生产、生活中有着重要的用途。
(1)某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,NaN3迅速分解产生N2和Na,同时放出大量的热。N2使气囊迅速膨胀,从而起到保护作用。
① KClO4的名称是___________ ,具有___________ (填“还原性”或“氧化性”)。
② Fe2O3可处理产生的Na,反应为6Na+Fe2O3 =3Na2O+2Fe,反应中Na作___________ (填“还原剂”或“氧化剂”)。
反应过程中氧化产物与还原产物的个数比为:___________ 。
(2)Na2O2可用于呼吸面具或潜水艇中氧气的来源。某实验小组利用下图装置探究Na2O2与CO2的反应。请回答下列问题:

①根据实验目的,虚线框中的装置所用的试剂为___________ 。
②装置C中观察到的现象是___________ ,反应的化学方程式是___________ 。
③装置A的作用是制备CO2,写出A中发生反应的化学方程式是___________ 。
(1)某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,NaN3迅速分解产生N2和Na,同时放出大量的热。N2使气囊迅速膨胀,从而起到保护作用。
① KClO4的名称是
② Fe2O3可处理产生的Na,反应为6Na+Fe2O3 =3Na2O+2Fe,反应中Na作
反应过程中氧化产物与还原产物的个数比为:
(2)Na2O2可用于呼吸面具或潜水艇中氧气的来源。某实验小组利用下图装置探究Na2O2与CO2的反应。请回答下列问题:

①根据实验目的,虚线框中的装置所用的试剂为
②装置C中观察到的现象是
③装置A的作用是制备CO2,写出A中发生反应的化学方程式是
您最近一年使用:0次
2021-03-21更新
|
588次组卷
|
4卷引用:广东省顺德市李兆基中学2021-2022学年高一上学期期中考试化学试题
广东省顺德市李兆基中学2021-2022学年高一上学期期中考试化学试题重庆市南坪中学2020-2021学年高一上学期期中考试化学试题黑龙江省龙西北地区八校2020-2021学年高一下学期3月联考化学试题(已下线)专题卷三 钠及其化合物(B卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)
3 . 电化学原理在金属防腐、物质制备方面有重要的作用。
I.将裹有锌片的铁钉放入溶有琼脂的饱和NaCl溶液中,滴入少量酚酞(如下图甲所示),回答下列问题。
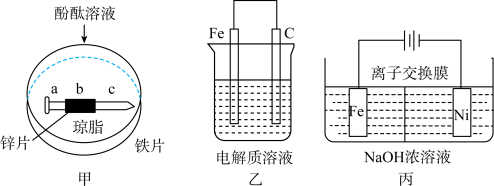
(1)一段时间后a处可能出现的现象是_______ ,请结合电化学原理解释原因________ 。
(2)某同学为验证选择的铁钉未被腐蚀,取少量溶液于试管,分别进行如表实验,能证明铁钉未被腐蚀的实验是___________ (填序号)
(3)钢铁的吸氧腐蚀简单示意图如上图乙所示,该图某处稍作修改即可成为钢铁电化学防护的简单示意图,请作出修改并标出电子流动方向___________ 。
II. 是一种既能杀菌、消毒,又能絮凝净水的水处理剂,其电解制法如上图丙所示。通电后,铁电极附近生成紫红色的
是一种既能杀菌、消毒,又能絮凝净水的水处理剂,其电解制法如上图丙所示。通电后,铁电极附近生成紫红色的 ,镍电极有气泡产生。
,镍电极有气泡产生。
已知: 只在强碱性条件下稳定,易被
只在强碱性条件下稳定,易被 还原。
还原。
(4)Fe电极发生的电极反应为:___________ 。
(5)电解过程中,须将阴极产生的气体及时排出,其原因是___________ 。
(6)该电解装置应使用___________ 离子交换膜(填“阳”或“阴”),当阴极产生112mL(标准状况)的气体时,通过离子交换膜的离子有___________ mol。
I.将裹有锌片的铁钉放入溶有琼脂的饱和NaCl溶液中,滴入少量酚酞(如下图甲所示),回答下列问题。

(1)一段时间后a处可能出现的现象是
(2)某同学为验证选择的铁钉未被腐蚀,取少量溶液于试管,分别进行如表实验,能证明铁钉未被腐蚀的实验是
| 序号 | ① | ② | ③ | ④ |
| 滴入试剂 |  溶液 溶液 | 淀粉KI溶液 | KSCN溶液 |  溶液 溶液 |
| 实验现象 | 产生沉淀 | 无蓝色出现 | 无红色出现 | 无蓝色沉淀 |
(3)钢铁的吸氧腐蚀简单示意图如上图乙所示,该图某处稍作修改即可成为钢铁电化学防护的简单示意图,请作出修改并标出电子流动方向
II.
 是一种既能杀菌、消毒,又能絮凝净水的水处理剂,其电解制法如上图丙所示。通电后,铁电极附近生成紫红色的
是一种既能杀菌、消毒,又能絮凝净水的水处理剂,其电解制法如上图丙所示。通电后,铁电极附近生成紫红色的 ,镍电极有气泡产生。
,镍电极有气泡产生。已知:
 只在强碱性条件下稳定,易被
只在强碱性条件下稳定,易被 还原。
还原。(4)Fe电极发生的电极反应为:
(5)电解过程中,须将阴极产生的气体及时排出,其原因是
(6)该电解装置应使用
您最近一年使用:0次
4 . 现有甲、乙、丙三名同学分别进行Fe(OH)3胶体的制备实验。
甲同学:向饱和FeCl3溶液中加少量NaOH溶液。
乙同学:直接加热饱和FeCl3溶液。
丙同学:向25mL沸水中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至溶液呈红褐色,停止加热。
回答下列问题:
(1)其中操作正确的同学是________ (填“甲”“乙”或“丙”),写出制备Fe(OH)3胶体的化学反应方程式________ 。
(2)证明有Fe(OH)3胶体生成的实验操作是用一束强光从侧面照射,观察现象,该过程利用的胶体性质是________ 。
(3)丁同学取适量的Fe(OH)3胶体注入试管,然后用胶头滴管逐滴向试管中加入过量稀硫酸,观察到现象为________ 。
(4)戊同学认为制备的Fe(OH)3胶体中混有FeCl3杂质,采用如图所示装置进行提纯,该操作方法名称为________ (填“过滤”或“渗析”)。

(5)放置2min后,取少量半透膜外的液体于试管中,置于暗处,用一束强光从侧面照射,观察________ (填“有”或“无”)丁达尔现象,再向试管中加入用稀硝酸酸化的AgNO3溶液,可观察到________ (填“有”或“无”)白色沉淀生成。(已知胶体不能透过半透膜)
甲同学:向饱和FeCl3溶液中加少量NaOH溶液。
乙同学:直接加热饱和FeCl3溶液。
丙同学:向25mL沸水中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至溶液呈红褐色,停止加热。
回答下列问题:
(1)其中操作正确的同学是
(2)证明有Fe(OH)3胶体生成的实验操作是用一束强光从侧面照射,观察现象,该过程利用的胶体性质是
(3)丁同学取适量的Fe(OH)3胶体注入试管,然后用胶头滴管逐滴向试管中加入过量稀硫酸,观察到现象为
(4)戊同学认为制备的Fe(OH)3胶体中混有FeCl3杂质,采用如图所示装置进行提纯,该操作方法名称为

(5)放置2min后,取少量半透膜外的液体于试管中,置于暗处,用一束强光从侧面照射,观察
您最近一年使用:0次
5 . 乙醇、乙二醇等醇类物质是重要的有机化工原料。回答下列问题:
I.工业上可用乙烯水合法生产乙醇
第一步:反应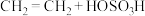 (浓硫酸)
(浓硫酸)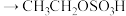 (硫酸氢乙酯);
(硫酸氢乙酯);
第二步:硫酸氢乙酯水解生成乙醇。
(1)第一步属于___________ (填反应类型)。
(2)第二步反应的化学方程式为___________ 。
Ⅱ.以乙醇为原料可制备某种高分子涂料,其转化关系如下图:
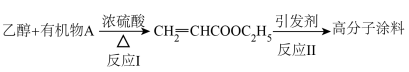
(3)有机物A的结构简式为___________ 。
(4)反应Ⅱ的化学方程式为___________ 。
(5)一定条件下,醇可发生分子间脱水反应可生成醚(R-O-R′,R、R′表示烃基),请写出乙二醇( )在一定条件下生成环状醚的结构简式为
)在一定条件下生成环状醚的结构简式为___________ 。
Ⅲ.某学习小组设计乙醇的催化氧化的实验装置如图所示,试回答下列问题。

(6)甲的锥形瓶中盛放的固体药品可能为___________(填字母)。
(7)实验过程中,丙装置硬质玻璃管中发生反应的化学方程式为___________ 。
(8)己醇的催化氧化产物与葡萄糖具有相同的特征反应,将所得的氧化产物与新制氢氧化铜悬浊液混合后加热,现象为___________ 。
I.工业上可用乙烯水合法生产乙醇
第一步:反应
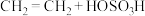 (浓硫酸)
(浓硫酸)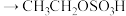 (硫酸氢乙酯);
(硫酸氢乙酯);第二步:硫酸氢乙酯水解生成乙醇。
(1)第一步属于
(2)第二步反应的化学方程式为
Ⅱ.以乙醇为原料可制备某种高分子涂料,其转化关系如下图:
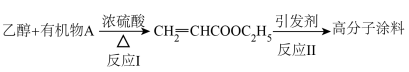
(3)有机物A的结构简式为
(4)反应Ⅱ的化学方程式为
(5)一定条件下,醇可发生分子间脱水反应可生成醚(R-O-R′,R、R′表示烃基),请写出乙二醇(
 )在一定条件下生成环状醚的结构简式为
)在一定条件下生成环状醚的结构简式为Ⅲ.某学习小组设计乙醇的催化氧化的实验装置如图所示,试回答下列问题。

(6)甲的锥形瓶中盛放的固体药品可能为___________(填字母)。
A. | B. | C. | D. |
(8)己醇的催化氧化产物与葡萄糖具有相同的特征反应,将所得的氧化产物与新制氢氧化铜悬浊液混合后加热,现象为
您最近一年使用:0次
6 . 有下列物质:①硫酸 ② 溶液 ③
溶液 ③ ④小苏打 ⑤纯碱 ⑥
④小苏打 ⑤纯碱 ⑥ ⑦明矾。回答下列问题:
⑦明矾。回答下列问题:
(1)将上述物质按下图进行分类。
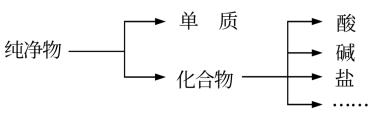
图中所示所属的分类方法为_______ 。
(2)纯碱是重要的化工原料之一,写出其在水中的电离方程式:_______ 。
(3)明矾 [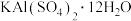 ]是常见的净水剂,属于
]是常见的净水剂,属于_______ (填“酸”“碱”或“盐”),实验室利用明矾制备 的离子方程式为
的离子方程式为_______ 。
(4)取 溶液做导电性实验,往烧杯中滴加
溶液做导电性实验,往烧杯中滴加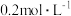 稀硫酸。装置如图1,测得溶液电导率如图2所示。
稀硫酸。装置如图1,测得溶液电导率如图2所示。

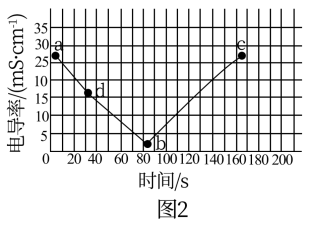
①由 过程中,可观察到的现象有
过程中,可观察到的现象有_______ ,发生反应的离子方程式为_______ 。
②b点时加入 溶液的体积为
溶液的体积为_______  。
。
 溶液 ③
溶液 ③ ④小苏打 ⑤纯碱 ⑥
④小苏打 ⑤纯碱 ⑥ ⑦明矾。回答下列问题:
⑦明矾。回答下列问题:(1)将上述物质按下图进行分类。

图中所示所属的分类方法为
(2)纯碱是重要的化工原料之一,写出其在水中的电离方程式:
(3)明矾 [
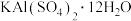 ]是常见的净水剂,属于
]是常见的净水剂,属于 的离子方程式为
的离子方程式为(4)取
 溶液做导电性实验,往烧杯中滴加
溶液做导电性实验,往烧杯中滴加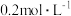 稀硫酸。装置如图1,测得溶液电导率如图2所示。
稀硫酸。装置如图1,测得溶液电导率如图2所示。

①由
 过程中,可观察到的现象有
过程中,可观察到的现象有②b点时加入
 溶液的体积为
溶液的体积为 。
。
您最近一年使用:0次
2022-01-24更新
|
94次组卷
|
2卷引用:广东省茂名高州市2021-2022学年高一上学期期末考试化学试题
解题方法
7 . 根据下列实验设计,回答问题:
(1)利用实验(Ⅰ)探究锌与0.1mol/L硫酸和2mol/L硫酸反应的速率,可以测定收集一定体积氢气所用的时间。此方法需要控制的变量有(写出1项):___________ 。
(2)实验(Ⅱ)探究浓度对化学化学平衡的影响。
已知:Cr2O (橙色)+H2O
(橙色)+H2O 2CrO
2CrO (黄色)+2H+
(黄色)+2H+
推测D试管中实验现象为___________ ,用平衡移动原理解释原因:___________ 。
(3)实验(Ⅲ)目的是探究浓度对反应速率的影响,实验中反应离子方程式为___________ ,推测该实验设计___________ (填“能”或“不能”)达到实验目的,判断理由是___________ 。
(4)某小组也用酸性KMnO4溶液和草酸(H2C2O4)溶液进行实验,实验操作及现象如下表:
由实验ⅰ、实验ⅱ可得出的结论是___________ 。

(1)利用实验(Ⅰ)探究锌与0.1mol/L硫酸和2mol/L硫酸反应的速率,可以测定收集一定体积氢气所用的时间。此方法需要控制的变量有(写出1项):
(2)实验(Ⅱ)探究浓度对化学化学平衡的影响。
已知:Cr2O
 (橙色)+H2O
(橙色)+H2O 2CrO
2CrO (黄色)+2H+
(黄色)+2H+推测D试管中实验现象为
(3)实验(Ⅲ)目的是探究浓度对反应速率的影响,实验中反应离子方程式为
(4)某小组也用酸性KMnO4溶液和草酸(H2C2O4)溶液进行实验,实验操作及现象如下表:
| 编号 | 实验操作 | 实验现象 |
| ⅰ | 向一支试管中先加入5mL0.01mol/L酸性KMnO4溶液,再加入1滴3mol/L硫酸和9滴蒸馏水,最后加入5mL0.1mol/L草酸溶液 | 前10min内溶液紫色无明显变化,后颜色逐渐变浅,30min后几乎变为无色 |
| ⅱ | 向另一支试管中先加入5mL0.01mol/L酸性KMnO4溶液,再加入10滴3mol/L硫酸,最后加入5mL0.1mol/L草酸溶液 | 80s内溶液紫色无明显变化,后颜色迅速变浅,约150s后几乎变为无色 |
由实验ⅰ、实验ⅱ可得出的结论是
您最近一年使用:0次
解题方法
8 . 硫、氮、碳的氧化物都会引起环境问题,越来越引起人们的重视,如图1是氮元素的各种价态与物质类别的对应关系
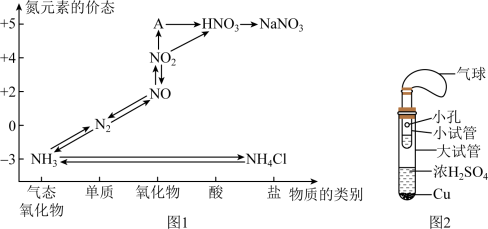
(1)根据A对应的化合价和物质类别,A为_________ (写分子式),从氦元素的化合价能否发生变化的角度判断,图1中既有氧化性又有还原性的化合物是_________ ;
(2)浓、稀硝酸的性质相似又有差别,若要除去铁制品表面的铜镀层应选择,反应的化学方程式为_________________ ;
(3)某同学设计了如图2所示的套管实验装置(部分装置未画出)来制备SO2,并利用实验现象来检验其还原性,制备SO2时选用的试剂为Cu和浓H2SO4,回答下列问题.
①写出制取SO2的化学方程式___________________ ;
②该同学利用实验现象来检验SO2的还原性,则选用的试剂为__________ ;
A 双氧水(H2O2) B品红溶液 C 酸性高锰酸钾溶液
(4)工业上把海水先进行氧化,再吸收溴,达到富集溴的目的.吸收工艺常用的方法是用热空气吹出Br2,用SO2吸收Br2,取吸收后的溶液,向其中加入氯化钠溶液有白色沉淀析出,写出SO2吸收Br2反应的化学方程式______________ 。

(1)根据A对应的化合价和物质类别,A为
(2)浓、稀硝酸的性质相似又有差别,若要除去铁制品表面的铜镀层应选择,反应的化学方程式为
(3)某同学设计了如图2所示的套管实验装置(部分装置未画出)来制备SO2,并利用实验现象来检验其还原性,制备SO2时选用的试剂为Cu和浓H2SO4,回答下列问题.
①写出制取SO2的化学方程式
②该同学利用实验现象来检验SO2的还原性,则选用的试剂为
A 双氧水(H2O2) B品红溶液 C 酸性高锰酸钾溶液
(4)工业上把海水先进行氧化,再吸收溴,达到富集溴的目的.吸收工艺常用的方法是用热空气吹出Br2,用SO2吸收Br2,取吸收后的溶液,向其中加入氯化钠溶液有白色沉淀析出,写出SO2吸收Br2反应的化学方程式
您最近一年使用:0次
解题方法
9 . 某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如Ⅰ~Ⅳ所示(部分夹持装置已略去)
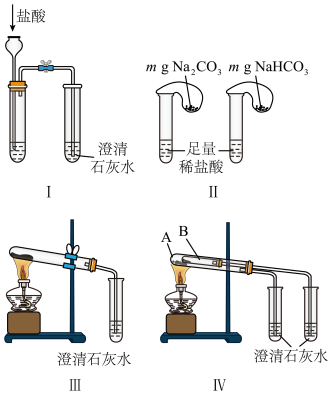
(1)图Ⅰ、Ⅱ所示实验中能够达到实验目的的是_______ (填序号)。
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式为_______ 。
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是_______ (填化学式)。
(4)将碳酸氢钠溶液与澄清石灰水混合并充分反应。当碳酸氢钠与氢氧化钙的物质的量之比为2:1时,所得溶液中溶质的化学式为_______ ,请设计实验检验所得溶液中溶质的阴离子_______

(1)图Ⅰ、Ⅱ所示实验中能够达到实验目的的是
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式为
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是
(4)将碳酸氢钠溶液与澄清石灰水混合并充分反应。当碳酸氢钠与氢氧化钙的物质的量之比为2:1时,所得溶液中溶质的化学式为
您最近一年使用:0次
名校
10 . 铁的化合物在水溶液中呈现丰富的颜色,这与其水解平衡和配位平衡有关。
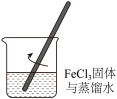
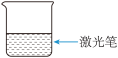
(1)下列为用氯化铁固体制备氢氧化铁胶体的相关实验,可以达到实验目的的是___________。
(2)实验室用 溶液制备
溶液制备 胶体的化学反应方程式为
胶体的化学反应方程式为___________ 。
(3)实验小组为探究溶液 对
对 水解平衡的影响,在常温下设计了下列实验,通过测定透光率进行研究。
水解平衡的影响,在常温下设计了下列实验,通过测定透光率进行研究。
已知:① 水解程度越大,颜色越深
水解程度越大,颜色越深
②颜色越深,透光率越低
①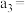
___________ ,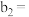
___________ 。
②由
___________  ,可证明:
,可证明: 减小,
减小, 的水解平衡逆向移动。(选填“>”“<”或“=”)
的水解平衡逆向移动。(选填“>”“<”或“=”)
③分析实验结果: ,同学甲推测原因可能是:
,同学甲推测原因可能是: (较深的黄色),并做了如下实验:
(较深的黄色),并做了如下实验:
试剂 为
为___________ ,可由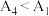 ,证实同学甲的推测。
,证实同学甲的推测。
通过对比___________ (填字母)的实验结果,证明 对
对 的水解平衡的影响。
的水解平衡的影响。
A.组别4与组别1 B.组别4与组别2 C.组别4与组别3
(4)为了探究 的热效应,同学乙设计了下列四组实验方案:
的热效应,同学乙设计了下列四组实验方案:
若实验结果为___________ ,则可证明: 为吸热反应。
为吸热反应。
(5)写出一种强酸弱碱盐(除 )及其用途:
)及其用途:___________ 。
(1)下列为用氯化铁固体制备氢氧化铁胶体的相关实验,可以达到实验目的的是___________。
| A | B | C | D |
配制 溶液 溶液 | 制备 胶体 胶体 | 观察胶体的丁达尔效应 | 分离 胶体与溶液 胶体与溶液 |
 |  |  |  |
| A.A | B.B | C.C | D.D |
 溶液制备
溶液制备 胶体的化学反应方程式为
胶体的化学反应方程式为(3)实验小组为探究溶液
 对
对 水解平衡的影响,在常温下设计了下列实验,通过测定透光率进行研究。
水解平衡的影响,在常温下设计了下列实验,通过测定透光率进行研究。已知:①
 水解程度越大,颜色越深
水解程度越大,颜色越深②颜色越深,透光率越低
| 组别 |  溶液 溶液 | 蒸馏水 | 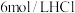 溶液 溶液 | 透光率 |
| 1 |  |  | 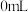 |  |
| 2 |  |  | 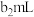 |  |
| 3 |  |  |  |  |
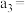
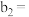
②由

 ,可证明:
,可证明: 减小,
减小, 的水解平衡逆向移动。(选填“>”“<”或“=”)
的水解平衡逆向移动。(选填“>”“<”或“=”)③分析实验结果:
 ,同学甲推测原因可能是:
,同学甲推测原因可能是: (较深的黄色),并做了如下实验:
(较深的黄色),并做了如下实验:| 组别 |  溶液 溶液 | 蒸馏水 | 试剂 | 透光率 |
| 4 |  |  |  |  |
 为
为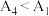 ,证实同学甲的推测。
,证实同学甲的推测。通过对比
 对
对 的水解平衡的影响。
的水解平衡的影响。A.组别4与组别1 B.组别4与组别2 C.组别4与组别3
(4)为了探究
 的热效应,同学乙设计了下列四组实验方案:
的热效应,同学乙设计了下列四组实验方案:| 组别 | 温度 | 试剂 | 透光率 |
| 5 |  |  溶液 溶液 | 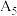 |
| 6 |  |  溶液 溶液 | 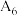 |
| 7 |  | 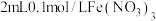 溶液 溶液 | 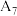 |
| 8 |  | 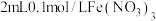 溶液 溶液 | 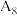 |
 为吸热反应。
为吸热反应。(5)写出一种强酸弱碱盐(除
 )及其用途:
)及其用途:
您最近一年使用:0次
2023-05-29更新
|
621次组卷
|
3卷引用:广东省华南师范大学附属中学2023届高三下学期第三次模拟考试化学试题



