名校
解题方法
1 . 钠、碳及它们的化合物在生产、生活中有着重要的用途。
(1)某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,NaN3迅速分解产生N2和Na,同时放出大量的热。N2使气囊迅速膨胀,从而起到保护作用。
① KClO4的名称是___________ ,具有___________ (填“还原性”或“氧化性”)。
② Fe2O3可处理产生的Na,反应为6Na+Fe2O3 =3Na2O+2Fe,反应中Na作___________ (填“还原剂”或“氧化剂”)。
反应过程中氧化产物与还原产物的个数比为:___________ 。
(2)Na2O2可用于呼吸面具或潜水艇中氧气的来源。某实验小组利用下图装置探究Na2O2与CO2的反应。请回答下列问题:

①根据实验目的,虚线框中的装置所用的试剂为___________ 。
②装置C中观察到的现象是___________ ,反应的化学方程式是___________ 。
③装置A的作用是制备CO2,写出A中发生反应的化学方程式是___________ 。
(1)某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,NaN3迅速分解产生N2和Na,同时放出大量的热。N2使气囊迅速膨胀,从而起到保护作用。
① KClO4的名称是
② Fe2O3可处理产生的Na,反应为6Na+Fe2O3 =3Na2O+2Fe,反应中Na作
反应过程中氧化产物与还原产物的个数比为:
(2)Na2O2可用于呼吸面具或潜水艇中氧气的来源。某实验小组利用下图装置探究Na2O2与CO2的反应。请回答下列问题:

①根据实验目的,虚线框中的装置所用的试剂为
②装置C中观察到的现象是
③装置A的作用是制备CO2,写出A中发生反应的化学方程式是
您最近一年使用:0次
2021-03-21更新
|
588次组卷
|
4卷引用:重庆市南坪中学2020-2021学年高一上学期期中考试化学试题
重庆市南坪中学2020-2021学年高一上学期期中考试化学试题(已下线)专题卷三 钠及其化合物(B卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)黑龙江省龙西北地区八校2020-2021学年高一下学期3月联考化学试题广东省顺德市李兆基中学2021-2022学年高一上学期期中考试化学试题
2016高二·全国·课时练习
2 . 1乙氧基萘是一种无色液体,密度比水的大,不溶于水,易溶于乙醇,熔点为5.5℃,沸点为267℃。1萘酚(性质与苯酚相似)的熔点为96℃,沸点为278℃,微溶于水,易溶于乙醇。乙醇的沸点为78.5℃。1乙氧基萘常用作香料,也可合成其他香料。实验室制备1乙氧基萘的反应原理如下:
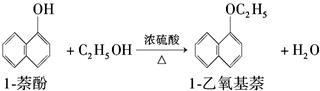
(1)将72g1萘酚溶于100mL无水乙醇中,再加入5mL浓硫酸。将混合溶液置于如图所示的圆底烧瓶中加热充分反应。实验中使用过量乙醇的原因是________ 。烧瓶上连接长玻璃管的主要作用是________________ 。
(2)反应结束后将烧瓶中的液体倒入冷水中,经处理得到有机层。为提纯产物有以下四步操作:①蒸馏;②水洗并分液;③用10%的NaOH溶液洗并分液;④用无水氯化钙干燥并过滤。正确的顺序是________ (填序号)。
A.③②④① B.①②③④ C.②①③④
(3)实验测得1乙氧基萘的产量与反应时间、温度的关系如图所示,时间延长、温度升高,1乙氧基萘的产量下降的原因可能是__________ 、____________ 。

(4)某同学推测经提纯的产品可能还含有1萘酚、乙醇、硫酸和水等杂质,设计了如下方案进行检验,请完成表中内容。

(1)将72g1萘酚溶于100mL无水乙醇中,再加入5mL浓硫酸。将混合溶液置于如图所示的圆底烧瓶中加热充分反应。实验中使用过量乙醇的原因是

(2)反应结束后将烧瓶中的液体倒入冷水中,经处理得到有机层。为提纯产物有以下四步操作:①蒸馏;②水洗并分液;③用10%的NaOH溶液洗并分液;④用无水氯化钙干燥并过滤。正确的顺序是
A.③②④① B.①②③④ C.②①③④
(3)实验测得1乙氧基萘的产量与反应时间、温度的关系如图所示,时间延长、温度升高,1乙氧基萘的产量下降的原因可能是

(4)某同学推测经提纯的产品可能还含有1萘酚、乙醇、硫酸和水等杂质,设计了如下方案进行检验,请完成表中内容。
| 实验目的 | 实验操作 | 预期现象和结论 |
| ①用金属钠检验1乙氧基萘是否纯净 | 取少量经提纯的产品于试管A中,加入金属钠 | 若 若 |
| ②检验经提纯的产品是否含有1萘酚 | 若 若 |
您最近一年使用:0次
3 . 为探究铜与稀硝酸反应的产物及影响反应速率的主要因素,进行如下实验。
实验一 探究铜与稀硝酸反应的产物实验装置如图所示,气密性已检查。
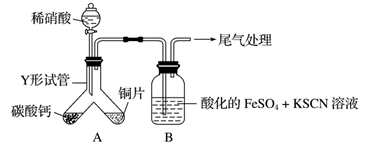
已知:FeSO4+NO===[Fe(NO)]SO4,该反应较缓慢,待生成一定量[Fe(NO)]2+时突显明显
棕色。
(1)实验开始时先将Y形试管向盛有碳酸钙的支管倾斜,缓慢滴入稀硝酸,该实验操作的目的是___________________________________________________________ 。
(2)铜片和稀硝酸反应的化学方程式为____________________________________ 。
(3)本实验A生成的气体中,若有NO2,则B的实验现象为__________________ ;
若只有NO生成,则B的实验现象是_________________ 。
实验二 探究化学反应产物对反应速率的影响
设计如下实验,利用上图装置测定溶液突显明显棕色的时间。
(4)请将上表中实验1的实验条件填写完整。
①________ ,②________ ,③________ 。
(5)通过实验发现实验1、2、3的反应速率并无明显变化,为达到实验目的还需要继续进行的实验是_______________________________________________________ 。
实验一 探究铜与稀硝酸反应的产物实验装置如图所示,气密性已检查。

已知:FeSO4+NO===[Fe(NO)]SO4,该反应较缓慢,待生成一定量[Fe(NO)]2+时突显明显
棕色。
(1)实验开始时先将Y形试管向盛有碳酸钙的支管倾斜,缓慢滴入稀硝酸,该实验操作的目的是
(2)铜片和稀硝酸反应的化学方程式为
(3)本实验A生成的气体中,若有NO2,则B的实验现象为
若只有NO生成,则B的实验现象是
实验二 探究化学反应产物对反应速率的影响
设计如下实验,利用上图装置测定溶液突显明显棕色的时间。
| 序号 | 温度 | 铜片/(g) | 硝酸/mL | 硝酸铜/g |
| 1 | 25 ℃ | ① | ② | ③ |
| 2 | 25 ℃ | 5 | 20 | 0.5 |
| 3 | 25 ℃ | 5 | 20 | 1.0 |
(4)请将上表中实验1的实验条件填写完整。
①
(5)通过实验发现实验1、2、3的反应速率并无明显变化,为达到实验目的还需要继续进行的实验是
您最近一年使用:0次
2024高三下·全国·专题练习
4 . 二氧化氯(ClO2)与亚氯酸钠(NaClO2)都具有强氧化性。两者作漂白剂时,不伤害织物;作饮用水消毒剂时,不残留异味。某研究性学习小组利用如图装置由二氧化氯制备NaClO2·3H2O,并探究其性质。
①ClO2易与碱反应生成亚氯酸盐和氯酸盐。
②NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
利用题中原理制备出NaClO2·3H2O晶体的试样,可以用“间接碘量法”测定试样(杂质与I-不发生反应)的纯度,过程如下:(已知:I2+2 =
=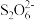 +2I-)取样品0.6000g于锥形瓶中,加入足量KI固体和适量稀H2SO4,再滴加几滴淀粉溶液,然后用0.5000mol·L-1Na2S2O3标准溶液滴定,当出现
+2I-)取样品0.6000g于锥形瓶中,加入足量KI固体和适量稀H2SO4,再滴加几滴淀粉溶液,然后用0.5000mol·L-1Na2S2O3标准溶液滴定,当出现_______ (填实验现象),达到滴定终点,共消耗该标准溶液25.00mL,经计算该试样中NaClO2·3H2O的百分含量为_______ (结果保留3位有效数字)。
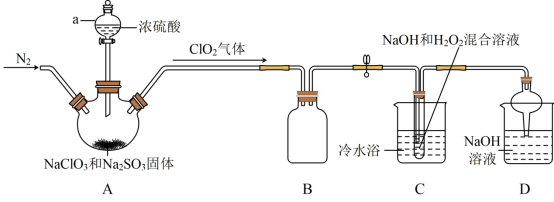
①ClO2易与碱反应生成亚氯酸盐和氯酸盐。
②NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
利用题中原理制备出NaClO2·3H2O晶体的试样,可以用“间接碘量法”测定试样(杂质与I-不发生反应)的纯度,过程如下:(已知:I2+2
 =
=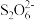 +2I-)取样品0.6000g于锥形瓶中,加入足量KI固体和适量稀H2SO4,再滴加几滴淀粉溶液,然后用0.5000mol·L-1Na2S2O3标准溶液滴定,当出现
+2I-)取样品0.6000g于锥形瓶中,加入足量KI固体和适量稀H2SO4,再滴加几滴淀粉溶液,然后用0.5000mol·L-1Na2S2O3标准溶液滴定,当出现
您最近一年使用:0次
5 . 海洋蕴藏着中极为丰富的化学资源,如海水中就有80多种元素,所含的盐大部分是氯化钠。十九世纪末工业上开始通过电解饱和食盐水的方法制备氯气、氨气和烧碱,并以它们为原料生产一系列含氯、含钠产品(氯碱工业),请回答下列问题:
(1)天原化工厂是我国最早的氯碱企业,其创始人是______(单选)
(2)电解饱和食盐水时,与电源正极相连的电极叫阳极,阳极产物是氯气,可以用______ 检验,现象为______ ,写出检验氯气的离子方程式_____________________
(3)工业上用氯气与消石灰制成漂白粉,漂白粉的有效成分为______(单选)
(4)新制氧水呈浅黄绿色,是因为氯水中存在______(单选)
(5)有两组学生根据不同的反应原理在实验室制取氯气。

①请按要求填表。
②有同学建议第一组使用图所示装置作为氯气的发生装置,请谈谈你的看法______ 。
氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用如图表示。
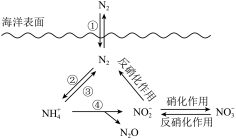
(6)海洋中的氮循环属于固氮作用的一步是______ (填图中的数字序号)。
(7)下列关于海洋氮循环的说法正确的是______(双选)。
(8)有氧时,在硝化细菌作用下, 可实现过程④的转化,方程式如下,请标出该反应的电子转移的方向与数目。
可实现过程④的转化,方程式如下,请标出该反应的电子转移的方向与数目。_______ 。

(9)有人研究了温度对海洋硝化细菌去除氯氮效果的影响.下表为对 人工海水样本的监测数据.硝化细菌去除氨氮的最佳反应温度是
人工海水样本的监测数据.硝化细菌去除氨氮的最佳反应温度是______ ,在最佳反应温度时, 内去除氨氮反应的平均速率是
内去除氨氮反应的平均速率是____ 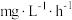 。
。
(1)天原化工厂是我国最早的氯碱企业,其创始人是______(单选)
| A.侯德榜 | B.吴蕴初 | C.荣毅仁 | D.戴安邦 |
(3)工业上用氯气与消石灰制成漂白粉,漂白粉的有效成分为______(单选)
A. | B. | C. | D. |
A. | B. | C. | D. |

①请按要求填表。
实验组 | 实验原理 | 发生装置(填编号) |
第一组 |  | |
第二组 | 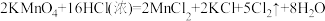 |

氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用如图表示。

(6)海洋中的氮循环属于固氮作用的一步是
(7)下列关于海洋氮循环的说法正确的是______(双选)。
| A.海洋中存在游离态的氮 |
| B.海洋中的氮循环起始于氮的氧化 |
C.向海洋排放含 的废水会影响海洋中 的废水会影响海洋中 的含量 的含量 |
| D.海洋中的反硝化作用一定有氧气的参与 |
 可实现过程④的转化,方程式如下,请标出该反应的电子转移的方向与数目。
可实现过程④的转化,方程式如下,请标出该反应的电子转移的方向与数目。
(9)有人研究了温度对海洋硝化细菌去除氯氮效果的影响.下表为对
 人工海水样本的监测数据.硝化细菌去除氨氮的最佳反应温度是
人工海水样本的监测数据.硝化细菌去除氨氮的最佳反应温度是 内去除氨氮反应的平均速率是
内去除氨氮反应的平均速率是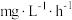 。
。温度/ | 样本氨氮含量/ | 处理 | 处理 |
氨氮含量/ | 氨氮含量/ | ||
20 | 1008 | 838 | 788 |
25 | 1008 | 757 | 468 |
30 | 1008 | 798 | 600 |
40 | 1008 | 977 | 910 |
您最近一年使用:0次
6 . 磷酸氢二铵[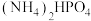 ]常用于干粉灭火剂。某研究小组用磷酸吸收氨气制备
]常用于干粉灭火剂。某研究小组用磷酸吸收氨气制备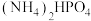 ,装置如图所示(夹持和搅拌装置已省略)。
,装置如图所示(夹持和搅拌装置已省略)。
(1)装置中活塞 的作用为
的作用为_______ 。实验过程中,当出现_______ 现象时,应及时关闭 ,打开
,打开 。
。
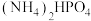 ]常用于干粉灭火剂。某研究小组用磷酸吸收氨气制备
]常用于干粉灭火剂。某研究小组用磷酸吸收氨气制备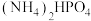 ,装置如图所示(夹持和搅拌装置已省略)。
,装置如图所示(夹持和搅拌装置已省略)。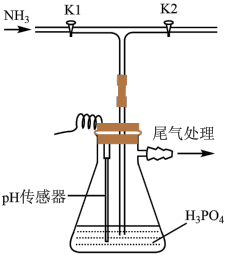
(1)装置中活塞
 的作用为
的作用为 ,打开
,打开 。
。
您最近一年使用:0次
2024高三下·全国·专题练习
7 . 学习小组利用废银催化剂制备乙炔银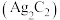 和酸性乙炔银
和酸性乙炔银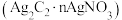 。已知乙炔银和酸性乙炔银在受热时均易发生分解。
。已知乙炔银和酸性乙炔银在受热时均易发生分解。
①制取乙炔。利用如图装置制取纯净的乙炔。 的溶液中通入乙炔可得到乙炔银沉淀。
的溶液中通入乙炔可得到乙炔银沉淀。
(1)将过滤所得滤渣置于小烧杯中,利用丙酮反复多次冲洗沉淀。检验滤渣已经洗净的实验方案是_______ 。
(2)准确称取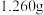 样品,用浓硝酸完全溶解后,定容得
样品,用浓硝酸完全溶解后,定容得 溶液,取
溶液,取 于锥形瓶中,以
于锥形瓶中,以 作指示剂,用
作指示剂,用 标准溶液进行滴定
标准溶液进行滴定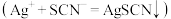 ,终点时消耗标准溶液的体积为
,终点时消耗标准溶液的体积为 。
。
滴定终点的现象为_______ 。通过计算确定n的数值_______ (写出计算过程)。
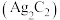 和酸性乙炔银
和酸性乙炔银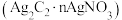 。已知乙炔银和酸性乙炔银在受热时均易发生分解。
。已知乙炔银和酸性乙炔银在受热时均易发生分解。①制取乙炔。利用如图装置制取纯净的乙炔。
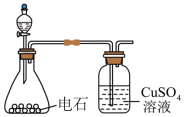
 的溶液中通入乙炔可得到乙炔银沉淀。
的溶液中通入乙炔可得到乙炔银沉淀。(1)将过滤所得滤渣置于小烧杯中,利用丙酮反复多次冲洗沉淀。检验滤渣已经洗净的实验方案是
(2)准确称取
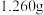 样品,用浓硝酸完全溶解后,定容得
样品,用浓硝酸完全溶解后,定容得 溶液,取
溶液,取 于锥形瓶中,以
于锥形瓶中,以 作指示剂,用
作指示剂,用 标准溶液进行滴定
标准溶液进行滴定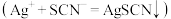 ,终点时消耗标准溶液的体积为
,终点时消耗标准溶液的体积为 。
。滴定终点的现象为
您最近一年使用:0次
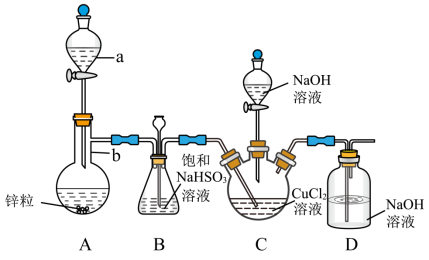
8 . CuCl是一种难溶于水和乙醇的白色固体,可溶于浓盐酸或者浓氨水(形成络合物),易被氧化为高价绿色铜盐,见光受热易分解。在催化领域广泛应用,纺织工业中常作脱色剂,可利用如图装置(夹持装置略去)将SO2通入新制氢氧化铜悬浊液中制备CuCl。
①向C中先加入10.00mL0.5mol•L-1CuCl2溶液,再加入30mL0.6mol•L-1NaOH溶液;
②取下A中分液漏斗上的玻璃塞,然后打开分液漏斗的活塞,产生SO2气体至过量,直至C中出现较多的白色沉淀,上层是淡绿色的溶液;
③将C中混合物过滤,依次用水和乙醇洗涤低温晾干,精确称量所得固体质量为0.398g。
回答下列问题:
(1)针对步骤2中的现象查阅资料得知:
i.白色沉淀为CuCl;
ii.上层淡绿色溶液中的主要溶质为NaCl和少量Cu(HSO3)2。
结论:本实验中较多量的新制氢氧化铜与二氧化硫发生了氧化还原反应,少量与之发生了复分解反应,二者为竞争关系。检验淡绿色溶液中含有 的操作方法是
的操作方法是_______ 。
①向C中先加入10.00mL0.5mol•L-1CuCl2溶液,再加入30mL0.6mol•L-1NaOH溶液;
②取下A中分液漏斗上的玻璃塞,然后打开分液漏斗的活塞,产生SO2气体至过量,直至C中出现较多的白色沉淀,上层是淡绿色的溶液;
③将C中混合物过滤,依次用水和乙醇洗涤低温晾干,精确称量所得固体质量为0.398g。
回答下列问题:
(1)针对步骤2中的现象查阅资料得知:
i.白色沉淀为CuCl;
ii.上层淡绿色溶液中的主要溶质为NaCl和少量Cu(HSO3)2。
结论:本实验中较多量的新制氢氧化铜与二氧化硫发生了氧化还原反应,少量与之发生了复分解反应,二者为竞争关系。检验淡绿色溶液中含有
 的操作方法是
的操作方法是
您最近一年使用:0次
解题方法
9 . 铁及其化合物在日常生产生活中有着广泛应用。
I.在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。现设计如下装置完成高温下“Fe与水蒸气反应”的实验,并检验其产物(已知:Fe3O4中Fe的化合价为+2价、+3价)。
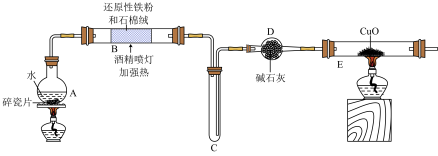
(1)装置B中发生反应的化学方程式为___________ 。
(2)装置C中导管“短进长出”的原因___________ 。
(3)取反应后得到的黑色粉末放入一试管中,加入稀硫酸将固体溶解,再滴加几滴KSCN溶液,振荡,溶液没有出现红色,原因是___________ (用离子方程式表示)。
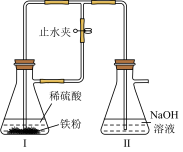
Ⅱ.某学生设计了如图装置制备白色Fe(OH)2固体。
(4)配置NaOH溶液和稀硫酸时,需将所用蒸馏水加热煮沸后,冷却至室温再用于配置,加热煮沸的目的是___________ 。
(5)开始实验时,先打开止水夹,待装置中空气已排尽,再关闭止水夹。
①关闭止水夹前,请设计实验证明装置中空气已排尽:___________ 。
②装置Ⅱ中发生反应的主要化学方程式为___________ 。
③若未排净装置中的空气,则装置Ⅱ中观察到的实验现象为___________ 。
I.在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。现设计如下装置完成高温下“Fe与水蒸气反应”的实验,并检验其产物(已知:Fe3O4中Fe的化合价为+2价、+3价)。

(1)装置B中发生反应的化学方程式为
(2)装置C中导管“短进长出”的原因
(3)取反应后得到的黑色粉末放入一试管中,加入稀硫酸将固体溶解,再滴加几滴KSCN溶液,振荡,溶液没有出现红色,原因是
Ⅱ.某学生设计了如图装置制备白色Fe(OH)2固体。

(4)配置NaOH溶液和稀硫酸时,需将所用蒸馏水加热煮沸后,冷却至室温再用于配置,加热煮沸的目的是
(5)开始实验时,先打开止水夹,待装置中空气已排尽,再关闭止水夹。
①关闭止水夹前,请设计实验证明装置中空气已排尽:
②装置Ⅱ中发生反应的主要化学方程式为
③若未排净装置中的空气,则装置Ⅱ中观察到的实验现象为
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
10 . 海洋蕴藏着中极为丰富的化学资源,如海水中就有80多种元素,所含的盐大部分是氯化钠。十九世纪末工业上开始通过电解饱和食盐水的方法制备氯气、氨气和烧碱,并以它们为原料生产一系列含氯、含钠产品(氯碱工业),请回答下列问题:
(1)天原化工厂是我国最早的氯碱企业,其创始人是___________(单选)
(2)电解饱和食盐水时,与电源正极相连的电极叫阳极,阳极产物是氯气,可以用___________ 检验,现象为___________ ,写出检验氯气的离子方程式___________
(3)工业上用氯气与消石灰制成漂白粉,漂白粉的有效成分为___________(单选)
(4)新制氯水呈浅黄绿色,是因为氯水中存在___________(单选)
(5)有两组学生根据不同的反应原理在实验室制取氯气。
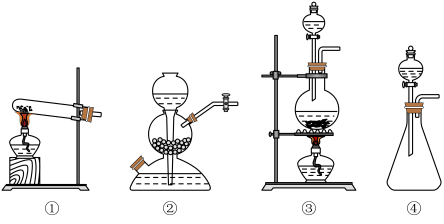
①请按要求填表。
②有同学建议第一组使用图所示装置作为氯气的发生装置,请谈谈你的看法___________ 。
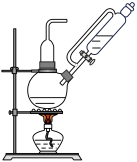
氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用如图表示。

(1)天原化工厂是我国最早的氯碱企业,其创始人是___________(单选)
| A.侯德榜 | B.吴蕴初 | C.荣毅仁 | D.戴安邦 |
(3)工业上用氯气与消石灰制成漂白粉,漂白粉的有效成分为___________(单选)
A. | B. | C. | D. |
A. | B. | C. | D. |

①请按要求填表。
| 实验组 | 实验原理 | 发生装置(填编号) |
| 第一组 |  | |
| 第二组 | 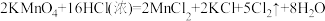 |

氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用如图表示。

您最近一年使用:0次






