名校
解题方法
1 . 某科研小组对乙醛与新制Cu(OH)2反应的实验进行探究。文献资料:
a.Cu(OH)2与OH-反应生成[Cu(OH)4]2-(蓝紫色)。
b.Cu2O在碱性条件下稳定,在酸性溶液中不稳定,如:Cu2O Cu+Cu2+。
Cu+Cu2+。
Ⅰ.探究NaOH在乙醛与新制Cu(OH)2浊液反应中的作用
实验记录如下:
(1)实验ⅰ中的浅蓝绿色沉淀的主要成份为Cu2(OH)2SO4,受热不易分解。写出生成Cu2(OH)2SO4的化学方程式___________ 。
(2)实验ⅰ、ⅱ、ⅲ中,实验___________ 的新制Cu(OH)2浊液与乙醛反应生成了Cu2O。
(3)为进一步探究新制Cu(OH)2与乙醛反应的本质,科研小组又进行如下实验:
① 由实验ⅳ的现象推测:实验ⅱ的黑色沉淀是___________ 。
② 实验ⅴ能够产生砖红色沉淀的原因是___________ (结合微粒符号解释),写出实验ⅴ中该微粒与乙醛发生反应的方程式___________ 。
Ⅱ.对“黄绿色浊液→橙黄色浊液”异常现象的探究及产物的分离检验
(4)针对实验ⅲ、ⅴ中“黄绿色浊液→橙黄色浊液”的异常现象,通过实验证明了“橙黄色”与乙醛在碱性条件下发生反应生成的有色物质有关。实验方案为:___________ ,加热,无色溶液先变为亮黄色,逐渐加深为橙黄色。
(5)为分离实验ⅴ中砖红色物质,进行如下操作:取实验ⅴ反应后浊液,加入50%乙醇溶液,过滤,得到砖红色固体W,滤液放置24小时后,底部有几粒黄豆大小的黄色油状物质P。
① 文献表明:黄色油状物质P主要是乙醛在碱性条件下的聚合产物。在碱作用下,乙醛发生羟醛缩合反应生成CH3CH=CHCHO,CH3CH=CHCHO与乙醛继续发生羟醛缩合反应,最终生成多烯醛聚合物。写出由乙醛生成多烯醛聚合物的反应方程式___________ 。
② 为进一步确定砖红色固体W的成分,该小组同学设计以下实验方案:取少量砖红色固体W于试管中,加入过量稀H2SO4,振荡,溶液变为蓝色并有紫红色固体。由实验现象能否得出该砖红色固体W是Cu2O,理由是___________ 。
a.Cu(OH)2与OH-反应生成[Cu(OH)4]2-(蓝紫色)。
b.Cu2O在碱性条件下稳定,在酸性溶液中不稳定,如:Cu2O
 Cu+Cu2+。
Cu+Cu2+。Ⅰ.探究NaOH在乙醛与新制Cu(OH)2浊液反应中的作用
实验记录如下:
| 序号 | 5% CuSO4 溶液体积 | 10% NaOH 溶液的体积 | 振荡后现象 | 加入0.5 mL 40%的乙醛溶液,加热后现象 |
| ⅰ | 2 mL | 5滴 | 浅蓝绿色沉淀 | 仍然为浅蓝绿色沉淀 |
| ⅱ | 2 mL | 0.5 mL | 浅蓝色沉淀 | 浅蓝色沉淀→黑色沉淀 |
| ⅲ | 5滴 | 2 mL | 蓝色浊液 | 蓝色浊液→黄绿色浊液→橙黄色浊液→砖红色浊液 |
(2)实验ⅰ、ⅱ、ⅲ中,实验
(3)为进一步探究新制Cu(OH)2与乙醛反应的本质,科研小组又进行如下实验:
| 序号 | 实验 | 加入试剂 | 加入0.5 mL 40%的乙醛溶液,加热后现象 |
| ⅳ |
| 3 mL H2O | 蓝色沉淀→黑色沉淀 |
| ⅴ | 3 mL 10% NaOH | 蓝色浊液→黄绿色浊液→橙黄色浊液→砖红色浊液 |
② 实验ⅴ能够产生砖红色沉淀的原因是
Ⅱ.对“黄绿色浊液→橙黄色浊液”异常现象的探究及产物的分离检验
(4)针对实验ⅲ、ⅴ中“黄绿色浊液→橙黄色浊液”的异常现象,通过实验证明了“橙黄色”与乙醛在碱性条件下发生反应生成的有色物质有关。实验方案为:
(5)为分离实验ⅴ中砖红色物质,进行如下操作:取实验ⅴ反应后浊液,加入50%乙醇溶液,过滤,得到砖红色固体W,滤液放置24小时后,底部有几粒黄豆大小的黄色油状物质P。
① 文献表明:黄色油状物质P主要是乙醛在碱性条件下的聚合产物。在碱作用下,乙醛发生羟醛缩合反应生成CH3CH=CHCHO,CH3CH=CHCHO与乙醛继续发生羟醛缩合反应,最终生成多烯醛聚合物。写出由乙醛生成多烯醛聚合物的反应方程式
② 为进一步确定砖红色固体W的成分,该小组同学设计以下实验方案:取少量砖红色固体W于试管中,加入过量稀H2SO4,振荡,溶液变为蓝色并有紫红色固体。由实验现象能否得出该砖红色固体W是Cu2O,理由是
您最近一年使用:0次
2023-07-10更新
|
209次组卷
|
4卷引用:北京市石景山区2022-2023学年高二下学期期末考试化学试题
北京市石景山区2022-2023学年高二下学期期末考试化学试题北京市顺义区杨镇第一中学2023-2024学年高三上学期第一次月考化学试题名校期末好题汇编-烃的衍生物(非选择题)(已下线)题型突破02 有机实验(综合题)-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(北京专用)
2024高三下·全国·专题练习
2 . 测定CrCl3产品的纯度,实验如下:
①取mg CrCl3产品,在强碱性条件下,加入过量30%H2O2溶液,小火加热使CrCl3完全转化为CrO ,继续加热一段时间;
,继续加热一段时间;
②冷却后,滴入适量的稀硫酸和浓磷酸,使CrO 转化为Cr2O
转化为Cr2O ,加适量的蒸馏水配成250.00mL溶液;
,加适量的蒸馏水配成250.00mL溶液;
③取25.00mL溶液,用新配制的 的NH4)2Fe(SO4)2标准溶液滴定至终点,重复3次,平均消耗NH4)2Fe(SO4)2标准溶液VmL(已知Cr2O
的NH4)2Fe(SO4)2标准溶液滴定至终点,重复3次,平均消耗NH4)2Fe(SO4)2标准溶液VmL(已知Cr2O 被
被 还原为Cr3+)。
还原为Cr3+)。
则样品中CrCl3 (摩尔质量为M g·molˉ1)的质量分数为___________ %;若步骤③中所用标准溶液已变质,将导致CrCl3质量分数测定值___________ (填“偏高”、“偏低”或“无影响”)。
①取mg CrCl3产品,在强碱性条件下,加入过量30%H2O2溶液,小火加热使CrCl3完全转化为CrO
 ,继续加热一段时间;
,继续加热一段时间;②冷却后,滴入适量的稀硫酸和浓磷酸,使CrO
 转化为Cr2O
转化为Cr2O ,加适量的蒸馏水配成250.00mL溶液;
,加适量的蒸馏水配成250.00mL溶液;③取25.00mL溶液,用新配制的
 的NH4)2Fe(SO4)2标准溶液滴定至终点,重复3次,平均消耗NH4)2Fe(SO4)2标准溶液VmL(已知Cr2O
的NH4)2Fe(SO4)2标准溶液滴定至终点,重复3次,平均消耗NH4)2Fe(SO4)2标准溶液VmL(已知Cr2O 被
被 还原为Cr3+)。
还原为Cr3+)。则样品中CrCl3 (摩尔质量为M g·molˉ1)的质量分数为
您最近一年使用:0次
解题方法
3 . 实验室中有一瓶碳酸氢钠固体,因受热而部分变质(杂质为Na2CO3,假设杂质分布均匀)。为测定其组成,称取4.86 g样品溶于水,配成500 mL溶液。加入0.50 mol/L Ba(OH)2溶液至100.00 mL时沉淀量达到最大。请计算:
(1)25℃时0.50 mol/L Ba(OH)2溶液中的氢氧根离子浓度是_______ mol/L。
(2)样品中n(NaHCO3)∶n(Na2CO3)=_______ 。
(1)25℃时0.50 mol/L Ba(OH)2溶液中的氢氧根离子浓度是
(2)样品中n(NaHCO3)∶n(Na2CO3)=
您最近一年使用:0次
2023高三·全国·专题练习
4 . 氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7820g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000g。则样品中氨基甲酸铵的物质的量分数为_______ 。[Mr(NH2COONH4)=78、Mr(NH4HCO3)=79、Mr(CaCO3)=100]
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
5 . 完成下列表格(操作—现象—结论型判断解释)
| 序号 | 实验操作及现象 | 结论 | 判断 | 解释 |
| (1) | 用铂丝蘸取某溶液进行焰色反应,火焰呈黄色 | 一定是钠盐溶液,该溶液中一定不含 | ||
| (2) | 向乙醇中加入浓硫酸,加热,溶液变黑,将产生的气体通入酸性 溶液中,溶液褪色 溶液中,溶液褪色 | 该气体是乙烯 | ||
| (3) | 向溶液X中滴加稀 溶液,将湿润的红色石蕊试纸置于试管口,试纸不变蓝 溶液,将湿润的红色石蕊试纸置于试管口,试纸不变蓝 | 溶液X中无 | ||
| (4) | 用湿润的淀粉碘化钾试纸检验气体Y,试纸变蓝 | Y是 | ||
| (5) | 将某气体通入品红溶液中,溶液褪色 | 该气体一定是 | ||
| (6) | 向溶液Y中滴加稀硝酸,再滴加 溶液,有白色沉淀生成 溶液,有白色沉淀生成 | Y中一定含有 | ||
| (7) | 往 中滴入酸性 中滴入酸性 溶液,溶液褪色 溶液,溶液褪色 | 该有机物中含有碳碳双键 | ||
| (8) | 蘸有浓氨水的玻璃棒靠近溶液X有白烟产生 | X一定是浓盐酸 | ||
| (9) | 向某溶液中滴加 溶液,溶液不变色,滴加氯水后溶液显红色 溶液,溶液不变色,滴加氯水后溶液显红色 | 该溶液中一定含 | ||
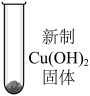
| (10) | 将 气体通入 气体通入 溶液中,生成白色沉淀 溶液中,生成白色沉淀 | 该沉淀一定是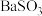 | ||
| (11) | 将 气体通入 气体通入 溶液中,无明显现象 溶液中,无明显现象 |  和 和 不反应 不反应 | ||
| (12) | 将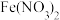 样品溶于稀硫酸,滴加 样品溶于稀硫酸,滴加 溶液,溶液变红 溶液,溶液变红 | 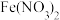 样品已氧化变质 样品已氧化变质 |
您最近一年使用:0次
21-22高一·全国·假期作业
6 . Na2O2是一种重要化工原料,工业上可以用来漂白纺织类物品、麦秆、纤维等。回答下列问题:
(1)Na2O2中氧元素化合价为_______ ,写出过氧化钠与水反应的化学方程式_______ 。
(2)过氧化钠若长期保存不当,容易生成_______ (填化学式),证明过氧化钠变质情况的一种实验方案如下。
(3)过氧化钠还可以作为潜艇工作人员的供氧剂,某工作人员携带10kg的过氧化钠固体进入潜艇,相当于携带标况下_______ m3空气(只需列出计算表达式,已知氧气占空气体积分数约为20%,空气的密度为1.293g/cm3)。
(1)Na2O2中氧元素化合价为
(2)过氧化钠若长期保存不当,容易生成
| 操作 | 现象 | 结论 |
| 取少量样品于试管中,加水溶解,加入 | 有白色沉淀生成 | |
| 另取少量样品于试管中,再加入适量的水,用带火星的木条靠近管口 | 带火星的木条复燃 |
(3)过氧化钠还可以作为潜艇工作人员的供氧剂,某工作人员携带10kg的过氧化钠固体进入潜艇,相当于携带标况下
您最近一年使用:0次
名校
7 . H2O2是医药、卫生行业上广泛使用的消毒剂。某课外小组采用滴定法测定某医用消毒剂中H2O2的浓度。实验步骤如下:
①标准液的配制和标定:称取一定量KMnO4固体溶于水,避光放置6~10天,过滤并取滤液于滴定管中待用,称取mgNa2C2O4固体于锥形瓶中,加水溶解,再加H2SO4酸化,滴定至终点,消耗KMnO4溶液的体积V1mL。滴定过程中发生的一个反应为:5H2C2O4+2MnO +6H+=2Mn2++10CO2↑+8H2O。
+6H+=2Mn2++10CO2↑+8H2O。
②H2O2浓度的测定:取待测样品25mL稀释至500mL,再移取10.00mL于锥形瓶中,加H2SO4酸化,用上述KMnO4标准液滴定至终点,消耗溶液的体积V2mL。
回答下列问题:
(1)②中移取10.00mL待测液所用主要仪器名称为___________ 。
(2)配制KMnO4标准液时需要久置并过滤掉变质生成的MnO2,该过滤操作需用___________ 。
a.普通漏斗和滤纸
b.不需滤纸的微孔玻璃漏斗
(3)标定KMnO4标准液时需要控制温度为75~85℃,温度过低反应较慢,温度过高可能会因___________ 而导致KMnO4标准液的标定浓度偏高,在恒定温度下进行滴定操作时,开始时反应速率较慢,随后加快,导致速率加快的原因是___________ 。
(4)KMnO4标准液滴定H2O2的离子方程式为___________ ;当滴定到___________ 可以认为已达到滴定终点。
(5)该医生消毒剂中H2O2的物质的量浓度为___________ mol·L-1。
(6)②中若用盐酸代替H2SO4测定结果将___________ (填“偏高”“偏低”或“无影响”)
①标准液的配制和标定:称取一定量KMnO4固体溶于水,避光放置6~10天,过滤并取滤液于滴定管中待用,称取mgNa2C2O4固体于锥形瓶中,加水溶解,再加H2SO4酸化,滴定至终点,消耗KMnO4溶液的体积V1mL。滴定过程中发生的一个反应为:5H2C2O4+2MnO
 +6H+=2Mn2++10CO2↑+8H2O。
+6H+=2Mn2++10CO2↑+8H2O。②H2O2浓度的测定:取待测样品25mL稀释至500mL,再移取10.00mL于锥形瓶中,加H2SO4酸化,用上述KMnO4标准液滴定至终点,消耗溶液的体积V2mL。
回答下列问题:
(1)②中移取10.00mL待测液所用主要仪器名称为
(2)配制KMnO4标准液时需要久置并过滤掉变质生成的MnO2,该过滤操作需用
a.普通漏斗和滤纸
b.不需滤纸的微孔玻璃漏斗
(3)标定KMnO4标准液时需要控制温度为75~85℃,温度过低反应较慢,温度过高可能会因
(4)KMnO4标准液滴定H2O2的离子方程式为
(5)该医生消毒剂中H2O2的物质的量浓度为
(6)②中若用盐酸代替H2SO4测定结果将
您最近一年使用:0次
名校
8 . 过氧化钠保存不当容易变质,某课外活动小组为了粗略测定样品中过氧化钠的质量分数,他们称取 样品,并设计用如图装置来测定过氧化钠的质量分数。
样品,并设计用如图装置来测定过氧化钠的质量分数。
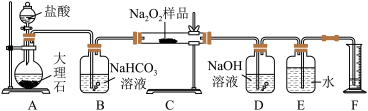
上图中的 和
和 构成量气装置,用来测定
构成量气装置,用来测定 的体积。
的体积。
(1)写出以下装置中发生反应的化学方程式。
装置 :
:_____ 。装置 :
:_______ 。装置 :
:_________ 。
(2) 中
中 溶液的作用是
溶液的作用是_________ 。
(3)为准确读出氧气的体积需进行以下操作,正确的顺序为________ 。
A.调整量筒高度,使广口瓶 与量筒
与量筒 内液面相平
内液面相平
B.将气体冷却至室温
C.平视,使凹液面最低点与视线水平相切再读数
 样品,并设计用如图装置来测定过氧化钠的质量分数。
样品,并设计用如图装置来测定过氧化钠的质量分数。
上图中的
 和
和 构成量气装置,用来测定
构成量气装置,用来测定 的体积。
的体积。(1)写出以下装置中发生反应的化学方程式。
装置
 :
: :
: :
:(2)
 中
中 溶液的作用是
溶液的作用是(3)为准确读出氧气的体积需进行以下操作,正确的顺序为
A.调整量筒高度,使广口瓶
 与量筒
与量筒 内液面相平
内液面相平B.将气体冷却至室温
C.平视,使凹液面最低点与视线水平相切再读数
您最近一年使用:0次
2020-09-04更新
|
551次组卷
|
5卷引用:人教版(2019)高一必修第一册第二章 海水中的重要元素 第一节 钠及其化合物 课时2 钠的几种化合物 焰色试验
人教版(2019)高一必修第一册第二章 海水中的重要元素 第一节 钠及其化合物 课时2 钠的几种化合物 焰色试验(已下线)第13单元 化学实验基本操作(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷河北省石家庄市第二十四中学2020-2021学年高一上学期期中考试化学试题2(已下线)3.2.1 钠的性质与制备-2021-2022学年高一化学课后培优练(苏教版2019必修第一册)广东省华南师范大学附属中学2020-2021学年高一上学期期中考试化学试题
12-13高二上·山东济宁·期中
名校
9 . 成熟的苹果中含有淀粉、葡萄糖和无机盐等,某课外兴趣小组设计了一组实验证明某些成份的存在,请你参与并协助他们完成相关实验。
(1)用小试管取少量的苹果汁,加入_________ ,溶液变蓝,则苹果中含有淀粉。
(2)用小试管取少量的苹果汁,加入新制Cu(OH)2悬浊液,并加热,产生砖红色的沉淀,则苹果中含有____________ (写分子式)。
(3)葡萄糖在一定条件下可以得到化学式为C2H6O的化合物A。
A + CH3COOH→有香味的产物
① 含A的体积分数为75%的水溶液可以用做_____________ 。
②写出化合物A与CH3COOH反应的化学方程式为______________________ ,该反应的类型为_____ 。
(4)苹果中含有苹果酸,测得其相对分子质量为134。取0.02mol苹果酸,使其完全燃烧,将燃烧后的产物先后通过足量的无水CaCl2和碱石灰,两者分别增重1.08g 和 3.52g。则分子中C、H原子的个数比_______ 。苹果酸的分子式是___________ 。
(1)用小试管取少量的苹果汁,加入
(2)用小试管取少量的苹果汁,加入新制Cu(OH)2悬浊液,并加热,产生砖红色的沉淀,则苹果中含有
(3)葡萄糖在一定条件下可以得到化学式为C2H6O的化合物A。
A + CH3COOH→有香味的产物
① 含A的体积分数为75%的水溶液可以用做
②写出化合物A与CH3COOH反应的化学方程式为
(4)苹果中含有苹果酸,测得其相对分子质量为134。取0.02mol苹果酸,使其完全燃烧,将燃烧后的产物先后通过足量的无水CaCl2和碱石灰,两者分别增重1.08g 和 3.52g。则分子中C、H原子的个数比
您最近一年使用:0次
2012-12-25更新
|
435次组卷
|
4卷引用:人教版高中化学必修二第三单元《有机化合物》测试卷
人教版高中化学必修二第三单元《有机化合物》测试卷江西省南昌市八一中学2019-2020学年高二下学期期末考试化学试题(已下线)2012-2013学年山东济宁鱼台一中高二上学期期中考试化学试卷(已下线)2012-2013学年福建省泉州一中高二上学期期中考试化学试卷
名校
10 . 糖类、油脂、蛋白质都是人体基本营养物质。
(1)向蛋白质溶液中加入下列物质,会产生沉淀,再加水稀释,沉淀又溶解的是___________(填字母)。
(2)不同油脂在酸性和碱性条件下水解的共同产物的名称是___________ 。下列有关油脂的说法正确的是___________ (填字母)。
A.油脂是高级脂肪酸甘油酯,属于高分子化合物
B.油脂中的碳链为碳碳单键时,主要是沸点低的植物油
C.油脂由碳、氢、氧三种元素组成
D.食用油长时间放置会因水解而变质
(3)在试管中加入0.5g淀粉和4mL20%的稀硫酸,加热3~4min,然后用碱液中和试管中的稀硫酸。
①淀粉完全水解生成有机物的化学方程式为___________ 。
②若要检验淀粉已经发生了水解,可取少量上述加碱中和后的溶液加入___________ (填试剂名称),加热后观察到的现象是___________ 。若要检验淀粉是否完全水解,可取少量上述溶液加入___________ (填试剂名称),观察到溶液变蓝,则没有完全水解。
(1)向蛋白质溶液中加入下列物质,会产生沉淀,再加水稀释,沉淀又溶解的是___________(填字母)。
A. | B. | C. | D. |
A.油脂是高级脂肪酸甘油酯,属于高分子化合物
B.油脂中的碳链为碳碳单键时,主要是沸点低的植物油
C.油脂由碳、氢、氧三种元素组成
D.食用油长时间放置会因水解而变质
(3)在试管中加入0.5g淀粉和4mL20%的稀硫酸,加热3~4min,然后用碱液中和试管中的稀硫酸。
①淀粉完全水解生成有机物的化学方程式为
②若要检验淀粉已经发生了水解,可取少量上述加碱中和后的溶液加入
您最近一年使用:0次