2024高三下·全国·专题练习
1 . 硫氰化钾( )俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如下图所示:
)俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如下图所示: 不溶于水,密度比水的大;
不溶于水,密度比水的大;
② 不溶于
不溶于 ;
;
③三颈烧瓶内盛放有 、水和催化剂。
、水和催化剂。
回答下列问题:
制备 溶液:
溶液:
测定晶体中 的含量:称取10.0g样品,配成
的含量:称取10.0g样品,配成 溶液。量取
溶液。量取 溶液于锥形瓶中,加入适量稀硝酸,再加入几滴
溶液于锥形瓶中,加入适量稀硝酸,再加入几滴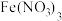 溶液作指示剂,用
溶液作指示剂,用
 标准溶液滴定,达到滴定终点时消耗
标准溶液滴定,达到滴定终点时消耗 标准溶液
标准溶液 。
。
(1)滴定时发生的反应: (白色)。则判断到达滴定终点的方法是
(白色)。则判断到达滴定终点的方法是_______ 。
(2)晶体中 的质量分数为
的质量分数为_______ (结果精确至0.1%)。
 )俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如下图所示:
)俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如下图所示: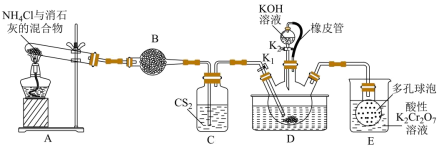
 不溶于水,密度比水的大;
不溶于水,密度比水的大;②
 不溶于
不溶于 ;
;③三颈烧瓶内盛放有
 、水和催化剂。
、水和催化剂。回答下列问题:
制备
 溶液:
溶液:测定晶体中
 的含量:称取10.0g样品,配成
的含量:称取10.0g样品,配成 溶液。量取
溶液。量取 溶液于锥形瓶中,加入适量稀硝酸,再加入几滴
溶液于锥形瓶中,加入适量稀硝酸,再加入几滴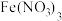 溶液作指示剂,用
溶液作指示剂,用
 标准溶液滴定,达到滴定终点时消耗
标准溶液滴定,达到滴定终点时消耗 标准溶液
标准溶液 。
。(1)滴定时发生的反应:
 (白色)。则判断到达滴定终点的方法是
(白色)。则判断到达滴定终点的方法是(2)晶体中
 的质量分数为
的质量分数为
您最近一年使用:0次
2024高三下·全国·专题练习
2 . 制备的泄盐样品中MgSO4·7H2O的含量可用EDTA二钠盐(用Na2H2Y表示)进行测定,实验测定方法如下:
则制得的泄盐样品中MgSO4·7H2O的质量分数为___________ 。
| 实验测定方法 | 涉及的反应 |
| ①在1.5 g样品中加入足量的EDTA二钠盐溶液,配成pH=9~10的100.00 mL甲溶液 | Mg2++H2Y2-=MgH2Y |
| ②取25.00 mL甲溶液于锥形瓶中,用含0.100 mol·L-1 Zn2+的标准液进行滴定,消耗20.00 mL含Zn2+标准液 | Zn2++H2Y2-=ZnH2Y |
| ③再取25.00 mL甲溶液于另一锥形瓶中,调节pH为5~6,用含0.100 mol·L-1 Zn2+的标准液进行滴定,消耗35.00 mL含Zn2+标准液 | Zn2++MgH2Y=Mg2++ZnH2Y、Zn2++H2Y2-=ZnH2Y |
您最近一年使用:0次
2024高三下·全国·专题练习
3 . 测定钛白中TiO2的含量可用滴定分析法:称取mg样品放入锥形瓶中,加入H2SO4和(NH4)2SO4混合溶液,加热使样品溶解。冷却后,加入足量稀盐酸(Ti元素存在形式变为TiO2+)。加入过量铝粉将TiO2+充分还原[ (未配平)],待过量金属铝完全溶解并冷却后,滴加2~3滴指示剂,用cmol/L的NH4Fe(SO4)2标准溶液进行滴定(Fe3+能将Ti3+氧化成四价钛的化合物),重复上述滴定操作2~3次,平均消耗NH4Fe(SO4)2标准溶液VmL。
(未配平)],待过量金属铝完全溶解并冷却后,滴加2~3滴指示剂,用cmol/L的NH4Fe(SO4)2标准溶液进行滴定(Fe3+能将Ti3+氧化成四价钛的化合物),重复上述滴定操作2~3次,平均消耗NH4Fe(SO4)2标准溶液VmL。
(1)过量铝粉的作用除了还原TiO2+外,另一个作用是___________ 。
(2)上述滴定过程中应选用指示剂为___________ 。
(3)下列关于滴定分析的操作,不正确 的是___________ 。
A.用托盘天平称量TiO2样品mg
B.滴定管用蒸馏水洗涤时,洗涤液应从滴定管下端放出
C.滴定时,通常用左手控制旋塞滴加溶液,右手摇动锥形瓶,使溶液向同一方向旋转
D.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
E.滴定前滴定管尖嘴内无气泡,滴定后尖嘴内有气泡,则测得TiO2的含量测定结果偏高
(4)钛白中TiO2质量分数为___________ 。(写出最简表达式即可)。
 (未配平)],待过量金属铝完全溶解并冷却后,滴加2~3滴指示剂,用cmol/L的NH4Fe(SO4)2标准溶液进行滴定(Fe3+能将Ti3+氧化成四价钛的化合物),重复上述滴定操作2~3次,平均消耗NH4Fe(SO4)2标准溶液VmL。
(未配平)],待过量金属铝完全溶解并冷却后,滴加2~3滴指示剂,用cmol/L的NH4Fe(SO4)2标准溶液进行滴定(Fe3+能将Ti3+氧化成四价钛的化合物),重复上述滴定操作2~3次,平均消耗NH4Fe(SO4)2标准溶液VmL。(1)过量铝粉的作用除了还原TiO2+外,另一个作用是
(2)上述滴定过程中应选用指示剂为
(3)下列关于滴定分析的操作,
A.用托盘天平称量TiO2样品mg
B.滴定管用蒸馏水洗涤时,洗涤液应从滴定管下端放出
C.滴定时,通常用左手控制旋塞滴加溶液,右手摇动锥形瓶,使溶液向同一方向旋转
D.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
E.滴定前滴定管尖嘴内无气泡,滴定后尖嘴内有气泡,则测得TiO2的含量测定结果偏高
(4)钛白中TiO2质量分数为
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
4 . 一定条件下,乙酸酐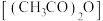 醇解反应
醇解反应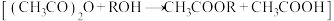 可进行完全,利用此反应定量测定有机醇
可进行完全,利用此反应定量测定有机醇 中的羟基含量,实验过程中酯的水解可忽略。实验步骤如下:
中的羟基含量,实验过程中酯的水解可忽略。实验步骤如下:
①配制一定浓度的乙酸酐-苯溶液。
②量取一定体积乙酸酐-苯溶液置于锥形瓶中,加入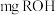 样品,充分反应后,加适量水使剩余乙酸酐完全水解:
样品,充分反应后,加适量水使剩余乙酸酐完全水解: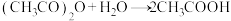 。
。
③加指示剂并用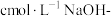 甲醇标准溶液滴定至终点,消耗标准溶液
甲醇标准溶液滴定至终点,消耗标准溶液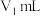 。
。
④在相同条件下,量取相同体积的乙酸酐-苯溶液,只加适量水使乙酸酐完全水解;加指示剂并用 -甲醇标准溶液滴定至终点,消耗标准溶液
-甲醇标准溶液滴定至终点,消耗标准溶液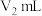 。根据上述实验原理,下列说法正确的是
。根据上述实验原理,下列说法正确的是______ 。
A.可以用乙酸代替乙酸酐进行上述实验
B.若因甲醇挥发造成标准溶液浓度发生变化,将导致测定结果偏小
C.步骤③滴定时,不慎将锥形瓶内溶液溅出,将导致测定结果偏小
D.步骤④中,若加水量不足,将导致测定结果偏大
E. 样品中羟基含量(质量分数)是
样品中羟基含量(质量分数)是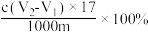
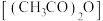 醇解反应
醇解反应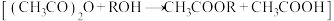 可进行完全,利用此反应定量测定有机醇
可进行完全,利用此反应定量测定有机醇 中的羟基含量,实验过程中酯的水解可忽略。实验步骤如下:
中的羟基含量,实验过程中酯的水解可忽略。实验步骤如下:①配制一定浓度的乙酸酐-苯溶液。
②量取一定体积乙酸酐-苯溶液置于锥形瓶中,加入
 样品,充分反应后,加适量水使剩余乙酸酐完全水解:
样品,充分反应后,加适量水使剩余乙酸酐完全水解: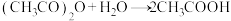 。
。③加指示剂并用
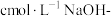 甲醇标准溶液滴定至终点,消耗标准溶液
甲醇标准溶液滴定至终点,消耗标准溶液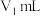 。
。④在相同条件下,量取相同体积的乙酸酐-苯溶液,只加适量水使乙酸酐完全水解;加指示剂并用
 -甲醇标准溶液滴定至终点,消耗标准溶液
-甲醇标准溶液滴定至终点,消耗标准溶液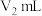 。根据上述实验原理,下列说法正确的是
。根据上述实验原理,下列说法正确的是A.可以用乙酸代替乙酸酐进行上述实验
B.若因甲醇挥发造成标准溶液浓度发生变化,将导致测定结果偏小
C.步骤③滴定时,不慎将锥形瓶内溶液溅出,将导致测定结果偏小
D.步骤④中,若加水量不足,将导致测定结果偏大
E.
 样品中羟基含量(质量分数)是
样品中羟基含量(质量分数)是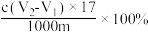
您最近一年使用:0次
2024高三下·全国·专题练习
5 . 充分反应后,某同学设计实验对E中NaNO2的含量进行检测。称取E中固体2g,完全溶解配制成溶液100 mL,取出25 mL溶液用0.100 mol/L酸性KMnO4溶液进行滴定(杂质不与KMnO4反应),消耗KMnO4溶液20mL,求样品中亚硝酸钠的质量分数(只列式,不用化简,不用计算,已知:NaNO2摩尔质量69g/mol)___________ 。
您最近一年使用:0次
2024高三下·全国·专题练习
6 . 三氯化六氨合钴(Ⅲ){[Co(NH3)6]Cl3}是重要的化工原料。制备反应式为:2CoCl2·6H2O+10NH3+2NH4Cl+H2O2 2[Co(NH3)6]Cl3+14H2O,反应放出大量热。已知:①Co2+不易被氧化,Co3+具有强氧化性;[Co(NH3)6]2+具有较强还原性,[Co(NH3)6]3+性质稳定。②[Co(NH3)6]Cl3在水中的溶解度曲线如图1所示,加入少量浓盐酸有利于其析出。制备[Co(NH3)6]Cl3的实验步骤:
2[Co(NH3)6]Cl3+14H2O,反应放出大量热。已知:①Co2+不易被氧化,Co3+具有强氧化性;[Co(NH3)6]2+具有较强还原性,[Co(NH3)6]3+性质稳定。②[Co(NH3)6]Cl3在水中的溶解度曲线如图1所示,加入少量浓盐酸有利于其析出。制备[Co(NH3)6]Cl3的实验步骤:
Ⅲ.在静置的同时,需对静置液进行“操作A”后过滤;用无水乙醇洗涤晶体2~3次。
(1)步骤Ⅲ中的“操作A”是_______ 。
(2)用如图3装置测定产品中NH3的含量(部分装置已省略):
液封装置1的作用是_______ 。
液封装置2的作用是_______ 。
②滴定:将液封装置2中的水倒入锥形瓶后滴定剩余的H2SO4,消耗c2mol·L-1的NaOH标准溶液V2mL。若未将液封装置2中的水倒入锥形瓶,测得NH3的质量分数将_______ (填“偏高”或“偏低”或“不变”)。
 2[Co(NH3)6]Cl3+14H2O,反应放出大量热。已知:①Co2+不易被氧化,Co3+具有强氧化性;[Co(NH3)6]2+具有较强还原性,[Co(NH3)6]3+性质稳定。②[Co(NH3)6]Cl3在水中的溶解度曲线如图1所示,加入少量浓盐酸有利于其析出。制备[Co(NH3)6]Cl3的实验步骤:
2[Co(NH3)6]Cl3+14H2O,反应放出大量热。已知:①Co2+不易被氧化,Co3+具有强氧化性;[Co(NH3)6]2+具有较强还原性,[Co(NH3)6]3+性质稳定。②[Co(NH3)6]Cl3在水中的溶解度曲线如图1所示,加入少量浓盐酸有利于其析出。制备[Co(NH3)6]Cl3的实验步骤: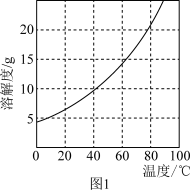

Ⅲ.在静置的同时,需对静置液进行“操作A”后过滤;用无水乙醇洗涤晶体2~3次。
(1)步骤Ⅲ中的“操作A”是
(2)用如图3装置测定产品中NH3的含量(部分装置已省略):
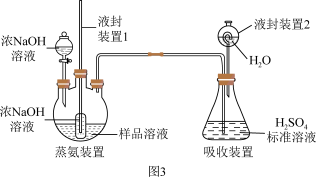
液封装置1的作用是
液封装置2的作用是
②滴定:将液封装置2中的水倒入锥形瓶后滴定剩余的H2SO4,消耗c2mol·L-1的NaOH标准溶液V2mL。若未将液封装置2中的水倒入锥形瓶,测得NH3的质量分数将
您最近一年使用:0次
2024高三下·全国·专题练习
7 . 测定锗的含量:称取0.5500g锗样品,加入双氧水溶解,再加入盐酸生成 ,以淀粉为指示剂,用
,以淀粉为指示剂,用 的碘酸钾标准溶液滴定,消耗碘酸钾的体积为24.80mL。已知:酸性条件下IO
的碘酸钾标准溶液滴定,消耗碘酸钾的体积为24.80mL。已知:酸性条件下IO ,能将
,能将 氧化为
氧化为 。
。
(1)在滴定过程中依次发生的离子方程式为:___________ 、___________ ;
(2)该样品中储的质量分数是___________ %(精确到0.01%)。
 ,以淀粉为指示剂,用
,以淀粉为指示剂,用 的碘酸钾标准溶液滴定,消耗碘酸钾的体积为24.80mL。已知:酸性条件下IO
的碘酸钾标准溶液滴定,消耗碘酸钾的体积为24.80mL。已知:酸性条件下IO ,能将
,能将 氧化为
氧化为 。
。(1)在滴定过程中依次发生的离子方程式为:
(2)该样品中储的质量分数是
您最近一年使用:0次
解题方法
8 . 如图是某化肥厂在一公共场所的围墙上的广告:

请仔细观察、分析,并回答下列问题。
(1)碳酸氢铵(化学式为NH4HCO3)是由___________ 种元素组成的。
(2)碳酸氢铵的氮含量是指氮元素的质量分数。根据所学化学知识,你认为此广告是___________ (填“真实”或“虚假”)广告,判断的依据是___________ 。
(3)碳酸氢铵受潮时在常温下就能分解,温度越高分解越快,因此保存时应注意___________ 。

请仔细观察、分析,并回答下列问题。
(1)碳酸氢铵(化学式为NH4HCO3)是由
(2)碳酸氢铵的氮含量是指氮元素的质量分数。根据所学化学知识,你认为此广告是
(3)碳酸氢铵受潮时在常温下就能分解,温度越高分解越快,因此保存时应注意
您最近一年使用:0次
2023高三·全国·专题练习
9 . 为测定产品中Zn3(PO4)2·4H2O的含量,进行如下实验,已知滴定过程中Zn2+与H2Y2-按1∶1反应。
步骤Ⅰ:准确称取0.457 0 g产品于烧杯中,加入适量盐酸使其溶解,将溶液转移至100 mL容量瓶,定容
步骤Ⅱ:移取20.00 mL上述溶液于锥形瓶中,加入指示剂,在pH=5~6的缓冲溶液中用0.020 00 mol·L-1 Na2H2标准溶液滴定至终点,测得Na2H2Y标准溶液的用量为27.60 mL。
(1)步骤Ⅱ中移取溶液时所使用的玻璃仪器为________ ;
(2)产品中Zn3(PO4)2·4H2O的质量分数为________ ;
(3)下列操作中,导致产品中Zn3(PO4)2·4H2O含量测定值偏低的是________。
步骤Ⅰ:准确称取0.457 0 g产品于烧杯中,加入适量盐酸使其溶解,将溶液转移至100 mL容量瓶,定容
步骤Ⅱ:移取20.00 mL上述溶液于锥形瓶中,加入指示剂,在pH=5~6的缓冲溶液中用0.020 00 mol·L-1 Na2H2标准溶液滴定至终点,测得Na2H2Y标准溶液的用量为27.60 mL。
(1)步骤Ⅱ中移取溶液时所使用的玻璃仪器为
(2)产品中Zn3(PO4)2·4H2O的质量分数为
(3)下列操作中,导致产品中Zn3(PO4)2·4H2O含量测定值偏低的是________。
| A.步骤Ⅰ中定容时俯视刻度线 |
| B.步骤Ⅰ中转移溶液时未洗涤烧杯 |
| C.步骤Ⅱ中滴定管未用Na2H2Y标准溶液润洗 |
| D.步骤Ⅱ中滴定前滴定管内无气泡,滴定结束后有气泡 |
您最近一年使用:0次
2023高三·全国·专题练习
10 . 完成下列问题
(1)用 的盐酸滴定未知浓度的
的盐酸滴定未知浓度的 溶液,用酚酞作指示剂,达到滴定终点的现象是
溶液,用酚酞作指示剂,达到滴定终点的现象是_______ ;若用甲基橙作指示剂,滴定终点现象是_______ 。
(2)用标准碘溶液滴定溶有 的水溶液,以测定水中
的水溶液,以测定水中 的含量,应选用
的含量,应选用_______ 作指示剂,达到滴定终点的现象是_______ 。
(3)用标准酸性 溶液滴定溶有
溶液滴定溶有 的水溶液,以测定水中
的水溶液,以测定水中 的含量,是否需要选用指示剂
的含量,是否需要选用指示剂_______ (填“是”或“否”),达到滴定终点的现象是_______ 。
(4)用氧化还原滴定法测定 的质量分数:一定条件下,将
的质量分数:一定条件下,将 溶解并还原为
溶解并还原为 ,再用
,再用 溶液作指示剂,用
溶液作指示剂,用 标准溶液滴定
标准溶液滴定 至全部生成
至全部生成 ,滴定
,滴定 时发生反应的离子方程式为
时发生反应的离子方程式为_______ ,达到滴定终点的现象是_______ 。
(5)用标准 溶液滴定含有
溶液滴定含有 的溶液,应选用
的溶液,应选用_______ 作指示剂,滴定终点现象是_______ 。
(1)用
 的盐酸滴定未知浓度的
的盐酸滴定未知浓度的 溶液,用酚酞作指示剂,达到滴定终点的现象是
溶液,用酚酞作指示剂,达到滴定终点的现象是(2)用标准碘溶液滴定溶有
 的水溶液,以测定水中
的水溶液,以测定水中 的含量,应选用
的含量,应选用(3)用标准酸性
 溶液滴定溶有
溶液滴定溶有 的水溶液,以测定水中
的水溶液,以测定水中 的含量,是否需要选用指示剂
的含量,是否需要选用指示剂(4)用氧化还原滴定法测定
 的质量分数:一定条件下,将
的质量分数:一定条件下,将 溶解并还原为
溶解并还原为 ,再用
,再用 溶液作指示剂,用
溶液作指示剂,用 标准溶液滴定
标准溶液滴定 至全部生成
至全部生成 ,滴定
,滴定 时发生反应的离子方程式为
时发生反应的离子方程式为(5)用标准
 溶液滴定含有
溶液滴定含有 的溶液,应选用
的溶液,应选用
您最近一年使用:0次



