1 . 双氧水是中学常见的绿色化学试剂,既可以表现氧化性,又可以表现还原性。某学习小组设计一组与双氧水相关的实验如表所示:
请回答下列问题:
(1)实验Ⅰ的离子方程式为_____________________________ ;该原理广泛用于除去Fe3+中的Fe2+的操作中,此操作的优点是__________ 。
(2)实验Ⅱ可用于测定双氧水的浓度,用酸性高锰酸钾溶液滴定双氧水,达到滴定终点的标志是________ ,反应的离子方程式为_________________________ 。当有1.7g过氧化氢参加反应时转移的电子数目为_____________ 。
(3)在实验Ⅲ和Ⅳ中双氧水没有表现的性质是________ (填选项字母)。
A.氧化性 B.还原性 C.不稳定性 D.酸性
(4)双氧水能将碱性废水中的CN-转化成碳酸盐和一种使湿润的红色石蕊试纸变蓝的气体,写出反应的离子方程式________________________________________ 。
| 实验 | 实验操作与现象 |
| Ⅰ | 向含少量硫酸亚铁的硫酸铁溶液中滴加双氧水和稀硫酸 |
| Ⅱ | 向双氧水中滴加酸性高锰酸钾溶液,产生气泡,紫红色褪去 |
| Ⅲ | 向淀粉-KI溶液中滴加双氧水,溶液变蓝色 |
| Ⅳ | 向双氧水加入铁红粉末,产生大量气泡 |
请回答下列问题:
(1)实验Ⅰ的离子方程式为
(2)实验Ⅱ可用于测定双氧水的浓度,用酸性高锰酸钾溶液滴定双氧水,达到滴定终点的标志是
(3)在实验Ⅲ和Ⅳ中双氧水没有表现的性质是
A.氧化性 B.还原性 C.不稳定性 D.酸性
(4)双氧水能将碱性废水中的CN-转化成碳酸盐和一种使湿润的红色石蕊试纸变蓝的气体,写出反应的离子方程式
您最近一年使用:0次
名校
2 . 某学习小组探究 溶液与
溶液与 溶液的反应。资料:①
溶液的反应。资料:① 溶液呈酸性;②
溶液呈酸性;② 具有较强的氧化性;③
具有较强的氧化性;③ 溶液暴露在空气中或久置会变为黄色。甲同学对两溶液可能发生的反应提出了下列两种猜想:
溶液暴露在空气中或久置会变为黄色。甲同学对两溶液可能发生的反应提出了下列两种猜想:
猜测1:发生复分解反应。
猜测2: 与
与 发生氧化还原反应。
发生氧化还原反应。
(1)①如果猜测2成立,则发生反应的化学方程式为___________ ;为了验证该猜测,甲同学往反应后的溶液中加入淀粉,观察到溶液变蓝,证明猜测2成立。
②乙同学认为甲同学的实验方案不能证明猜测2成立,原因是 溶液中的
溶液中的 在酸性条件下具有较强的氧化性,也可能氧化
在酸性条件下具有较强的氧化性,也可能氧化 ,反应的离子方程式为
,反应的离子方程式为___________ ;该反应中的氧化剂和还原剂的物质的量之比为___________ 。
(2)乙同学利用原电池原理来验证以上猜测,设计了如图所示实验装置(盐桥中的离子可以自由移动,两烧杯中电解质溶液足量)。
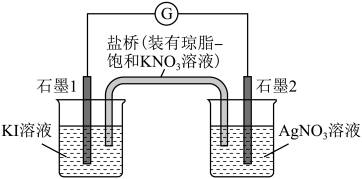
①该装置的负极为石墨___________ (填“1”或“2”)。
②电池反应一段时间后, 溶液逐渐变为黄色。丙同学从盛有
溶液逐渐变为黄色。丙同学从盛有 溶液烧杯中取少量液体,向其中加入淀粉溶液,淀粉变蓝。丙同学由此得出是
溶液烧杯中取少量液体,向其中加入淀粉溶液,淀粉变蓝。丙同学由此得出是 和
和 发生了氧化还原反应,是否合理?并说明理由
发生了氧化还原反应,是否合理?并说明理由___________ 。
③一段时间后,电流计指针发生偏转, 溶液无气泡产生,石墨2表面有银白色金属析出。由此可知,
溶液无气泡产生,石墨2表面有银白色金属析出。由此可知, 溶液中发生的电极反应式为
溶液中发生的电极反应式为___________ ,因此验证了 与
与 能发生氧化还原反应。若石墨2增重
能发生氧化还原反应。若石墨2增重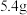 (不考虑其他反应),则电路中转移电子数为
(不考虑其他反应),则电路中转移电子数为___________ 。
 溶液与
溶液与 溶液的反应。资料:①
溶液的反应。资料:① 溶液呈酸性;②
溶液呈酸性;② 具有较强的氧化性;③
具有较强的氧化性;③ 溶液暴露在空气中或久置会变为黄色。甲同学对两溶液可能发生的反应提出了下列两种猜想:
溶液暴露在空气中或久置会变为黄色。甲同学对两溶液可能发生的反应提出了下列两种猜想:猜测1:发生复分解反应。
猜测2:
 与
与 发生氧化还原反应。
发生氧化还原反应。(1)①如果猜测2成立,则发生反应的化学方程式为
②乙同学认为甲同学的实验方案不能证明猜测2成立,原因是
 溶液中的
溶液中的 在酸性条件下具有较强的氧化性,也可能氧化
在酸性条件下具有较强的氧化性,也可能氧化 ,反应的离子方程式为
,反应的离子方程式为(2)乙同学利用原电池原理来验证以上猜测,设计了如图所示实验装置(盐桥中的离子可以自由移动,两烧杯中电解质溶液足量)。

①该装置的负极为石墨
②电池反应一段时间后,
 溶液逐渐变为黄色。丙同学从盛有
溶液逐渐变为黄色。丙同学从盛有 溶液烧杯中取少量液体,向其中加入淀粉溶液,淀粉变蓝。丙同学由此得出是
溶液烧杯中取少量液体,向其中加入淀粉溶液,淀粉变蓝。丙同学由此得出是 和
和 发生了氧化还原反应,是否合理?并说明理由
发生了氧化还原反应,是否合理?并说明理由③一段时间后,电流计指针发生偏转,
 溶液无气泡产生,石墨2表面有银白色金属析出。由此可知,
溶液无气泡产生,石墨2表面有银白色金属析出。由此可知, 溶液中发生的电极反应式为
溶液中发生的电极反应式为 与
与 能发生氧化还原反应。若石墨2增重
能发生氧化还原反应。若石墨2增重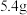 (不考虑其他反应),则电路中转移电子数为
(不考虑其他反应),则电路中转移电子数为
您最近一年使用:0次
解题方法
3 . 铁是人体必需的微量元素之一,补铁剂中的Fe2+在空气中很容易被氧化为Fe3+,影响铁元素在人体中的吸收利用。某实验小组进行如图所示的对照实验,验证补铁剂和维生素C一起服用的科学性。
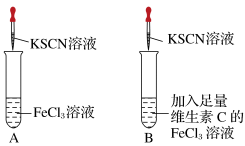
[实验操作]第一步:在A、B两支试管中加入对比试剂;第二步:振荡;第三步:滴加KSCN溶液。
[实验现象]
(1)A试管中溶液变___________ 色,B试管中无明显现象。
[实验结论]
(2)维生素C具有___________ (填“氧化性”或“还原性”),能防止Fe2+被氧化为Fe3+,所以补铁剂和维生素C一起服用具有科学依据。
[生活应用]
(3)某品牌泡腾片的主要成分为维生素C和NaHCO3,放入水中立即产生大量气泡(CO2)使口感更好,说明维生素C具有___________ (填“酸性”或“碱性”)。
(4)为防止烹调时蔬菜中维生素C的损失,烹调蔬菜应注意___________ (写一条即可)。

[实验操作]第一步:在A、B两支试管中加入对比试剂;第二步:振荡;第三步:滴加KSCN溶液。
[实验现象]
(1)A试管中溶液变
[实验结论]
(2)维生素C具有
[生活应用]
(3)某品牌泡腾片的主要成分为维生素C和NaHCO3,放入水中立即产生大量气泡(CO2)使口感更好,说明维生素C具有
(4)为防止烹调时蔬菜中维生素C的损失,烹调蔬菜应注意
您最近一年使用:0次
名校
4 . 回答下列问题:
I.KClO3和浓盐酸在一定温度下反应会生成黄绿色的有毒气体氯气。其变化可表示为: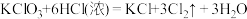 。
。
(1)请用“双线桥”表示上述反应电子转移的方向和数目___________ 。
(2)反应中,氧化剂为___________ ,氧化产物为:___________ 。
(3)浓盐酸在反应中体现出来的性质有___________ (填序号)。
①还原性 ②酸性 ③氧化性 ④碱性
Ⅱ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(4)干法制备高铁酸钠的主要反应为 ,该反应中还原剂是
,该反应中还原剂是___________ 。(填化学式)
(5)湿法制备高铁酸钾(K2FeO4)是在碱性环境中进行,反应体系中有六种反应微粒:Fe(OH)3、ClO-、OH-、 、Cl-、H2O。
、Cl-、H2O。
①请依据上述信息,写出并配平湿法制高铁酸钾的离子反应方程式:___________ 。
②每生成1个 转移
转移___________ 个电子。
I.KClO3和浓盐酸在一定温度下反应会生成黄绿色的有毒气体氯气。其变化可表示为:
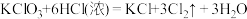 。
。(1)请用“双线桥”表示上述反应电子转移的方向和数目
(2)反应中,氧化剂为
(3)浓盐酸在反应中体现出来的性质有
①还原性 ②酸性 ③氧化性 ④碱性
Ⅱ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(4)干法制备高铁酸钠的主要反应为
 ,该反应中还原剂是
,该反应中还原剂是(5)湿法制备高铁酸钾(K2FeO4)是在碱性环境中进行,反应体系中有六种反应微粒:Fe(OH)3、ClO-、OH-、
 、Cl-、H2O。
、Cl-、H2O。①请依据上述信息,写出并配平湿法制高铁酸钾的离子反应方程式:
②每生成1个
 转移
转移
您最近一年使用:0次
21-22高二下·全国·单元测试
解题方法
5 . 同周期、同主族元素性质的递变规律
| 性质 | 同一周期(从左到右) | 同一主族(从上到下) | |
| 核外电子的排布 | 能层数 | ||
| 最外层电子数 | 1→2或8 | ||
| 金属性 | |||
| 非金属性 | |||
| 单质的氧化性、还原性 | 氧化性 | ||
| 还原性 | |||
| 最高价氧化物对应水化物的酸碱性 | 酸性 | ||
| 碱性 | |||
| 气态氢化物的稳定性 | |||
| 第一电离能 | |||
| 电负性 | |||
您最近一年使用:0次
解题方法
6 . 研究或认识物质的化学性质一般可从以下几个方面入手(以SiO2为例)。
(1)从物质分类角度分析可能具有的通性,如酸性、碱性等。
SiO2属于_______ (填“酸性”“碱性”或“两性”)氧化物。盛装NaOH等碱性溶液的试剂瓶不能用玻璃塞,其原因为________ (用离子方程式表示)。
(2)从核心元素化合价角度分析可能具有氧化性、还原性。
据SiO2中Si元素的价态可推知SiO2______ (填字母序号)。
A.只有还原性 B.只有氧化性 C.既有还原性又有氧化性
工业上用石英砂和焦炭混合高温制取粗硅,其反应为: ,用双线桥法标出该反应中电子转移的方向和数目
,用双线桥法标出该反应中电子转移的方向和数目________ 。
(3)从其它角度认识物质可能具有的特性,SiO2能与氢氟酸(HF)反应,工业上常利用该反应刻蚀玻璃,反应的化学方程式为:_______ 。
(1)从物质分类角度分析可能具有的通性,如酸性、碱性等。
SiO2属于
(2)从核心元素化合价角度分析可能具有氧化性、还原性。
据SiO2中Si元素的价态可推知SiO2
A.只有还原性 B.只有氧化性 C.既有还原性又有氧化性
工业上用石英砂和焦炭混合高温制取粗硅,其反应为:
 ,用双线桥法标出该反应中电子转移的方向和数目
,用双线桥法标出该反应中电子转移的方向和数目(3)从其它角度认识物质可能具有的特性,SiO2能与氢氟酸(HF)反应,工业上常利用该反应刻蚀玻璃,反应的化学方程式为:
您最近一年使用:0次
解题方法
7 . 利用下图,可以从不同角度研究含氯物质的性质及其转化关系,图中甲~辛均含氯元素。回答下列问题:
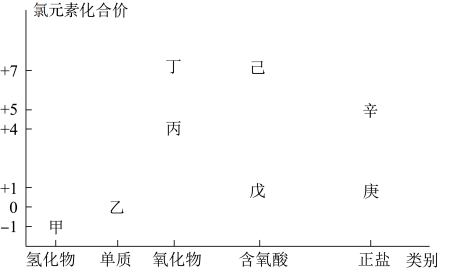
(1)丁属于___________ (“酸性”或“碱性”)氧化物;
(2)图中甲、乙、丙、戊中,属于电解质的是___________ (填化学式);根据氯元素的化合价判断,乙物质___________ ;
A. 只有氧化性 B. 只有还原性 C. 既有氧化性又有还原性
(3)电解甲溶液制备己的化学反应为: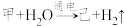 (未配平),则配平后参与反应的甲与H2O的物质的量之比是
(未配平),则配平后参与反应的甲与H2O的物质的量之比是___________ ;
(4)庚是漂白粉的有效成分,用乙制取庚的化学方程式为___________ ;
(5)已知己是最强的无机酸,写出己的电离方程式___________ 。

(1)丁属于
(2)图中甲、乙、丙、戊中,属于电解质的是
A. 只有氧化性 B. 只有还原性 C. 既有氧化性又有还原性
(3)电解甲溶液制备己的化学反应为:
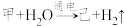 (未配平),则配平后参与反应的甲与H2O的物质的量之比是
(未配平),则配平后参与反应的甲与H2O的物质的量之比是(4)庚是漂白粉的有效成分,用乙制取庚的化学方程式为
(5)已知己是最强的无机酸,写出己的电离方程式
您最近一年使用:0次
2021-11-17更新
|
1158次组卷
|
4卷引用:辽宁省沈阳市五校协作体2021-2022学年高一上学期期中联考化学试题
8 . 预测元素及其化合物的性质
| 项目 | 同周期(左→右) | 同主族(上→下) | |
| 原子 结构 | 核电荷数 | 逐渐 | 逐渐 |
| 电子层结构 | 电子层数 | 电子层数 | |
| 原子半径 | 逐渐 | 逐渐 | |
| 离子半径 | 阳离子逐渐减小,阴离子逐渐减小,但r(阴离子)>r(阳离子) | 逐渐增大 | |
| 性 质 | 主要化合价 | 元素的最高正化合价由+1→+7(O、F除外) 非金属元素负价由-4→-1 非金属元素负化合价= —(8—主族序数) | 相同 最高正化合价=主族序数 (O、F除外) |
| 元素的金属性 | 金属性逐渐 | 金属性逐渐 | |
| 元素的非金属性 | 非金属性逐渐 | 非金属性逐渐 | |
| 失电子能力 | 失电子逐渐减弱 | 失电子逐渐增强 | |
| 得电子能力 | 得电子逐渐增强 | 得电子逐渐减弱 | |
| 单质的还原性 | 还原性逐渐减弱 | 还原性逐渐增强 | |
| 单质的氧化性 | 氧化性逐渐增强 | 氧化性逐渐减弱 | |
| 阳离子的氧化性 | 阳离子氧化性逐渐增强 | 阳离子氧化性逐渐减弱 | |
| 阴离子的还原性 | 阴离子还原性逐渐减弱 | 阴离子还原性逐渐增强 | |
| 非金属元素气态氢化物的形成及稳定性 | 气态氢化物的形成越来越容易,其稳定性逐渐增强 | 气态氢化物的形成越来越困难,其稳定性逐渐减弱 | |
| 最高价氧化物对应水化物的酸碱性 | 碱性逐渐减弱 酸性逐渐增强 | 碱性逐渐增强 酸性逐渐减弱 | |
您最近一年使用:0次
9 . 某兴趣小组研究亚硝酸钠,查阅下列资料,试根据信息回答下列问题。
(1)已知NaNO2能发生如下反应: 2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。请用双线桥表示电子转移的方向和数目。________________ ;该反应中氧化剂是_____ ;若有0.75mol电子转移,则被还原的氧化剂粒子数为_______ 。(用NA表示)
(2)误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+而中毒,可服用维生素C解毒。下列分析错误的是______ (填序号)。
A.NaNO2被还原 B.维生素C具有还原性
C.还原性: 维生素C > Fe2+ D.NaNO2是还原剂
(3)下列方法中,可用来区分NaNO2和NaCl的是______ (填序号)。
A. 焰色反应 B.分别滴加酸化FeSO4溶液和KSCN溶液
C.在酸性条件下加入KI 淀粉溶液 D.分别滴加AgNO3溶液
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:_______________ 。
| 药品 | NaNO2 (亚硝酸钠) |
| 性质 | 1.在酸性溶液中有较强氧化性,能将Fe2+ 氧化成Fe3+ ; 2.AgNO2是一种难溶于水、易溶于酸的盐。 |
(1)已知NaNO2能发生如下反应: 2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。请用双线桥表示电子转移的方向和数目。
(2)误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+而中毒,可服用维生素C解毒。下列分析错误的是
A.NaNO2被还原 B.维生素C具有还原性
C.还原性: 维生素C > Fe2+ D.NaNO2是还原剂
(3)下列方法中,可用来区分NaNO2和NaCl的是
A. 焰色反应 B.分别滴加酸化FeSO4溶液和KSCN溶液
C.在酸性条件下加入KI 淀粉溶液 D.分别滴加AgNO3溶液
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:
您最近一年使用:0次
2018-01-31更新
|
534次组卷
|
6卷引用:四川省成都市2017-2018学年高一上期期末调研考试化学试题
10 . 下表是周期表中的一部分,根据A-I在周期表中的位置,第(1)~(4)小题用元素符号或化学式 回答,(5)~(8)小题按题目要求回答。
(1)表中元素,化学性质最不活泼的是_______ ,只有负价而无正价的是_______ ,氧化性最强的单质是_______ ,还原性最强的单质是_______ 。
(2)最高价氧化物的水化物碱性最强的是_______ ,酸性最强的是_______ ,呈两性的是_______ 。
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的_______ 。
(4)在B、C、E、F、G、H中,原子半径最大的是_______ 。
(5)A和D组成化合物的电子式_______ 。
(6)用电子式表示B和H组成化合物的形成过程_______ 。
(7)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式_______
族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(2)最高价氧化物的水化物碱性最强的是
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的
(4)在B、C、E、F、G、H中,原子半径最大的是
(5)A和D组成化合物的电子式
(6)用电子式表示B和H组成化合物的形成过程
(7)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式
您最近一年使用:0次



