名校
1 . 某小组同学做“硫在氧气中燃烧”的实验时,老师建议在集气瓶底部放少量NaOH溶液吸收生成的SO2。这种做法引起了同学们的思考:SO2与NaOH是否发生反应。
【查阅资料】通常状况下,1体积水约能溶解40体积SO2。
【实验方案】同学们向充满SO2的软塑料瓶中迅速倒入一定量NaOH溶液,拧紧瓶盖,振荡,发现塑
料瓶变瘪,他们认为SO2与NaOH发生了反应。
【反思与改进】甲同学认为上述实验不够严谨,理由是_________________ 。于是同学们设计了如下两
个改进方案。
方案一:
乙同学认为由于两个瓶子变瘪的程度完全相同,因此无法证明SO2与NaOH是否发生了反应。试分析导致两个瓶子变瘪的程度完全相同的原因是_____________________ 。他认为若改变注入水和NaOH溶液的体积便可达到实验目的,注入液体的体积可以是__________ (填序号)。
a.15 mL b.8 mL c.5 mL d.3 mL
方案二:
丙同学认为上述方案也无法证明SO2与NaOH是否发生反应。你认为导致吸入液体的体积完全相同的原因是___________________ 。
丁同学思考后,将上述装置进行了改进,便达到实验目的。改进装置如下图所示,你认为装置B的作用是_______________ 。
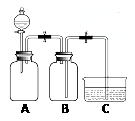
【查阅资料】通常状况下,1体积水约能溶解40体积SO2。
【实验方案】同学们向充满SO2的软塑料瓶中迅速倒入一定量NaOH溶液,拧紧瓶盖,振荡,发现塑
料瓶变瘪,他们认为SO2与NaOH发生了反应。
【反思与改进】甲同学认为上述实验不够严谨,理由是
个改进方案。
方案一:
| 实验操作 | 实验现象 |
| 向两个充满SO2的200 mL软塑料瓶中分别注入10 mL水和NaOH溶液,振荡,对比。 | 两个瓶子变瘪的程度完全相同 |
乙同学认为由于两个瓶子变瘪的程度完全相同,因此无法证明SO2与NaOH是否发生了反应。试分析导致两个瓶子变瘪的程度完全相同的原因是
a.15 mL b.8 mL c.5 mL d.3 mL
方案二:
| 实验操作 | 实验现象 |
| 利用如图所示装置进行实验: 向两个充满SO2的300 mL集气瓶 中分别加入6 mL水和NaOH溶液, 一段时间后,打开止水夹,对比。 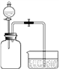 | 倒吸入两个集气瓶中的液体体积完全相同 |
丙同学认为上述方案也无法证明SO2与NaOH是否发生反应。你认为导致吸入液体的体积完全相同的原因是
丁同学思考后,将上述装置进行了改进,便达到实验目的。改进装置如下图所示,你认为装置B的作用是

您最近一年使用:0次
名校
2 . 中国疾控中心指出,消毒是疫情防控的重要措施。含氯消毒剂是一种高效、安全的杀菌消毒剂。
I.
(1)已知HClO的杀菌能力比ClO-强。25℃时将氯气溶于水形成氯气—氯水体系,该体系中Cl2(aq)、HClO和 ClO-的物质的量分数(α)随pH变化的关系如图所示。
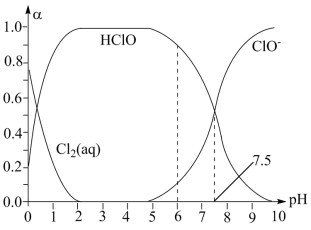
由图分析,用氯气处理饮用水时,pH=6与pH=7.5两种情况下,pH=___________ 时杀菌效果强;当pH=7.5时,氯水中含氯元素的微粒有HClO、ClO-和___________ 。
(2)84消毒液是一种家庭常用消毒剂,但不能用于钢制器具的消毒,原因是___________ ;在使用时不能与洁厕灵(主要成分为盐酸)混合使用,混合时会产生黄绿色的有毒气体,其反应的离子方程式为___________ 。
(3) 是国际上公认的高效、安全的杀菌消毒剂。工业制备ClO2的反应原理为:
是国际上公认的高效、安全的杀菌消毒剂。工业制备ClO2的反应原理为: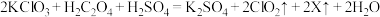 ,X的化学式为
,X的化学式为___________ ,每生成1mol ClO2,反应中转移电子___________ mol。
II.如图是实验室制备氯气并进行一系列相关实验的装置(部分夹持装置已略去)。
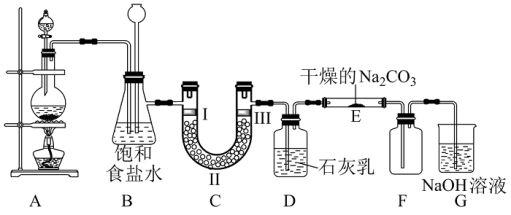
(4)装置B有安全瓶作用,监测实验进行时C中是否发生堵塞,发生堵塞时B中的现象为___________ 。
(5)装置E中潮湿的Cl2与Na2CO3以物质的量比2:1反应,生成Cl2O气体,试写出该反应的化学方程式:___________ 。
I.
(1)已知HClO的杀菌能力比ClO-强。25℃时将氯气溶于水形成氯气—氯水体系,该体系中Cl2(aq)、HClO和 ClO-的物质的量分数(α)随pH变化的关系如图所示。

由图分析,用氯气处理饮用水时,pH=6与pH=7.5两种情况下,pH=
(2)84消毒液是一种家庭常用消毒剂,但不能用于钢制器具的消毒,原因是
(3)
 是国际上公认的高效、安全的杀菌消毒剂。工业制备ClO2的反应原理为:
是国际上公认的高效、安全的杀菌消毒剂。工业制备ClO2的反应原理为: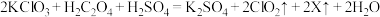 ,X的化学式为
,X的化学式为II.如图是实验室制备氯气并进行一系列相关实验的装置(部分夹持装置已略去)。

(4)装置B有安全瓶作用,监测实验进行时C中是否发生堵塞,发生堵塞时B中的现象为
(5)装置E中潮湿的Cl2与Na2CO3以物质的量比2:1反应,生成Cl2O气体,试写出该反应的化学方程式:
您最近一年使用:0次
解题方法
3 . 合成氨是重要的研究课题。粮食生产依赖于合成氨工业,氨也被认为是一种具有潜在应用前景的能源载体。
(1)NH3是1754年研究人员加热氯化铵和石灰的混合物时发现的。现在依然利用上述原理制取少量NH3,实验室可用下图所示装置(夹持仪器略)制备并收集NH3。

①加热氯化铵和石灰反应的化学方程式是_______ 。
②将方框中的收集装置补充完整_______ 。
③用湿润的红色石蕊试纸检验NH3,_______ (填现象),说明检出NH3。
(2)工业由N2和H2直接合成氨是获得大量氨的主要途径。研究人员采用表面技术手段,从原子层面上较为清晰的揭示了该反应的微观历程,示意如下:

①上述过程中吸收能量的是_______ (填写序号)。
②工业合成氨的化学方程式是:_______ 。
(3)以N2和H2为原料直接合成NH3能耗高,科研人员利用选用NH4Cl固体进行转化。合成氨的过程如下:
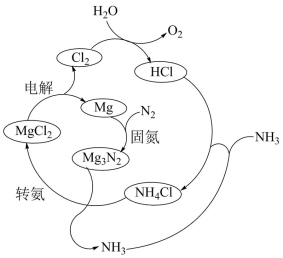
①合成氨的总反应方程式是_______ 。
②实验研究:查阅资料,同位素示踪法可以证实 中的氮元素在“转氨”过程中能转变为氨。
中的氮元素在“转氨”过程中能转变为氨。
实验:将_______ (填化学式)两种物质混合,充分反应。
检测结果:经探测仪器检测,所得氨气中存在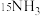 。
。
③测量 的转化率:取固体
的转化率:取固体 、NH4Cl的混合物
、NH4Cl的混合物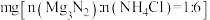 ,混匀,充分反应。生成的NH3与
,混匀,充分反应。生成的NH3与 的H2SO4恰好完全反应。
的H2SO4恰好完全反应。 的转化率为
的转化率为_______ 。( 摩尔质量为
摩尔质量为 、
、 摩尔质量为
摩尔质量为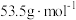 )
)
(1)NH3是1754年研究人员加热氯化铵和石灰的混合物时发现的。现在依然利用上述原理制取少量NH3,实验室可用下图所示装置(夹持仪器略)制备并收集NH3。

①加热氯化铵和石灰反应的化学方程式是
②将方框中的收集装置补充完整
③用湿润的红色石蕊试纸检验NH3,
(2)工业由N2和H2直接合成氨是获得大量氨的主要途径。研究人员采用表面技术手段,从原子层面上较为清晰的揭示了该反应的微观历程,示意如下:

①上述过程中吸收能量的是
②工业合成氨的化学方程式是:
(3)以N2和H2为原料直接合成NH3能耗高,科研人员利用选用NH4Cl固体进行转化。合成氨的过程如下:

①合成氨的总反应方程式是
②实验研究:查阅资料,同位素示踪法可以证实
 中的氮元素在“转氨”过程中能转变为氨。
中的氮元素在“转氨”过程中能转变为氨。实验:将
检测结果:经探测仪器检测,所得氨气中存在
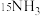 。
。③测量
 的转化率:取固体
的转化率:取固体 、NH4Cl的混合物
、NH4Cl的混合物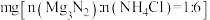 ,混匀,充分反应。生成的NH3与
,混匀,充分反应。生成的NH3与 的H2SO4恰好完全反应。
的H2SO4恰好完全反应。 的转化率为
的转化率为 摩尔质量为
摩尔质量为 、
、 摩尔质量为
摩尔质量为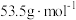 )
)
您最近一年使用:0次
4 . 如图为实验室制备乙炔并进行性质验证的装置(夹持仪器已略去)。
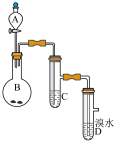
(1)实验开始前,首先进行的操作是___ ;
(2)实验室制备乙炔的方程式为___ ;
(3)仪器A在安装前必须进行的操作是___ ,为防止气体生成的速率过快,由A滴入B的试剂为___ 。
(4)装置C可选用的试剂为___ (写出一种即可),其作用为___ ;
(5)反应开始后,D中的现象为___ ,所发生反应的反应类型为___ ;
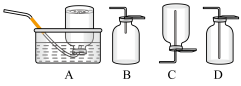
(6)D中验证实验结束后。B中反应仍在继续。此时可撤去装置D,在装置C之后连接收集装置,以下装置中最适合用于收集乙炔的是___ 。

(1)实验开始前,首先进行的操作是
(2)实验室制备乙炔的方程式为
(3)仪器A在安装前必须进行的操作是
(4)装置C可选用的试剂为
(5)反应开始后,D中的现象为
(6)D中验证实验结束后。B中反应仍在继续。此时可撤去装置D,在装置C之后连接收集装置,以下装置中最适合用于收集乙炔的是

您最近一年使用:0次
2019-11-13更新
|
870次组卷
|
4卷引用:安徽省合肥市第八中学2021-2022学年高二下学期实验班开学考化学试题
安徽省合肥市第八中学2021-2022学年高二下学期实验班开学考化学试题云南省云天化中学2019-2020学年高二上学期期中考试化学试题(已下线)2.2.2 炔烃-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修3)第二章 烃
解题方法
5 . 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响,在常温下按照如下方案完成实验。
(1)催化剂能加快化学反应速率的原因_______ 。
(2)实验①和②的目的是_______ 。实验时由于较长时间没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是_______ 。
(3)写出实验③的化学反应方程式:_______ 。
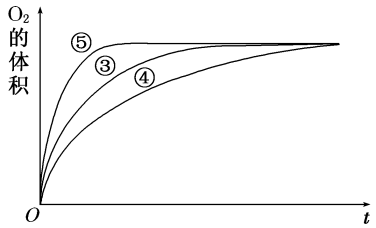
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。分析如图能够得出的实验结论是_______ 。
| 实验编号 | 反应物 | 催化剂 |
| ① | 10 mL 2% H2O2溶液 | 无 |
| ② | 10 mL 5% H2O2溶液 | 无 |
| ③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol • L-1 FeCl3溶液 |
| ④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol • L-1 FeCl3溶液 |
| ⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol • L-1 FeCl3溶液 |
(2)实验①和②的目的是
(3)写出实验③的化学反应方程式:
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。分析如图能够得出的实验结论是

您最近一年使用:0次
6 . 已知Fe3+与 之间的反应是可逆反应:
之间的反应是可逆反应: 。某同学对该反应的可逆性进行实验。实验过程如下:
。某同学对该反应的可逆性进行实验。实验过程如下:
①将2mL0.004 KI溶液放入试管中,然后加入VmL0.004
KI溶液放入试管中,然后加入VmL0.004 FeCl3溶液并立即振荡。
FeCl3溶液并立即振荡。
②将充分反应后的①中溶液分成三份,分别放入A、B、C三个试管中,向A中加入3滴淀粉溶液,向B中加入3滴X溶液,向C中加入3滴蒸馏水。
回答下列问题:
(1)为达到预期实验目的,
_______ ,常用试剂X是_______ ,当A、B中溶液出现预期现象时,可确定该反应是可逆反应。
(2)假设实验①中V=2且忽略溶液体积的变化,反应经5s末时溶液颜色稳定不变且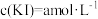 。则前5s内v(I2)=
。则前5s内v(I2)=_______ 。在图1的坐标系中画出用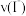 表示正、逆反应速率随时间的变化示意图
表示正、逆反应速率随时间的变化示意图_____ ;在图2的坐标系中画出c(Fe2+)随时间的变化图象______ 。


图1 图2
(3)若向C试管中加入少量固体KCl,振荡后静置,溶液颜色_______ (填“变深”“变浅”或“不变”)。
 之间的反应是可逆反应:
之间的反应是可逆反应: 。某同学对该反应的可逆性进行实验。实验过程如下:
。某同学对该反应的可逆性进行实验。实验过程如下:①将2mL0.004
 KI溶液放入试管中,然后加入VmL0.004
KI溶液放入试管中,然后加入VmL0.004 FeCl3溶液并立即振荡。
FeCl3溶液并立即振荡。②将充分反应后的①中溶液分成三份,分别放入A、B、C三个试管中,向A中加入3滴淀粉溶液,向B中加入3滴X溶液,向C中加入3滴蒸馏水。
回答下列问题:
(1)为达到预期实验目的,

(2)假设实验①中V=2且忽略溶液体积的变化,反应经5s末时溶液颜色稳定不变且
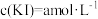 。则前5s内v(I2)=
。则前5s内v(I2)=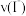 表示正、逆反应速率随时间的变化示意图
表示正、逆反应速率随时间的变化示意图

图1 图2
(3)若向C试管中加入少量固体KCl,振荡后静置,溶液颜色
您最近一年使用:0次
名校
7 . I.对于混合物的分离或提纯,常采用的方法有:①过滤、②蒸发、③蒸馏、④萃取、⑤加热分解等。下列各组混合物的分离或提纯应采用什么方法?(填序号)
(1)提取碘水中的碘______ 。
(2)除去食盐溶液中的水______ 。
(3)淡化海水______ 。
(4)KCl中含有KClO3______ 。
II.根据以下装置图,回答下列问题:
写出仪器名称②______ ③ ______ ;仪器①~④中,使用时必须检查是否漏水的有 ______ (填序号)。
III.某课外活动小组设计下列实验装置,验证“二氧化碳与水接触时才能和过氧化钠反应”。
(1)过氧化钠与水反应的化学方程式是______ 。
(2)装置I是制备纯净的______ (填化学式)。则装置I中最适宜的试剂组合是 __ (填字母) 。
a. 稀盐酸 b.稀硫酸 c.小苏打 d.石灰石
(3)实验时,应先打开弹簧夹K2,关闭K1,观察到预期现象后,打开K1,再关闭K2。
(4)实验过程中将带火星的木条置于a口,观察到带火星的木条始终不复燃。
①为观察到最终木条复燃,甲建议在Ⅲ后安装一个盛有碱石灰的干燥管,目的是______ ;
②乙认为即使采纳甲的建议且最终观察到木条复燃,也不能证明CO2参与了反应,原因是______ 。
(1)提取碘水中的碘
(2)除去食盐溶液中的水
(3)淡化海水
(4)KCl中含有KClO3
II.根据以下装置图,回答下列问题:

写出仪器名称②
III.某课外活动小组设计下列实验装置,验证“二氧化碳与水接触时才能和过氧化钠反应”。

(1)过氧化钠与水反应的化学方程式是
(2)装置I是制备纯净的
a. 稀盐酸 b.稀硫酸 c.小苏打 d.石灰石
(3)实验时,应先打开弹簧夹K2,关闭K1,观察到预期现象后,打开K1,再关闭K2。
(4)实验过程中将带火星的木条置于a口,观察到带火星的木条始终不复燃。
①为观察到最终木条复燃,甲建议在Ⅲ后安装一个盛有碱石灰的干燥管,目的是
②乙认为即使采纳甲的建议且最终观察到木条复燃,也不能证明CO2参与了反应,原因是
您最近一年使用:0次
8 . 氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注。
Ⅰ.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照下表所示的方案完成实验。
(1)实验①和②的目的是______________________ 。
同学们进行实验时没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进方法是_______________ (填一种即可)。
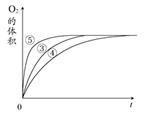
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图1所示。分析该图能够得出的实验结论是_____________________ 。
Ⅱ.资料显示,某些金属离子对H2O2的分解起催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,该实验小组的同学设计了如图2所示的实验装置进行实验。
(1)某同学通过测定O2的体积来比较H2O2的分解速率快慢,实验时可以通过测量______________________________________ 来比较。
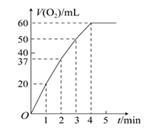
(2)0.1 g MnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如下图所示。解释反应速率变化的原因:_______________ 。
(3)根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法不正确的是_________ (填序号)。
A.化学反应速率理论可以指导怎样在一定时间内快出产品
B.勒夏特列原理可以指导怎样使有限原料多出产品
C.催化剂的使用是提高产品产率的有效办法
D.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
Ⅰ.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照下表所示的方案完成实验。
| 实验编号 | 反应物 | 催化剂 |
| ① | 10 mL 2%H2O2溶液 | 无 |
| ② | 10 mL 5%H2O2溶液 | 无 |
| ③ | 10 mL 5%H2O2溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
| ④ | 10 mL 5%H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
| ⑤ | 10 mL 5%H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |

(1)实验①和②的目的是
同学们进行实验时没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进方法是
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图1所示。分析该图能够得出的实验结论是

Ⅱ.资料显示,某些金属离子对H2O2的分解起催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,该实验小组的同学设计了如图2所示的实验装置进行实验。
(1)某同学通过测定O2的体积来比较H2O2的分解速率快慢,实验时可以通过测量
(2)0.1 g MnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如下图所示。解释反应速率变化的原因:

(3)根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法不正确的是
A.化学反应速率理论可以指导怎样在一定时间内快出产品
B.勒夏特列原理可以指导怎样使有限原料多出产品
C.催化剂的使用是提高产品产率的有效办法
D.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
您最近一年使用:0次
2016-12-09更新
|
179次组卷
|
3卷引用:安徽省毫州市涡阳第—中学2021-2022学年高二上学期第一次教学质量检测化学试题
名校
9 . 已知,在木炭还原氧化铜的实验中发生的主要反应是C+2CuO 2Cu+CO2↑。某化学实验小组对该实
2Cu+CO2↑。某化学实验小组对该实
验产物(假设已完全反应)进行了如下探究:
探究一:检验产物的成分
【提出问题】实验产物是暗红色固体,很难观察到紫红色固体,那么该暗红色固体物质是什么?
【查阅资料】氧化亚铜(Cu2O)为红色固体,可以和硫酸反应:Cu2O+H2SO4═CuSO4+Cu+H2O。
【猜想假设】暗红色固体除铜外还可能含有Cu2O。
【设计实验】取少量暗红色固体,加入稀硫酸,如果观察到_______________ ,说明猜想正确。
探究二:测定产物中Cu2O的含量

【查阅资料】草酸在浓硫酸的作用下会分解为CO和CO2
【设计实验】称取固体样品6.0g,置于上右图装置D中进行实验(固定装置略去,碱石灰为氧化钙和氢氧化钠的混合物),通过测定反应前后装置E的质量达到实验目的。
(1)证明草酸的分解产物中有CO2存在的是_______________ 。
(2)装置C的作用是__________________ 。
(3)写出装置D中反应的化学方程式___________________________ 。
(4)下列为加热装置前所涉及的部分操作,正确的顺序是_________ (填序号)。
①检查装置的气密性 ②关闭K2,打开K1,使装置A中的反应先进行一段时间
③连接仪器 ④关闭K1,打开K2
(5)若装置E在反应前后的质量分别为30.1g和31.2g,则该固体样品中Cu2O的质量分数为__________ 。
指出该装置的不足之处,说明不足的理由并给出改进方案__________________ 。
 2Cu+CO2↑。某化学实验小组对该实
2Cu+CO2↑。某化学实验小组对该实验产物(假设已完全反应)进行了如下探究:
探究一:检验产物的成分
【提出问题】实验产物是暗红色固体,很难观察到紫红色固体,那么该暗红色固体物质是什么?
【查阅资料】氧化亚铜(Cu2O)为红色固体,可以和硫酸反应:Cu2O+H2SO4═CuSO4+Cu+H2O。
【猜想假设】暗红色固体除铜外还可能含有Cu2O。
【设计实验】取少量暗红色固体,加入稀硫酸,如果观察到
探究二:测定产物中Cu2O的含量

【查阅资料】草酸在浓硫酸的作用下会分解为CO和CO2
【设计实验】称取固体样品6.0g,置于上右图装置D中进行实验(固定装置略去,碱石灰为氧化钙和氢氧化钠的混合物),通过测定反应前后装置E的质量达到实验目的。
(1)证明草酸的分解产物中有CO2存在的是
(2)装置C的作用是
(3)写出装置D中反应的化学方程式
(4)下列为加热装置前所涉及的部分操作,正确的顺序是
①检查装置的气密性 ②关闭K2,打开K1,使装置A中的反应先进行一段时间
③连接仪器 ④关闭K1,打开K2
(5)若装置E在反应前后的质量分别为30.1g和31.2g,则该固体样品中Cu2O的质量分数为
指出该装置的不足之处,说明不足的理由并给出改进方案
您最近一年使用:0次
名校
10 . I.现有下列10种物质:。①铜②熔融 ③
③ ④
④ ⑤
⑤ 晶体⑥胆矾⑦碳酸钙⑧
晶体⑥胆矾⑦碳酸钙⑧ ⑨盐酸⑩酒精
⑨盐酸⑩酒精
(1)上述物质中属于电解质的有___________ 。
(2)属于非电解质的有___________ ,能导电的有___________ 。(填序号)
(3)⑧在熔化状态下电离方程式为:___________ 。
(4)少量④通入③的溶液中,反应的离子方程式为:___________ 。
(5)写出⑤在水溶液中的电离方程式:___________ 。
(6)向 溶液逐滴加入
溶液逐滴加入 溶液至
溶液至 恰好完全沉淀,发生反应的离子方程式为
恰好完全沉淀,发生反应的离子方程式为___________ ,然后继续滴加 溶液时,此步发生反应的离子方程式为
溶液时,此步发生反应的离子方程式为___________ 。
II.现有课外活动小组进行胶体的制备并检验其性质,甲同学在小烧杯中加入 蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和
蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和 溶液,继续煮沸溶液呈红褐色,停止加热,即制得胶体。
溶液,继续煮沸溶液呈红褐色,停止加热,即制得胶体。
(7)① 胶粒带
胶粒带___________ 电荷(填“正”或“负”),写出制备 胶体的离子反应方程式
胶体的离子反应方程式___________ 。
②乙同学将用氯化铁溶液制得的氢氧化铁胶体放入半透膜制成的袋内,如图所示:
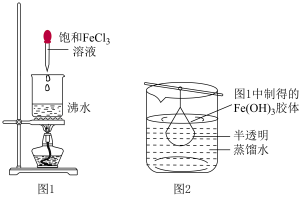
取图2中半透膜内的液体少许于试管中,向其中逐滴滴加稀硫酸,可观察到现象为___________ ,请写出此过程中发生反应的离子方程式___________ 。
 ③
③ ④
④ ⑤
⑤ 晶体⑥胆矾⑦碳酸钙⑧
晶体⑥胆矾⑦碳酸钙⑧ ⑨盐酸⑩酒精
⑨盐酸⑩酒精(1)上述物质中属于电解质的有
(2)属于非电解质的有
(3)⑧在熔化状态下电离方程式为:
(4)少量④通入③的溶液中,反应的离子方程式为:
(5)写出⑤在水溶液中的电离方程式:
(6)向
 溶液逐滴加入
溶液逐滴加入 溶液至
溶液至 恰好完全沉淀,发生反应的离子方程式为
恰好完全沉淀,发生反应的离子方程式为 溶液时,此步发生反应的离子方程式为
溶液时,此步发生反应的离子方程式为II.现有课外活动小组进行胶体的制备并检验其性质,甲同学在小烧杯中加入
 蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和
蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和 溶液,继续煮沸溶液呈红褐色,停止加热,即制得胶体。
溶液,继续煮沸溶液呈红褐色,停止加热,即制得胶体。(7)①
 胶粒带
胶粒带 胶体的离子反应方程式
胶体的离子反应方程式②乙同学将用氯化铁溶液制得的氢氧化铁胶体放入半透膜制成的袋内,如图所示:

取图2中半透膜内的液体少许于试管中,向其中逐滴滴加稀硫酸,可观察到现象为
您最近一年使用:0次



