名校
解题方法
1 . 如图为元素周期表的一部分,请根据元素①~⑧在表中的位置,回答下列问题:

(1)请写出元素⑦在元素周期表中的位置___________ 。在上述元素的最高价氧化物对应的水化物中,酸性最强的是___________ (用化学式表示)。
(2)由元素①、④、⑤形成的化合物的电子式为___________ ,该物质属于___________ (填“离子”或“共价”)化合物。
(3)③、④、⑤、⑥的简单离子半径由大到小的顺序是___________ (用离子符号表示)。
(4)在发生地震后,地震灾区需要大量的“84消毒液”来消毒杀菌。84消毒液(主要成分为NaClO)和洁厕灵(主要成分为盐酸)混合使用会产生一种有毒气体,写出两者混合时发生反应的离子方程式:___________ 。
(5)由表中元素形成的常见无机化合物A、B、C、X有以下转化关系:
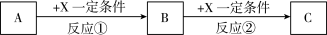
若A、B、C含同一金属元素,X为电解质溶液,可电离出 ,所有反应都在溶液中进行。B的化学式为
,所有反应都在溶液中进行。B的化学式为___________ ,X的化学式为___________ 。

(1)请写出元素⑦在元素周期表中的位置
(2)由元素①、④、⑤形成的化合物的电子式为
(3)③、④、⑤、⑥的简单离子半径由大到小的顺序是
(4)在发生地震后,地震灾区需要大量的“84消毒液”来消毒杀菌。84消毒液(主要成分为NaClO)和洁厕灵(主要成分为盐酸)混合使用会产生一种有毒气体,写出两者混合时发生反应的离子方程式:
(5)由表中元素形成的常见无机化合物A、B、C、X有以下转化关系:

若A、B、C含同一金属元素,X为电解质溶液,可电离出
 ,所有反应都在溶液中进行。B的化学式为
,所有反应都在溶液中进行。B的化学式为
您最近一年使用:0次
名校
解题方法
2 . 元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题:___________ ,I的最高价氧化物对应水化物的化学式为:___________ 。
(2)根据元素周期律等有关知识,推断:
①阴影部分元素的氢化物沸点最高的是___________ (填化学式)。
②O2-、Al3+、S2-三种离子半径大小顺序:___________ (用离子符号排序)。
(3)已知某主族元素离子结构示意图为 ,其中x-y=12,此元素在元素周期表中的位置为:
,其中x-y=12,此元素在元素周期表中的位置为:___________ 。
(4)卤素互化物(如IBr)与卤素单质性质相似。已知IBr能与水发生非氧化还原反应,写出IBr与水反应的化学方程式:___________ ;IBr中含有的化学键是___________ (填“离子键”、“极性键”或“非极性键”)。

(2)根据元素周期律等有关知识,推断:
①阴影部分元素的氢化物沸点最高的是
②O2-、Al3+、S2-三种离子半径大小顺序:
(3)已知某主族元素离子结构示意图为
 ,其中x-y=12,此元素在元素周期表中的位置为:
,其中x-y=12,此元素在元素周期表中的位置为:(4)卤素互化物(如IBr)与卤素单质性质相似。已知IBr能与水发生非氧化还原反应,写出IBr与水反应的化学方程式:
您最近一年使用:0次
名校
3 . 元素周期表体现了元素“位—构—性”的关系,揭示了元素间的内在联系。下图是元素周期表的一部分,回答下列问题:

(1)元素Ga在元素周期表中的位置为:第_______ 周期第_______ 族;
(2)Sn的最高正价为_______ ,Cl的最高价氧化物对应的水化物的化学式为_______ ,Bi的最高价氧化物为_______ ;
(3)根据元素周期律,推断:
①阴影部分元素氢化物热稳定性最强的是_______ 元素(填元素符号);
②H3AsO4、H2SeO4的酸性强弱:H3AsO4_______ (填“>”“<”或“=”)H2SeO4;
③氢化物的还原性:H2O_______ (填“>”“<”或“=”)H2S;
(4)Al的最高价氧化物可以和S的最高价氧化物的水化物反应,其反应方程式为_______ 。

(1)元素Ga在元素周期表中的位置为:第
(2)Sn的最高正价为
(3)根据元素周期律,推断:
①阴影部分元素氢化物热稳定性最强的是
②H3AsO4、H2SeO4的酸性强弱:H3AsO4
③氢化物的还原性:H2O
(4)Al的最高价氧化物可以和S的最高价氧化物的水化物反应,其反应方程式为
您最近一年使用:0次
2021-03-13更新
|
332次组卷
|
4卷引用:广东省湛江市第二十一中学2020-2021学年高一下学期期中考试化学试题
名校
4 . 以钛铁矿(主要成分为 ,还含有MgO、CaO、
,还含有MgO、CaO、 等杂质)为原料合成锂离子电池的电极材料钛酸锂(
等杂质)为原料合成锂离子电池的电极材料钛酸锂( )和磷酸亚铁锂(
)和磷酸亚铁锂( )的工艺流程如图:
)的工艺流程如图:

已知:“溶浸”后的溶液中含金属元素的离子主要包括 、
、 、
、 、
、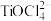 ;富铁元素主要以
;富铁元素主要以 形式存在;富钛渣中钛元素主要以
形式存在;富钛渣中钛元素主要以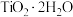 形式存在。
形式存在。
回答下列问题:
(1)“溶浸”时为加快浸取速率,可以采取的措施是___________ (答1条即可);“溶浸”过程 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(2)若在实验室模拟分离富钛渣和富铁液,则检验富钛渣洗涤干净的操作为___________ 。
(3)“沉铁”过程中需控制 ,其目的是
,其目的是___________ (答1条即可)。
(4)“溶钛”过程中Ti元素的浸出率与反应温度的关系如图所示,试分析40℃后Ti元素浸出率呈图像所示变化的原因:___________ 。

(5) 的晶胞结构如图1所示,设该晶胞的边长为a nm,
的晶胞结构如图1所示,设该晶胞的边长为a nm, 为阿伏伽德罗常数的值。Ti的价电子排布式为
为阿伏伽德罗常数的值。Ti的价电子排布式为___________ ,该晶体的密度
___________ (填含a的计算式)g⋅cm-3; 的结构的另一种表示如图2(晶胞中未标出Ti、O原子),画出沿z轴向xy平面投影时氧原子在xy平面的位置:
的结构的另一种表示如图2(晶胞中未标出Ti、O原子),画出沿z轴向xy平面投影时氧原子在xy平面的位置: 。
。________

 ,还含有MgO、CaO、
,还含有MgO、CaO、 等杂质)为原料合成锂离子电池的电极材料钛酸锂(
等杂质)为原料合成锂离子电池的电极材料钛酸锂( )和磷酸亚铁锂(
)和磷酸亚铁锂( )的工艺流程如图:
)的工艺流程如图:
已知:“溶浸”后的溶液中含金属元素的离子主要包括
 、
、 、
、 、
、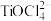 ;富铁元素主要以
;富铁元素主要以 形式存在;富钛渣中钛元素主要以
形式存在;富钛渣中钛元素主要以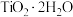 形式存在。
形式存在。回答下列问题:
(1)“溶浸”时为加快浸取速率,可以采取的措施是
 发生反应的离子方程式为
发生反应的离子方程式为(2)若在实验室模拟分离富钛渣和富铁液,则检验富钛渣洗涤干净的操作为
(3)“沉铁”过程中需控制
 ,其目的是
,其目的是(4)“溶钛”过程中Ti元素的浸出率与反应温度的关系如图所示,试分析40℃后Ti元素浸出率呈图像所示变化的原因:

(5)
 的晶胞结构如图1所示,设该晶胞的边长为a nm,
的晶胞结构如图1所示,设该晶胞的边长为a nm, 为阿伏伽德罗常数的值。Ti的价电子排布式为
为阿伏伽德罗常数的值。Ti的价电子排布式为
 的结构的另一种表示如图2(晶胞中未标出Ti、O原子),画出沿z轴向xy平面投影时氧原子在xy平面的位置:
的结构的另一种表示如图2(晶胞中未标出Ti、O原子),画出沿z轴向xy平面投影时氧原子在xy平面的位置: 。
。
您最近一年使用:0次
2023-05-20更新
|
471次组卷
|
2卷引用:广东省部分学校2023届高三5月联合考试化学试题
名校
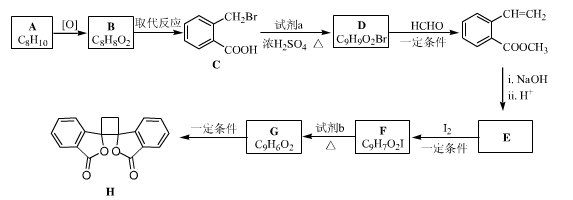
5 . 具有抗菌作用的白头翁素衍生物H的合成路线如下图所示:
已知:
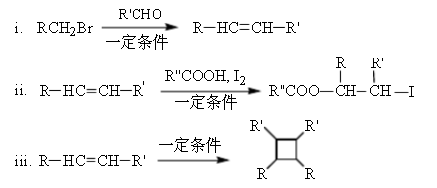
(以上R、R’、R’’代表氢、或烃基等)
(1)a属于芳香烃,名称是______________ ,B生成C的反应类型是__________ 。
(2)试剂a是(写结构简式)____________ ,HCHO的电子式是________________ 。
(3)E的结构简式是____________ 。
(4)由F生成G的化学方程式是_________ 。
(5)二取代芳香化合物W是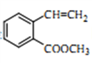 的同分异构体,能使溴的四氯化碳溶液褪色,能发生银镜反应,能发生水解反应,W共有
的同分异构体,能使溴的四氯化碳溶液褪色,能发生银镜反应,能发生水解反应,W共有_______ 种(不含顺反异构和其他立体异构)。其中核磁共振氢谱为五组峰的结构简式为___________ 。
(6)以乙醇为起始原料,结合已知信息选用必要的无机试剂合成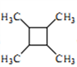 ,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。________________

已知:

(以上R、R’、R’’代表氢、或烃基等)
(1)a属于芳香烃,名称是
(2)试剂a是(写结构简式)
(3)E的结构简式是
(4)由F生成G的化学方程式是
(5)二取代芳香化合物W是
 的同分异构体,能使溴的四氯化碳溶液褪色,能发生银镜反应,能发生水解反应,W共有
的同分异构体,能使溴的四氯化碳溶液褪色,能发生银镜反应,能发生水解反应,W共有(6)以乙醇为起始原料,结合已知信息选用必要的无机试剂合成
 ,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
您最近一年使用:0次
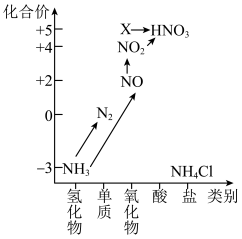
6 . 依据图中氮元素及其化合物的转化关系,回答下列问题:______ 。
(2)回答下列关于 的问题:
的问题:
①利用下列方法制氨气,其中合理的是______ (填字母)。
A.将浓氨水滴入氢氧化钠固体中
B.将氯化铵稀溶液滴入氧化钙固体中
C.将氯化铵固体加热分解
D.加热浓氨水
E.将浓氨水滴入碱石灰固体中
②氨气是重要的化工原料,可以合成多种物质,写出其催化氧化的化学方程式:______ 。
③ 、
、 合成
合成 的反应中,当分别用以下各种物质表示反应速率时,则反应速率最快的是
的反应中,当分别用以下各种物质表示反应速率时,则反应速率最快的是______ 。
A. B.
B.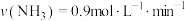
C.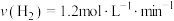 D.
D.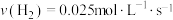
(3)下列关于NO、 的问题:
的问题:
①汽车排气管上装有催化转化器可减少尾气对环境的污染,汽车尾气中的有害气体C0和NO反应可转化为无害气体排放,写出相关反应的化学方程式:______ 。
②NO和 按一定比例混合可以被NaOH溶液完全吸收生成一种正盐,写出相关反应的化学方程式:
按一定比例混合可以被NaOH溶液完全吸收生成一种正盐,写出相关反应的化学方程式:______ 。
(2)回答下列关于
 的问题:
的问题:①利用下列方法制氨气,其中合理的是
A.将浓氨水滴入氢氧化钠固体中
B.将氯化铵稀溶液滴入氧化钙固体中
C.将氯化铵固体加热分解
D.加热浓氨水
E.将浓氨水滴入碱石灰固体中
②氨气是重要的化工原料,可以合成多种物质,写出其催化氧化的化学方程式:
③
 、
、 合成
合成 的反应中,当分别用以下各种物质表示反应速率时,则反应速率最快的是
的反应中,当分别用以下各种物质表示反应速率时,则反应速率最快的是A.
 B.
B.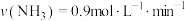
C.
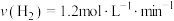 D.
D.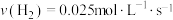
(3)下列关于NO、
 的问题:
的问题:①汽车排气管上装有催化转化器可减少尾气对环境的污染,汽车尾气中的有害气体C0和NO反应可转化为无害气体排放,写出相关反应的化学方程式:
②NO和
 按一定比例混合可以被NaOH溶液完全吸收生成一种正盐,写出相关反应的化学方程式:
按一定比例混合可以被NaOH溶液完全吸收生成一种正盐,写出相关反应的化学方程式:
您最近一年使用:0次
名校
解题方法
7 . 依据下图中氮元素及其化合物的转化关系,回答问题:

(1)图1中,X的化学式为_______ ,从化合价上看,X具有_______ (填“氧化”或“还原”)性。
(2)回答下列关于 的问题:
的问题:
①实验室制取氨气的化学方程式为_______ 。
②下列试剂能用于干燥 的是
的是_______ (填字母)。
A.浓硫酸 B.碱石灰 C.无水氯化钙 D.五氧化二磷固体
③氨气是重要的化工原料,可以合成多种物质,写出其催化氧化的化学方程式:_______ 。
(3)回答下列关于NO、 的问题:
的问题:
①汽车排气管上装有催化转化器可减少尾气对环境的污染,汽车尾气中的有害气体CO和NO反应可转化为无害气体排放,写出相关反应的化学方程式:_______ 。转化标准状况下22.4LCO,转移电子的物质的量为_______ mol。
②NO和 按一定比例混合可以被NaOH溶液完全吸收(提示:生成
按一定比例混合可以被NaOH溶液完全吸收(提示:生成 ),写出相关化学方程式:
),写出相关化学方程式:_______ ,在此反应中,氧化剂和还原剂的物质的量之比为_______ 。

(1)图1中,X的化学式为
(2)回答下列关于
 的问题:
的问题:①实验室制取氨气的化学方程式为
②下列试剂能用于干燥
 的是
的是A.浓硫酸 B.碱石灰 C.无水氯化钙 D.五氧化二磷固体
③氨气是重要的化工原料,可以合成多种物质,写出其催化氧化的化学方程式:
(3)回答下列关于NO、
 的问题:
的问题:①汽车排气管上装有催化转化器可减少尾气对环境的污染,汽车尾气中的有害气体CO和NO反应可转化为无害气体排放,写出相关反应的化学方程式:
②NO和
 按一定比例混合可以被NaOH溶液完全吸收(提示:生成
按一定比例混合可以被NaOH溶液完全吸收(提示:生成 ),写出相关化学方程式:
),写出相关化学方程式:
您最近一年使用:0次
名校
8 . 依据下图中氮元素及其化合物的转化关系,回答问题:
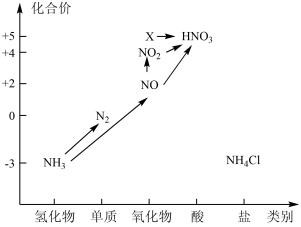
(1)上图中,X的化学式为_______ ,从化合价上看,X具有_______ (填“氧化”或“还原”)性。
(2)回答下列关于NH3的问题:
①实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为_______ 。
②下列试剂不能用于干燥NH3的是_______ (填字母)。
A.浓硫酸 B.碱石灰 C.NaOH固体
③氨气是重要的化工原料,可以合成多种物质,写出其催化氧化的化学方程式:_______ 。
(3)回答下列关于NO、NO2的问题:
①汽车排气管上装有催化转化器可减少尾气对环境的污染,汽车尾气中的有害气体CO和NO反应可转化为无害气体排放,写出相关反应的化学方程式:_______ 。
②NO和NO2按一定比例混合可以被NaOH溶液完全吸收,写出相关化学方程式:_______ 。工业生产中利用氨水吸收SO2和NO2,原理如下图所示:

NO2被吸收过程的离子方程式是_______ 。

(1)上图中,X的化学式为
(2)回答下列关于NH3的问题:
①实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为
②下列试剂不能用于干燥NH3的是
A.浓硫酸 B.碱石灰 C.NaOH固体
③氨气是重要的化工原料,可以合成多种物质,写出其催化氧化的化学方程式:
(3)回答下列关于NO、NO2的问题:
①汽车排气管上装有催化转化器可减少尾气对环境的污染,汽车尾气中的有害气体CO和NO反应可转化为无害气体排放,写出相关反应的化学方程式:
②NO和NO2按一定比例混合可以被NaOH溶液完全吸收,写出相关化学方程式:

NO2被吸收过程的离子方程式是
您最近一年使用:0次



