解题方法
1 . 铁及其化合物在生产、生活中有着重要作用。按要求回答下列问题。
(1)基态Fe原子的价层电子排布式为___________ ;铁元素在元素周期表中的位置是___________ ,属于___________ 区。
(2)铁及其化合物A~E的分类分布及其转化关系如下图所示:
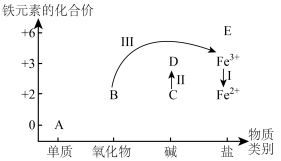
①从图中(A~E)选择反应物,实现Ⅰ的转化,写出反应Ⅰ的离子方程式:___________ 。
②预测物质E中铁元素具有___________ (填“氧化性”或“还原性”)。
③写出反应Ⅱ的化学方程式:___________ 。
④实现反应Ⅲ的转化,可选择含N元素的试剂为___________ 。
(3)探究铁盐X的组成与性质(忽略过程中氧气的参与)
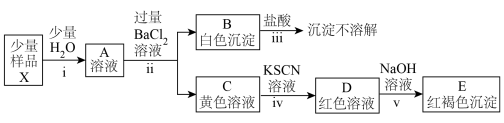
①由步骤ⅰ及其现象可推知铁盐X的物理性质:___________ 。
②由步骤ⅱ、ⅲ及其现象可推知该铁盐X中含有的阴离子为___________ 。
③C溶液呈黄色,不可能是因其体系中含有的___________ 、___________ 、___________ 、___________ (填离子符号)所致;
而可能是因其体系中含有的___________ 、___________ (填粒子的化学式)等所致。
④由步骤iv、v及其现象,体系中与 结合能力最强的离子是
结合能力最强的离子是___________ 。
(1)基态Fe原子的价层电子排布式为
(2)铁及其化合物A~E的分类分布及其转化关系如下图所示:

①从图中(A~E)选择反应物,实现Ⅰ的转化,写出反应Ⅰ的离子方程式:
②预测物质E中铁元素具有
③写出反应Ⅱ的化学方程式:
④实现反应Ⅲ的转化,可选择含N元素的试剂为
(3)探究铁盐X的组成与性质(忽略过程中氧气的参与)

①由步骤ⅰ及其现象可推知铁盐X的物理性质:
②由步骤ⅱ、ⅲ及其现象可推知该铁盐X中含有的阴离子为
③C溶液呈黄色,不可能是因其体系中含有的
而可能是因其体系中含有的
④由步骤iv、v及其现象,体系中与
 结合能力最强的离子是
结合能力最强的离子是
您最近一年使用:0次
名校
2 . Ⅰ.形式一:(由粒子数推断)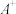 、
、 、
、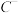 、D、E 5种粒子(分子或离子),它们分别含10个电子,已知它们有如下转化关系:①
、D、E 5种粒子(分子或离子),它们分别含10个电子,已知它们有如下转化关系:①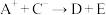 ;②
;② 。据此,回答下列问题:写出
。据此,回答下列问题:写出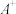 、
、 的化学式:
的化学式:____ 、______ 、
Ⅱ. 形式二:(由元素原子结构推断)A、B、C、D、E、F的原子序数依次增大,它们都是同周期的元素。已知:A、C、F 三种原子最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水;D元素原子的最外层电子数比次外层电子数少4;E元素原子次外层电子数比最外层电子数多2。
(1)写出下列元素的符号:A________ ,B________ ,E________
(2)F在元素周期表中的位置为___________________________________
(3)写出C的单质和A的最高价氧化物的水化物反应的离子方程式_______
(4)元素的非金属性为(原子的得电子能力):E________ F(填“强于”或“弱于”),请以E、F为例列举元素非金属性强弱的比较方法__________________________________________________ (至少2条)
通过Ⅱ的解题你认为推断出本题各元素的关键环节为___________
III.形式三:(由元素位置推断)下表为元素周期表的一部分:
请参照元素①-⑧在表中的位置,用化学用语 回答下列问题:
(1)请画出元素⑦的离子结构示意图________________ 。
(2)写出元素⑤在周期表中的位置______________ 。
(3)②、③、⑥的离子半径由大到小的顺序为_________________________ 。
(4)⑤、⑥、⑦的最高价氧化物对应水化物酸性由强到弱的顺序是______ 。
(5)①、②、③三种元素可形成既含离子键又含极性共价键的化合物,写出该化合物的电子式:____________________ 。该化合物与④的最高价氧化物反应的离子方程式为____________________ 。
(6)请你预测:如果发现了原子序数为116号元素,它在周期表中的位置是第________ 周期_______ 族,它属于_____ 元素(填“金属”或“非金属”)
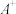 、
、 、
、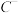 、D、E 5种粒子(分子或离子),它们分别含10个电子,已知它们有如下转化关系:①
、D、E 5种粒子(分子或离子),它们分别含10个电子,已知它们有如下转化关系:① ;②
;② 。据此,回答下列问题:写出
。据此,回答下列问题:写出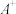 、
、 的化学式:
的化学式:Ⅱ. 形式二:(由元素原子结构推断)A、B、C、D、E、F的原子序数依次增大,它们都是同周期的元素。已知:A、C、F 三种原子最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水;D元素原子的最外层电子数比次外层电子数少4;E元素原子次外层电子数比最外层电子数多2。
(1)写出下列元素的符号:A
(2)F在元素周期表中的位置为
(3)写出C的单质和A的最高价氧化物的水化物反应的离子方程式
(4)元素的非金属性为(原子的得电子能力):E
通过Ⅱ的解题你认为推断出本题各元素的关键环节为
III.形式三:(由元素位置推断)下表为元素周期表的一部分:
族 周期 | ||||||||
| 1 | ① | |||||||
| 2 | ② | |||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
请参照元素①-⑧在表中的位置,用
(1)请画出元素⑦的离子结构示意图
(2)写出元素⑤在周期表中的位置
(3)②、③、⑥的离子半径由大到小的顺序为
(4)⑤、⑥、⑦的最高价氧化物对应水化物酸性由强到弱的顺序是
(5)①、②、③三种元素可形成既含离子键又含极性共价键的化合物,写出该化合物的电子式:
(6)请你预测:如果发现了原子序数为116号元素,它在周期表中的位置是第
您最近一年使用:0次
3 . A~I都是由短周期元素组成的常见物质,它们之间的转化关系如下图所示。已知:A为气体,其水溶液呈碱性;D、F均能与人体血液中的血红蛋白结合而使人中毒;E可作为半导体材料。

(1)化合物A的电子式为__________ 。
氧化物I中化学键类型:___________ 。
组成E单质的元素在元素周期表中的位置是________________ 。
图中物质所含元素原子的半径由大到小依次是(写元素符号)_____________ 。
(2)反应④的化学方程式为_________________________ 。
(3)将F与B按体积比2:1混合生成气体M,常温下测定M相对分子质量时,得到的实验值总是比理论值偏大,其原因是(用化学方程式表示)____________ 。
(4)某容积为V L的试管中充满F气体(标准状况下),若将该气体完全被水吸收,需通入B的物质的量为(写含V的表达式)_________ mol,此时所得溶液中再通入气体A,恰好完全反应后所得溶液中各离子浓度由大到小依次为:______________ 。

(1)化合物A的电子式为
氧化物I中化学键类型:
组成E单质的元素在元素周期表中的位置是
图中物质所含元素原子的半径由大到小依次是(写元素符号)
(2)反应④的化学方程式为
(3)将F与B按体积比2:1混合生成气体M,常温下测定M相对分子质量时,得到的实验值总是比理论值偏大,其原因是(用化学方程式表示)
(4)某容积为V L的试管中充满F气体(标准状况下),若将该气体完全被水吸收,需通入B的物质的量为(写含V的表达式)
您最近一年使用:0次
名校
4 . 现有下列短周期元素性质的有关数据:
(1)根据元素周期律确定a至h8种元素在周期表中的位置,将它们的元素编号填入下表相应的空格内_______ 。
(2)上述元素形成的常见氢化物中,分子间存在氢键的有(填氢化物的化学式)_______ 。
(3)氢化铝锂( )是一种易燃易爆具有极强还原性的物质,它在有机合成上应用广泛。在125℃时氢化铝锂分解为氢气、金属铝及氢化锂(LiH)。与氢化铝锂性质相似但较为温和的还原剂由上述a、d、h三种元素组成,请画出这种还原剂的电子式
)是一种易燃易爆具有极强还原性的物质,它在有机合成上应用广泛。在125℃时氢化铝锂分解为氢气、金属铝及氢化锂(LiH)。与氢化铝锂性质相似但较为温和的还原剂由上述a、d、h三种元素组成,请画出这种还原剂的电子式_______ 。写出该物质受热分解的反应方程式_______ 。
(4)在元素周期表中,相邻近的元素在结构和性质上有许多相似之处。第二周期的碳、氮、氧、氟都可以形成氢化物,氧元素的氢化物除 外,还有
外,还有 ;碳元素的氢化物除
;碳元素的氢化物除 外,还有
外,还有 等;与之相似的氮元素的氢化物除
等;与之相似的氮元素的氢化物除 外,还有
外,还有_______ (填化学式),其沸点比液氨_______ (填“高”或“低”),稳定性比氨_______ (填“好”或“差”),该氢化物与足量盐酸反应的化学方程式为_______ 。
| 元素编号 | a | b | c | d | e | f | g | h |
| 原子半径/nm | 0.037 | 0.071 | 0.075 | 0.082 | 0.102 | 0.143 | 0.152 | 0.186 |
| 最高化合价或最底 |  |  |  |  |  |  |  |  |
(1)根据元素周期律确定a至h8种元素在周期表中的位置,将它们的元素编号填入下表相应的空格内
| Ⅰ族 | Ⅱ族 | Ⅲ族 | Ⅳ族 | Ⅴ族 | Ⅵ族 | Ⅶ族 | Ⅷ族 | |
| 第一周期 | ||||||||
| 第二周期 | ||||||||
| 第三周期 |
(2)上述元素形成的常见氢化物中,分子间存在氢键的有(填氢化物的化学式)
(3)氢化铝锂(
 )是一种易燃易爆具有极强还原性的物质,它在有机合成上应用广泛。在125℃时氢化铝锂分解为氢气、金属铝及氢化锂(LiH)。与氢化铝锂性质相似但较为温和的还原剂由上述a、d、h三种元素组成,请画出这种还原剂的电子式
)是一种易燃易爆具有极强还原性的物质,它在有机合成上应用广泛。在125℃时氢化铝锂分解为氢气、金属铝及氢化锂(LiH)。与氢化铝锂性质相似但较为温和的还原剂由上述a、d、h三种元素组成,请画出这种还原剂的电子式(4)在元素周期表中,相邻近的元素在结构和性质上有许多相似之处。第二周期的碳、氮、氧、氟都可以形成氢化物,氧元素的氢化物除
 外,还有
外,还有 ;碳元素的氢化物除
;碳元素的氢化物除 外,还有
外,还有 等;与之相似的氮元素的氢化物除
等;与之相似的氮元素的氢化物除 外,还有
外,还有
您最近一年使用:0次
名校
5 . 1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经142年。元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题:
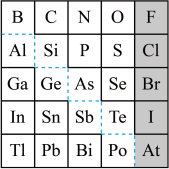
(1)元素Ga在元素周期表中的位置为:第________ 周期第________ 族。
(2)Sn的最高正价为________ ,Cl的最高价氧化物对应水化物的化学式为________ ,Bi的最高价氧化物为________ 。
(3)根据元素周期律,推断:
①阴影部分元素氢化物热稳定性最高的是________ 元素(填元素符号)。
②H3AsO4、H2SeO4的酸性强弱:H3AsO4________ (填“>”“<”或“=”)H2SeO4。
③氢化物的还原性:H2O________ (填“>”“<”或“=”)H2S。
④原子半径比较:N________ (填“>”“<”或“=”)Si。
(4)从下列试剂中选择最佳试剂组合,比较C、Si的非金属性强弱___________________ (可供选择的药品有:CaCO3固体、稀硫酸、盐酸、饱和NaHCO3溶液、饱和Na2CO3溶液、硅酸钠溶液)

(1)元素Ga在元素周期表中的位置为:第
(2)Sn的最高正价为
(3)根据元素周期律,推断:
①阴影部分元素氢化物热稳定性最高的是
②H3AsO4、H2SeO4的酸性强弱:H3AsO4
③氢化物的还原性:H2O
④原子半径比较:N
(4)从下列试剂中选择最佳试剂组合,比较C、Si的非金属性强弱
您最近一年使用:0次
2019-03-20更新
|
566次组卷
|
2卷引用:【全国百强校】天津市静海区第一中学2018-2019学年高一下学期3月月考化学试题2
名校
6 . 1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经142年。元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题:
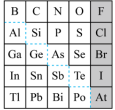
(1)元素Ga在元素周期表中的位置为:第________ 周期第________ 族。
(2)Sn的最高正价为________ ,Cl的最高价氧化物对应水化物的化学式为________ ,Bi的最高价氧化物为________ 。
(3)根据元素周期律,推断:
①阴影部分元素氢化物热稳定性最高的是________ 元素(填元素符号)。
②H3AsO4、H2SeO4的酸性强弱:H3AsO4________ (填“>”“<”或“=”)H2SeO4。
③氢化物的还原性:H2O________ (填“>”“<”或“=”)H2S。
④原子半径比较:N________ (填“>”“<”或“=”)Si。
(4)可在图中分界线(虚线部分)附近寻找________ (填序号)。
A.优良的催化剂 B.半导体材料 C.合金材料 D.农药
(5)从下列试剂中选择最佳试剂组合,比较C、Si的非金属性强弱__________________________
(可供选择的药品有:CaCO3固体、稀硫酸、盐酸、饱和NaHCO3溶液、饱和Na2CO3溶液、硅酸钠溶液.)

(1)元素Ga在元素周期表中的位置为:第
(2)Sn的最高正价为
(3)根据元素周期律,推断:
①阴影部分元素氢化物热稳定性最高的是
②H3AsO4、H2SeO4的酸性强弱:H3AsO4
③氢化物的还原性:H2O
④原子半径比较:N
(4)可在图中分界线(虚线部分)附近寻找
A.优良的催化剂 B.半导体材料 C.合金材料 D.农药
(5)从下列试剂中选择最佳试剂组合,比较C、Si的非金属性强弱
(可供选择的药品有:CaCO3固体、稀硫酸、盐酸、饱和NaHCO3溶液、饱和Na2CO3溶液、硅酸钠溶液.)
您最近一年使用:0次
7 . 下表列出8种元素在元素周期表中的位置,结合所学内容回答下列问题:
(1)写出①的元素符号_________ , 元素⑥的原子结构示意图____________________ 。
(2)写出元素⑤的最高价氧化物对应的水化物的电子式_____________ , 该化合物中含有的化学键是_____________________ 。
(3)H元素分别与②、③、④形成的最稳定的气态氢化物是______________ (写氢化物的化学式)。
(4)⑦、⑧是两种常见的非金属元素,从原子结构分析,原子半径⑦_______ ⑧(填写“>”或“<”);得电子能力较强是________ (填写元素符号);非金属性强弱关系是⑦_______ ⑧(填写“>”或“<”);⑧的单质通入⑦的钠盐溶液中,出现黄色沉淀,其离子方程式为_________________________________ 。
(5)某同学阅读课外资料,看到了下列有关锗、锡、铅三种元素的性质描述:
①锗、锡在空气中不反应,铅在空气中表面形成一层氧化铅;
②锗与盐酸不反应,锡与盐酸反应,铅与盐酸反应但生成PbCl2微溶而使反应终止;
③锗、锡、铅的+4价的氢氧化物的碱性强弱顺序是:Ge(OH)4<Sn(OH)4<Pb(OH)4。
该同学查找三种元素在周期表的位置如图所示:
请解释产生上述性质变化的原因______________________________________ 。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)写出①的元素符号
(2)写出元素⑤的最高价氧化物对应的水化物的电子式
(3)H元素分别与②、③、④形成的最稳定的气态氢化物是
(4)⑦、⑧是两种常见的非金属元素,从原子结构分析,原子半径⑦
(5)某同学阅读课外资料,看到了下列有关锗、锡、铅三种元素的性质描述:
①锗、锡在空气中不反应,铅在空气中表面形成一层氧化铅;
②锗与盐酸不反应,锡与盐酸反应,铅与盐酸反应但生成PbCl2微溶而使反应终止;
③锗、锡、铅的+4价的氢氧化物的碱性强弱顺序是:Ge(OH)4<Sn(OH)4<Pb(OH)4。
该同学查找三种元素在周期表的位置如图所示:
| Ⅳ | |
| 4 | Ge |
| 5 | Sn |
| 6 | Pb |
请解释产生上述性质变化的原因
您最近一年使用:0次
8 . I.乙烯是一种重要的化工原料。根据下列转化关系回答:
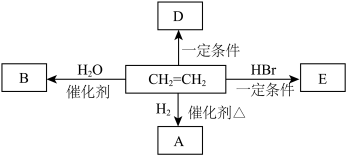
(1)乙烯分子中官能团的名称是___________ 。
(2) 的分子式是
的分子式是____________ 。
(3)乙烯转化成A的化学方程式是_________________ 。反应类型是______ 。
II.乙烯在化工生产领域应用广泛。
以原油为起始原料合成聚乙烯的路线如下图所示。
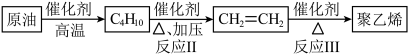
(1)反应III的化学方程式:__________ 。反应类型是________ 。
(2)写出分子式符合C4H10的所有物质的结构简式_______ 。

(1)乙烯分子中官能团的名称是
(2)
 的分子式是
的分子式是(3)乙烯转化成A的化学方程式是
II.乙烯在化工生产领域应用广泛。
以原油为起始原料合成聚乙烯的路线如下图所示。

(1)反应III的化学方程式:
(2)写出分子式符合C4H10的所有物质的结构简式
您最近一年使用:0次
名校
9 . I按要求填空,括号内为有机物的结构简式或分子式
(1)有机物甲(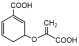 )中含氧官能团的名称是
)中含氧官能团的名称是________________
(2)有机物乙(分子式为C3H6O3)可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的乙为无色粘稠液体,易溶于水。乙的核磁共振氢谱如图 ,则乙的名称为
,则乙的名称为______________
(3)有机物丙(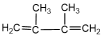 )的反式1,4-加成聚合反应产物的结构简式为
)的反式1,4-加成聚合反应产物的结构简式为______________
(4)已知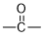 为平面结构,则有机物丁(
为平面结构,则有机物丁( )分子中最多有
)分子中最多有_____ 个原子在同一平面内
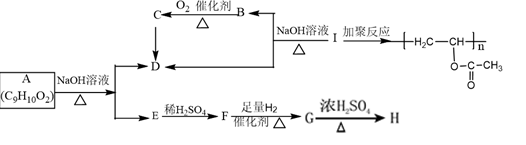
II化学式为C9H10O2的有机物有如下的转化关系:
已知:① F与FeCl3溶液能发生显色反应
②从G到H的反应中,H只有一种结构且能使溴水褪色。
③羟基与双键碳原子相连接时,不稳定,易发生转化:
请回答下列问题:
(5)写出物质D的名称_______________
(6)B→C的反应类型:_____________________________ 。G→H反应类型:__________________
(7)A生成D和E的化学方程式:_______________________ 。
(8)有机物B与银氨溶液反应的离子方程式________________________ 。
(9)写出由苯酚合成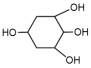 的合成路线流程图(无机试剂任选,要注明条件)
的合成路线流程图(无机试剂任选,要注明条件)_______
(1)有机物甲(
 )中含氧官能团的名称是
)中含氧官能团的名称是(2)有机物乙(分子式为C3H6O3)可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的乙为无色粘稠液体,易溶于水。乙的核磁共振氢谱如图
 ,则乙的名称为
,则乙的名称为(3)有机物丙(
 )的反式1,4-加成聚合反应产物的结构简式为
)的反式1,4-加成聚合反应产物的结构简式为(4)已知
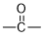 为平面结构,则有机物丁(
为平面结构,则有机物丁( )分子中最多有
)分子中最多有II化学式为C9H10O2的有机物有如下的转化关系:

已知:① F与FeCl3溶液能发生显色反应
②从G到H的反应中,H只有一种结构且能使溴水褪色。
③羟基与双键碳原子相连接时,不稳定,易发生转化:

请回答下列问题:
(5)写出物质D的名称
(6)B→C的反应类型:
(7)A生成D和E的化学方程式:
(8)有机物B与银氨溶液反应的离子方程式
(9)写出由苯酚合成
 的合成路线流程图(无机试剂任选,要注明条件)
的合成路线流程图(无机试剂任选,要注明条件)
您最近一年使用:0次
真题
10 . 图中X、Y、Z为单质,其他为化合物,它们之间存在如下转化关系(部分产物已略去)。其中,A俗称磁性氧化铁:E是不溶于水的酸性氧化物,能与氢氟酸反应。
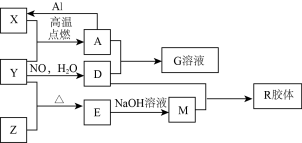
回答下列问题:
(1)组成单质Y的元素在周期表中的位置是_____________________ ;M中存在的化学键类型为_________________ ;R的化学式是_______________________ 。
(2)一定条件下,Z与H2反应生成ZH4,ZH4的电子式为________________ 。
(3)已知A与1 mol Al反应转化为X时(所有物质均为固体)。放出a kJ热量。写出该反应的热化学方程式:_______________________________________ 。
(4)写出A和D的稀溶液反应生成G的离子方程式:_______________________ 。
(5)问含4 mol D的稀溶液中,逐渐加入X3粉末至过量。假设生成的气体只有一种,请在坐标系中画出n(X2-)随n(X)变化的示意图,并标出n(X2-)的最大值_________ 。

回答下列问题:
(1)组成单质Y的元素在周期表中的位置是
(2)一定条件下,Z与H2反应生成ZH4,ZH4的电子式为
(3)已知A与1 mol Al反应转化为X时(所有物质均为固体)。放出a kJ热量。写出该反应的热化学方程式:
(4)写出A和D的稀溶液反应生成G的离子方程式:
(5)问含4 mol D的稀溶液中,逐渐加入X3粉末至过量。假设生成的气体只有一种,请在坐标系中画出n(X2-)随n(X)变化的示意图,并标出n(X2-)的最大值

您最近一年使用:0次



