已知: ①亚硝酸钠(NaNO2)是一种食品添加剂,为无色、无气味的同体,具有防腐和抗氧化作用。②AgNO2 是一种微溶于水、易溶于酸的浅黄色固体。
I.问题探究
(1)人体正常的血红蛋白中应含Fe2+,误食亚硝酸盐(如NaNO2)会致使机体组织缺氧,出现青紫而中毒,原因是___________ 。若发生中毒时,你认为下列物质有助于解毒的是____ (填字母)。
A.牛奶 B.Mg(OH)2 C.维生素C D.小苏打
(2)由于亚硝酸钠和食盐性状相似,曾多次发生过将NaNO2误当食盐食用的事件。要区别NaNO2和NaCl 两种固体,你需用的试剂是_______________ 。
II.实验测定
为了测定某样品中NaNO2的含量,某同学进行如下实验:
①称取样品ag,加水溶解,配制成100 mL 溶液。
②取25.00mL 溶液于锥形瓶中,用0.0200mol/LKMnO4标准溶液(酸性)进行滴定,滴定结束后消耗KMnO4溶液VmL。
(1)上述实验①所需玻璃仪器除玻璃棒、胶头滴管之外还有________ 。
(2)在进行滴定操作时,KMnO4溶液盛装在______ (填“酸式”或“碱式”)滴定管中。当滴入最后一滴溶液,________ 时达到滴定终点。
(3) 滴定过程中发生反应的离子方程式是________ ;测得该样品中NaNO2的质量分数为_____ 。
(4)若滴定管未用KMnO4标准溶液润洗就直接注入,则测定结果______ (填“偏大”、“偏小”或“无影响”,下同);若滴定过程中刚出现颜色变化就停止滴定,则测定结果________ 。
I.问题探究
(1)人体正常的血红蛋白中应含Fe2+,误食亚硝酸盐(如NaNO2)会致使机体组织缺氧,出现青紫而中毒,原因是
A.牛奶 B.Mg(OH)2 C.维生素C D.小苏打
(2)由于亚硝酸钠和食盐性状相似,曾多次发生过将NaNO2误当食盐食用的事件。要区别NaNO2和NaCl 两种固体,你需用的试剂是
II.实验测定
为了测定某样品中NaNO2的含量,某同学进行如下实验:
①称取样品ag,加水溶解,配制成100 mL 溶液。
②取25.00mL 溶液于锥形瓶中,用0.0200mol/LKMnO4标准溶液(酸性)进行滴定,滴定结束后消耗KMnO4溶液VmL。
(1)上述实验①所需玻璃仪器除玻璃棒、胶头滴管之外还有
(2)在进行滴定操作时,KMnO4溶液盛装在
(3) 滴定过程中发生反应的离子方程式是
(4)若滴定管未用KMnO4标准溶液润洗就直接注入,则测定结果
2018·天津和平·二模 查看更多[2]
更新时间:2018-05-10 08:10:04
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】请回答下列问题:
(1)下列溶液一定呈中性的是_______。
(2)已知T℃时,Kw=1×10-13,则T℃_______ 25℃(填“>”、“<”或“=”).在T℃时将pH=11的NaOH溶液a L与pH=1的硫酸b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=10,则a:b=_______ 。
(3)①某学生根据3次实验分别记录有关数据如下表:
依据上表数据计算该NaOH溶液的物质的量浓度_______ mol/L(保留四位有效数字)。
②若酚酞作指示剂,滴定终点现象是_______ 。
(4)下列操作中可能使所测NaOH溶液的浓度数值偏低的是_______(填字母)。
(1)下列溶液一定呈中性的是_______。
| A.pH=7的溶液 | B.c(H+)=10-7mol/L的溶液 |
| C.c(H+)/c(OH-)=10-14的溶液 | D.氨水和氯化铵的混合液中c(NH )=c(Cl-) )=c(Cl-) |
(3)①某学生根据3次实验分别记录有关数据如下表:
| 滴定次数 | 待测NaOH溶液的体积/mL | 0.1000mol/L盐酸的体积/mL | ||
| 滴定前刻度/mL | 滴定后刻度/mL | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据上表数据计算该NaOH溶液的物质的量浓度
②若酚酞作指示剂,滴定终点现象是
(4)下列操作中可能使所测NaOH溶液的浓度数值偏低的是_______(填字母)。
| A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸 |
| B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】回答下列问题:
(1)水是极弱的电解质,也是最重要的溶剂。常温下某电解质溶解在水中后,溶液中由水电离出的c(H+)=10-9 mol·L-1,则该电解质可能是_______ (填序号)。
A.CuSO4 B.Na2CO3 C.HCl D.NaOH E.K2SO4
(2)常温下,将pH=3的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性。
①c(OH-)=1.0×10-3 mol·L-1的氨水b L;
②浓度为1.0×10-3 mol·L-1的氨水c L;
③c(OH-)=1.0×10-3 mol·L-1的氢氧化钡溶液d L。
则a、b、c、d之间的关系是_______ 。
(3)已知室温时,0.1 mol·L-1的某一元酸HA在水中有0.1%发生电离,回答下列各问题:
①该溶液的pH=_______ 。
②升高温度时,K将_______ (填“增大”、“减小”或“不变”),pH将_______ (填“增大”、“减小”或“不变”)。
③由HA电离出的c(H+)约为水电离出的c(H+)的_______ 倍。
(4)某学生用0.1 mol/LKOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
(A)移取20.00 mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准KOH溶液注入碱式滴定管至0刻度以上2-3 cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
①正确操作的顺序是_______ 。(用序号字母填写)
②上述(A)操作之前,如先用待测液润洗锥形瓶,则对测定结果的影响是_______ (填“偏大”、“偏小”、“不变”)。判断到达终点的现象是_______ 。
(1)水是极弱的电解质,也是最重要的溶剂。常温下某电解质溶解在水中后,溶液中由水电离出的c(H+)=10-9 mol·L-1,则该电解质可能是
A.CuSO4 B.Na2CO3 C.HCl D.NaOH E.K2SO4
(2)常温下,将pH=3的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性。
①c(OH-)=1.0×10-3 mol·L-1的氨水b L;
②浓度为1.0×10-3 mol·L-1的氨水c L;
③c(OH-)=1.0×10-3 mol·L-1的氢氧化钡溶液d L。
则a、b、c、d之间的关系是
(3)已知室温时,0.1 mol·L-1的某一元酸HA在水中有0.1%发生电离,回答下列各问题:
①该溶液的pH=
②升高温度时,K将
③由HA电离出的c(H+)约为水电离出的c(H+)的
(4)某学生用0.1 mol/LKOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
(A)移取20.00 mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准KOH溶液注入碱式滴定管至0刻度以上2-3 cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
①正确操作的顺序是
②上述(A)操作之前,如先用待测液润洗锥形瓶,则对测定结果的影响是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】现使用酸碱中和滴定法测定市售白醋的总酸量
Ⅰ 实验步骤
实验步骤
(1)配制100mL待测白醋溶液:用______  填仪器名称
填仪器名称 量取
量取 市售白醋,在烧杯中用水稀释后转移到
市售白醋,在烧杯中用水稀释后转移到 ______  填仪器名称
填仪器名称 中定容,摇匀即得待测白醋溶液.
中定容,摇匀即得待测白醋溶液.
(2)用酸式滴定管取待测白醋溶液 于锥形瓶中,向其中滴加2滴
于锥形瓶中,向其中滴加2滴 _____ 作指示剂.
(3)读取盛装 NaOH 溶液的碱式滴定管的初始读数
NaOH 溶液的碱式滴定管的初始读数 如果液面位置如图所
如果液面位置如图所 示,则此时的读数为
示,则此时的读数为 ______ mL.
(4)滴定 当
当 ______ 时,停止滴定,并记录NaOH溶液的终读数 重复滴定3次.
重复滴定3次.
(5)实验记录
Ⅲ 数据处理与讨论
数据处理与讨论
按实验所得数据,可得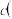 市售白醋
市售白醋
______  ;市售白醋总酸量
;市售白醋总酸量
______  .
.
(6)在本实验的滴定过程中,下列操作会使实验结果偏大的是______ (填写序号 .
.
 碱式滴定管在滴定时未用标准NaOH溶液润洗
碱式滴定管在滴定时未用标准NaOH溶液润洗
 碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
 锥形瓶中加入待测白醋溶液后,再加少量水
锥形瓶中加入待测白醋溶液后,再加少量水
 锥形瓶在滴定时剧烈摇动,有少量液体溅出.
锥形瓶在滴定时剧烈摇动,有少量液体溅出.

Ⅰ
 实验步骤
实验步骤 (1)配制100mL待测白醋溶液:用
 填仪器名称
填仪器名称 量取
量取 市售白醋,在烧杯中用水稀释后转移到
市售白醋,在烧杯中用水稀释后转移到  填仪器名称
填仪器名称 中定容,摇匀即得待测白醋溶液.
中定容,摇匀即得待测白醋溶液.(2)用酸式滴定管取待测白醋溶液
 于锥形瓶中,向其中滴加2滴
于锥形瓶中,向其中滴加2滴 (3)读取盛装
 NaOH 溶液的碱式滴定管的初始读数
NaOH 溶液的碱式滴定管的初始读数 如果液面位置如图所
如果液面位置如图所 示,则此时的读数为
示,则此时的读数为 (4)滴定
 当
当  重复滴定3次.
重复滴定3次.(5)实验记录
滴定次数实验数据 | 1 | 2 | 3 | 4 |
 样品 样品 |  |  |  |  |
 消耗 消耗 |  | 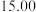 |  |  |
 数据处理与讨论
数据处理与讨论 按实验所得数据,可得
 市售白醋
市售白醋
 ;市售白醋总酸量
;市售白醋总酸量
 .
. (6)在本实验的滴定过程中,下列操作会使实验结果偏大的是
 .
. 碱式滴定管在滴定时未用标准NaOH溶液润洗
碱式滴定管在滴定时未用标准NaOH溶液润洗  碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失  锥形瓶中加入待测白醋溶液后,再加少量水
锥形瓶中加入待测白醋溶液后,再加少量水  锥形瓶在滴定时剧烈摇动,有少量液体溅出.
锥形瓶在滴定时剧烈摇动,有少量液体溅出.
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】如图是用0.1000mol·L-1的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后盛放盐酸的滴定管中液面的位置。

请回答下列问题:
(1)仪器A的名称是____ 。
(2)盐酸的体积:滴定前读数为____ mL,滴定后读数为____ mL。
(3)某实验小组同学三次实验的实验数据如表所示。根据表中数据计算出待测NaOH溶液的浓度是____ mol·L-1(保留四位有效数字)。
(4)对下列几种情况进行讨论:
①盛标准液的滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失,会使测定结果____ (填“偏高”“偏低”或“不变”,下同)。
②若锥形瓶中有少量蒸馏水,会使测定结果____ 。
③标准液读数时,若滴定前俯视,滴定后仰视,会使测定结果____ 。

请回答下列问题:
(1)仪器A的名称是
(2)盐酸的体积:滴定前读数为
(3)某实验小组同学三次实验的实验数据如表所示。根据表中数据计算出待测NaOH溶液的浓度是
| 实验编号 | 待测NaOH溶液的体积/mL | 滴定前盐酸的体积读数/mL | 滴定后盐酸的体积读数/mL |
| 1 | 20.00 | 1.20 | 23.22 |
| 2 | 20.00 | 1.21 | 29.21 |
| 3 | 20.00 | 1.50 | 23.48 |
①盛标准液的滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失,会使测定结果
②若锥形瓶中有少量蒸馏水,会使测定结果
③标准液读数时,若滴定前俯视,滴定后仰视,会使测定结果
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】中和滴定曲线的绘制
取0.100 0 mol·L-1的盐酸溶液20.00 mL,注入锥形瓶中,滴加2滴酚酞溶液,用0.100 0 mol·L-1的NaOH溶液滴定。
(1)计算滴定过程中的pH变化,填写下表空格:
(2)根据上表数据绘制滴定曲线

____________
(3)由上述滴定曲线可知,滴定终点前后,溶液的pH变化规律是:___________ 。
(4)达到终点的现象是___________ 。
取0.100 0 mol·L-1的盐酸溶液20.00 mL,注入锥形瓶中,滴加2滴酚酞溶液,用0.100 0 mol·L-1的NaOH溶液滴定。
(1)计算滴定过程中的pH变化,填写下表空格:
| V(NaOH) | 0.00 | 18.00 | 19.80 | 19.96 | 19.98 | 20.00 | 20.02 | 20.04 | 20.20 | 22.00 | 40.00 |
| pH | 2.28 | 3.30 | 10.70 | 11.70 | 12.52 |

(3)由上述滴定曲线可知,滴定终点前后,溶液的pH变化规律是:
(4)达到终点的现象是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】(1)配平氧化还原反应方程式:___ C2O42-+____ MnO4-+___ H+=______ CO2+____ Mn2++___ H2O
(2)称取6.0 g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL溶液。量取两份此溶液各25mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25mol/LNaOH溶液至20mL时,溶液由无色变为浅红色。该溶液被中和的H+的物质的量为___________ mol。
②第二份溶液中滴加0.10mol/L的酸性高锰酸钾溶液至16mL时反应完全,此时溶液颜色由________ 变为_______ 。该溶液中还原剂的物质的量为_________ mol。
(2)称取6.0 g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL溶液。量取两份此溶液各25mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25mol/LNaOH溶液至20mL时,溶液由无色变为浅红色。该溶液被中和的H+的物质的量为
②第二份溶液中滴加0.10mol/L的酸性高锰酸钾溶液至16mL时反应完全,此时溶液颜色由
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】把5.1g镁铝合金的粉末放入过量的300mL2mol/L盐酸中,得到5.6LH2(标准状况下)。试计算:该合金中铝和镁的物质的量之比___________ 。
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】某化工厂排放的工业废水中主要含 ,研究小组欲测定其中
,研究小组欲测定其中 的浓度,设计如下三个方案。
的浓度,设计如下三个方案。
方案一: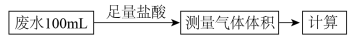
方案二:
方案三:量取 废水试样,用
废水试样,用 酸性
酸性 标准溶液进行滴定。记录数据,计算。
标准溶液进行滴定。记录数据,计算。
请回答下列问题:
(1)利用如图所示的装置完成方案一。

①仪器A的名称是_______ 。
②该方案存在较大的误差,可能的一种原因是_______ 。
(2)①方案二中吸收气体a的“X溶液”可能是_______ (填标号)。
a. 溶液b.双氧水c.硝酸钠溶液d.
溶液b.双氧水c.硝酸钠溶液d. 酸化的
酸化的 溶液
溶液
②若X为氯水,写出气体a与X溶液反应的离子方程式:_______ 。
(3)①方案三设计的下列滴定方式中,最合理的是_______ (填标号)。该方案是否需要指示剂?_______ (填“是”或“否”),原因是_______ 。

②滴定数据记录如表:
计算该废水试样中 的浓度为
的浓度为_______  。
。
 ,研究小组欲测定其中
,研究小组欲测定其中 的浓度,设计如下三个方案。
的浓度,设计如下三个方案。方案一:

方案二:

方案三:量取
 废水试样,用
废水试样,用 酸性
酸性 标准溶液进行滴定。记录数据,计算。
标准溶液进行滴定。记录数据,计算。请回答下列问题:
(1)利用如图所示的装置完成方案一。

①仪器A的名称是
②该方案存在较大的误差,可能的一种原因是
(2)①方案二中吸收气体a的“X溶液”可能是
a.
 溶液b.双氧水c.硝酸钠溶液d.
溶液b.双氧水c.硝酸钠溶液d. 酸化的
酸化的 溶液
溶液②若X为氯水,写出气体a与X溶液反应的离子方程式:
(3)①方案三设计的下列滴定方式中,最合理的是

②滴定数据记录如表:
滴定前读数/ | 滴定后读数/ | |
| 第一次 | 0.10 | 16.12 |
| 第二次 | 1.10 | 17.08 |
| 第三次 | 1.45 | 21.45 |
| 第四次 | 0.00 | 16.00 |
 的浓度为
的浓度为 。
。
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】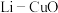 二次电池的比能量高、工作温度宽,性能优异,广泛用于军事和空间领域。
二次电池的比能量高、工作温度宽,性能优异,广泛用于军事和空间领域。
(1)质量比容量是指消耗单位质量的电池所释放的电量,用来衡量电池的优劣。比较 、
、 、
、 分别作为电极时,质量比容量由大到小的顺序为:
分别作为电极时,质量比容量由大到小的顺序为:___________ 。
通过如下过程制备 。
。

(2)过程Ⅱ产生 的离子方程式是
的离子方程式是___________ 。
(3)过程Ⅱ,将 溶液加到
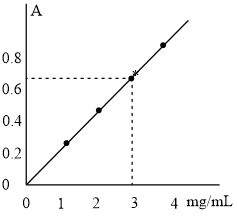
溶液加到 溶液中,研究二者不同物质的量之比与产品纯度的关系(用测定铜元素的百分含量来表征产品的纯度),结果如图1所示。
溶液中,研究二者不同物质的量之比与产品纯度的关系(用测定铜元素的百分含量来表征产品的纯度),结果如图1所示。

已知: 中铜元素的百分含量为57.7%。二者比值为
中铜元素的百分含量为57.7%。二者比值为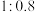 时,产品中可能含有的杂质是
时,产品中可能含有的杂质是___________ 。
(4)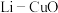 二次电池以含
二次电池以含 的有机溶液为电解质溶液,其工作原理为:
的有机溶液为电解质溶液,其工作原理为: 。装置示意图如图2所示。放电时,正极的电极反应式是
。装置示意图如图2所示。放电时,正极的电极反应式是___________ 。
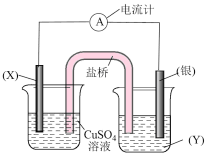
(5)依据氧化还原反应: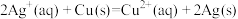 设计的原电池如图所示。电极
设计的原电池如图所示。电极 的材料是
的材料是___________ ,电解质溶液 是
是___________ ;盐桥中, 流向
流向___________ 烧杯(填“左边”、“右边”)。
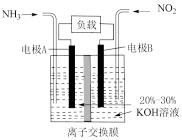
(6)利用原电池原理可将 和
和 转化为无污染物质,其装置原理图如图丙所示,则负极反应式为
转化为无污染物质,其装置原理图如图丙所示,则负极反应式为___________ 。
 二次电池的比能量高、工作温度宽,性能优异,广泛用于军事和空间领域。
二次电池的比能量高、工作温度宽,性能优异,广泛用于军事和空间领域。(1)质量比容量是指消耗单位质量的电池所释放的电量,用来衡量电池的优劣。比较
 、
、 、
、 分别作为电极时,质量比容量由大到小的顺序为:
分别作为电极时,质量比容量由大到小的顺序为:通过如下过程制备
 。
。
(2)过程Ⅱ产生
 的离子方程式是
的离子方程式是(3)过程Ⅱ,将
 溶液加到
溶液加到 溶液中,研究二者不同物质的量之比与产品纯度的关系(用测定铜元素的百分含量来表征产品的纯度),结果如图1所示。
溶液中,研究二者不同物质的量之比与产品纯度的关系(用测定铜元素的百分含量来表征产品的纯度),结果如图1所示。
已知:
 中铜元素的百分含量为57.7%。二者比值为
中铜元素的百分含量为57.7%。二者比值为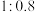 时,产品中可能含有的杂质是
时,产品中可能含有的杂质是(4)
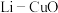 二次电池以含
二次电池以含 的有机溶液为电解质溶液,其工作原理为:
的有机溶液为电解质溶液,其工作原理为: 。装置示意图如图2所示。放电时,正极的电极反应式是
。装置示意图如图2所示。放电时,正极的电极反应式是(5)依据氧化还原反应:
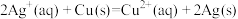 设计的原电池如图所示。电极
设计的原电池如图所示。电极 的材料是
的材料是 是
是 流向
流向

(6)利用原电池原理可将
 和
和 转化为无污染物质,其装置原理图如图丙所示,则负极反应式为
转化为无污染物质,其装置原理图如图丙所示,则负极反应式为
您最近一年使用:0次
【推荐2】我国“蛟龙号多次刷新“中国深度”,为我国深海矿物资源的开发奠定了坚实的基础。黄铜矿(主要成分为CuReS2)是海洋矿物中的一种,它是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。请回答下列问题:
(1)“蛟龙”号外壳用特殊的钛合金材料制成,它可以在7000米的深海中承受710吨的重量。下列说法正确的是___ 。
A.金属钛属于主族元素
B.钛合金强度不是很大
C.制备钛铝合金时可在空气中将两种金属熔化后混合而成
D.已知金属钛能与H2O反应,可用电解熔融二氧化钛冶炼金属钛
(2)利用黄铜矿冶炼铜的反应为8CuReS2+21O2 8Cu+4FeO+2Fe2O3+16SO2若CuReS2中Fe的化合价为+2,反应中被还原的元素是
8Cu+4FeO+2Fe2O3+16SO2若CuReS2中Fe的化合价为+2,反应中被还原的元素是___ 。(填元素符号),生成1molFe2O3时转移电子的物质的量为___ 。
(3)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3,方法为①用过量稀盐酸浸取炉渣,过滤。②先将滤液氰化,再向其中加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煆烧得Fe2O3。据以上信息回答下列问题:
a.①中过滤的目的是___ ,过滤需要的仪器有___ 。
b.除去A13+的化学方程式为___ 。
c.②中将滤液氧化常常选用H2O2,其反应的离子方程式为___ 。
(4)将Cu放入0.1mol•L-1FeCl3溶液中,反应一定时间后取出Cu片,溶液中c(Fe3+):c(Fe2+)=2:3,则Cu2+与Fe3+的物质的量之比为___ 。
(1)“蛟龙”号外壳用特殊的钛合金材料制成,它可以在7000米的深海中承受710吨的重量。下列说法正确的是
A.金属钛属于主族元素
B.钛合金强度不是很大
C.制备钛铝合金时可在空气中将两种金属熔化后混合而成
D.已知金属钛能与H2O反应,可用电解熔融二氧化钛冶炼金属钛
(2)利用黄铜矿冶炼铜的反应为8CuReS2+21O2
 8Cu+4FeO+2Fe2O3+16SO2若CuReS2中Fe的化合价为+2,反应中被还原的元素是
8Cu+4FeO+2Fe2O3+16SO2若CuReS2中Fe的化合价为+2,反应中被还原的元素是(3)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3,方法为①用过量稀盐酸浸取炉渣,过滤。②先将滤液氰化,再向其中加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煆烧得Fe2O3。据以上信息回答下列问题:
a.①中过滤的目的是
b.除去A13+的化学方程式为
c.②中将滤液氧化常常选用H2O2,其反应的离子方程式为
(4)将Cu放入0.1mol•L-1FeCl3溶液中,反应一定时间后取出Cu片,溶液中c(Fe3+):c(Fe2+)=2:3,则Cu2+与Fe3+的物质的量之比为
您最近一年使用:0次