名校
解题方法
1 . 某处工厂排出的烟道气中含氮氧化物(主要为NO、 )、粉尘和少量水蒸气.课外兴趣活动小组对该工厂排出的烟道气进行处理,并检测其氮氧化物含量,实验装置如图:
)、粉尘和少量水蒸气.课外兴趣活动小组对该工厂排出的烟道气进行处理,并检测其氮氧化物含量,实验装置如图: 混合气体按一定比例被
混合气体按一定比例被 溶液完全吸收生成
溶液完全吸收生成 和
和 ,写出该反应的化学方程式
,写出该反应的化学方程式______________ ;若反应后尾气无残留,则参加反应的 、NO物质的量比值为
、NO物质的量比值为_____ (填字母)。
a.≥1 b.≤1 c.任意值
(2)可使用适量酸性 溶液,将溶液中的
溶液,将溶液中的 全部氧化为
全部氧化为 ,发生反应的离子方程式是
,发生反应的离子方程式是_______________ 。
(3)气囊用来储存处理后气体,其中可能含少量NO气体,可用酸性 溶液来处理。
溶液来处理。 氧化NO生成
氧化NO生成 和
和 ,发生反应的离子方程式是
,发生反应的离子方程式是_______________ 。
(4)有氧条件下,NO在催化剂作用下可被 还原为
还原为 。在钒基催化剂
。在钒基催化剂 作用下的脱硝反应机理如图所示:
作用下的脱硝反应机理如图所示: 在有氧条件下的总化学方程式是
在有氧条件下的总化学方程式是___________ 。
(5)羟基自由基( )也可以用于脱硫脱硝。如图表示光催化氧化技术可生成
)也可以用于脱硫脱硝。如图表示光催化氧化技术可生成 ﹔光照时,价带失去电子产生有强氧化性的空穴,价带上
﹔光照时,价带失去电子产生有强氧化性的空穴,价带上 直接转化为
直接转化为 ;描述产生
;描述产生 的另一种过程:
的另一种过程:______________ 。 等杂质,可以采用
等杂质,可以采用 测定含量。称取
测定含量。称取 该亚硝酸钠产品溶于水配制成
该亚硝酸钠产品溶于水配制成 的样品溶液。取
的样品溶液。取 该样品溶液于锥形瓶中,用稀
该样品溶液于锥形瓶中,用稀 酸化后,再向锥形瓶中滴加
酸化后,再向锥形瓶中滴加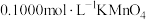 溶液,至恰好完全反应时,消耗
溶液,至恰好完全反应时,消耗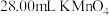 溶液。计算该产品中
溶液。计算该产品中 的质量分数
的质量分数__________ 。(写出计算过程)
 )、粉尘和少量水蒸气.课外兴趣活动小组对该工厂排出的烟道气进行处理,并检测其氮氧化物含量,实验装置如图:
)、粉尘和少量水蒸气.课外兴趣活动小组对该工厂排出的烟道气进行处理,并检测其氮氧化物含量,实验装置如图: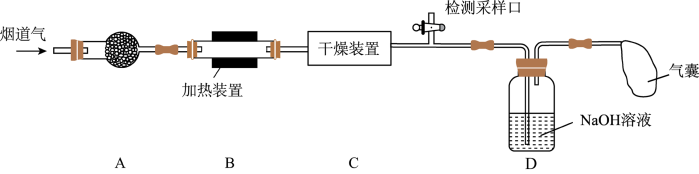
 混合气体按一定比例被
混合气体按一定比例被 溶液完全吸收生成
溶液完全吸收生成 和
和 ,写出该反应的化学方程式
,写出该反应的化学方程式 、NO物质的量比值为
、NO物质的量比值为a.≥1 b.≤1 c.任意值
(2)可使用适量酸性
 溶液,将溶液中的
溶液,将溶液中的 全部氧化为
全部氧化为 ,发生反应的离子方程式是
,发生反应的离子方程式是(3)气囊用来储存处理后气体,其中可能含少量NO气体,可用酸性
 溶液来处理。
溶液来处理。 氧化NO生成
氧化NO生成 和
和 ,发生反应的离子方程式是
,发生反应的离子方程式是(4)有氧条件下,NO在催化剂作用下可被
 还原为
还原为 。在钒基催化剂
。在钒基催化剂 作用下的脱硝反应机理如图所示:
作用下的脱硝反应机理如图所示: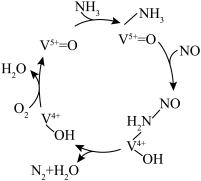
 在有氧条件下的总化学方程式是
在有氧条件下的总化学方程式是(5)羟基自由基(
 )也可以用于脱硫脱硝。如图表示光催化氧化技术可生成
)也可以用于脱硫脱硝。如图表示光催化氧化技术可生成 ﹔光照时,价带失去电子产生有强氧化性的空穴,价带上
﹔光照时,价带失去电子产生有强氧化性的空穴,价带上 直接转化为
直接转化为 ;描述产生
;描述产生 的另一种过程:
的另一种过程: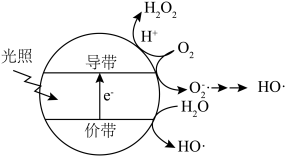
 等杂质,可以采用
等杂质,可以采用 测定含量。称取
测定含量。称取 该亚硝酸钠产品溶于水配制成
该亚硝酸钠产品溶于水配制成 的样品溶液。取
的样品溶液。取 该样品溶液于锥形瓶中,用稀
该样品溶液于锥形瓶中,用稀 酸化后,再向锥形瓶中滴加
酸化后,再向锥形瓶中滴加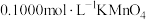 溶液,至恰好完全反应时,消耗
溶液,至恰好完全反应时,消耗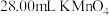 溶液。计算该产品中
溶液。计算该产品中 的质量分数
的质量分数
您最近一年使用:0次
2024-05-03更新
|
214次组卷
|
3卷引用:03 2024年苏州昆山中学高一3月月考
名校
2 . 硫化物含硫量的测定、脱硫是极具价值的重要课题。
(1)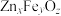 是一种复合脱硫剂,可用于脱除煤气中的
是一种复合脱硫剂,可用于脱除煤气中的 。
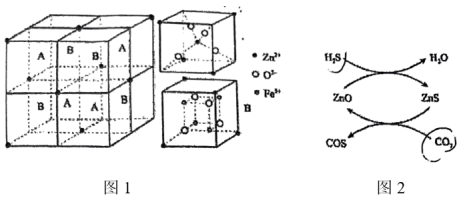
。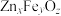 晶胞结构如图1所示(A、B交替排列,且A、B分别为晶胞的
晶胞结构如图1所示(A、B交替排列,且A、B分别为晶胞的 的结构),其化学式为
的结构),其化学式为__________ 。
②一定温度下将一定比例 和
和 的混合气体以一定流速通过装有上述脱硫剂的反应器,一段时间后,出口处检测到
的混合气体以一定流速通过装有上述脱硫剂的反应器,一段时间后,出口处检测到 。研究表明
。研究表明 参与了
参与了 与
与 生成
生成 的反应,反应机理如图2所示,反应前后
的反应,反应机理如图2所示,反应前后 的质量不变,该反应过程可描述为
的质量不变,该反应过程可描述为__________ 。
(2)稀土硫化物中硫含量的测定对其生产和质量控制具有重要意义。用如下方法对稀土硫化物中具有代表性的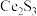 (
( 基态原子核外电子排布式为
基态原子核外电子排布式为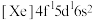 )样品硫含量进行测定。实验检测原理为
)样品硫含量进行测定。实验检测原理为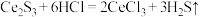
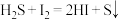

步骤1:称取0.1600g样品于反应瓶中,再准确滴加20.00mL 碘溶液;
碘溶液;
步骤2:缓慢滴加稍过量的稀盐酸(边滴加边摇动反应瓶),盖上瓶塞,剧烈摇动2min;
步骤3:滴入
 溶液至恰好完全反应,消耗
溶液至恰好完全反应,消耗 溶液20.00mL。
溶液20.00mL。
① 元素最高正化合价为
元素最高正化合价为__________ 。
②步骤1中不能使用稀硝酸的原因是__________ 。
③该样品中硫的质量分数为__________ (写出计算过程)。
(1)
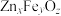 是一种复合脱硫剂,可用于脱除煤气中的
是一种复合脱硫剂,可用于脱除煤气中的 。
。
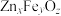 晶胞结构如图1所示(A、B交替排列,且A、B分别为晶胞的
晶胞结构如图1所示(A、B交替排列,且A、B分别为晶胞的 的结构),其化学式为
的结构),其化学式为②一定温度下将一定比例
 和
和 的混合气体以一定流速通过装有上述脱硫剂的反应器,一段时间后,出口处检测到
的混合气体以一定流速通过装有上述脱硫剂的反应器,一段时间后,出口处检测到 。研究表明
。研究表明 参与了
参与了 与
与 生成
生成 的反应,反应机理如图2所示,反应前后
的反应,反应机理如图2所示,反应前后 的质量不变,该反应过程可描述为
的质量不变,该反应过程可描述为(2)稀土硫化物中硫含量的测定对其生产和质量控制具有重要意义。用如下方法对稀土硫化物中具有代表性的
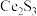 (
( 基态原子核外电子排布式为
基态原子核外电子排布式为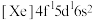 )样品硫含量进行测定。实验检测原理为
)样品硫含量进行测定。实验检测原理为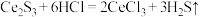
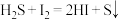

步骤1:称取0.1600g样品于反应瓶中,再准确滴加20.00mL
 碘溶液;
碘溶液;步骤2:缓慢滴加稍过量的稀盐酸(边滴加边摇动反应瓶),盖上瓶塞,剧烈摇动2min;
步骤3:滴入

 溶液至恰好完全反应,消耗
溶液至恰好完全反应,消耗 溶液20.00mL。
溶液20.00mL。①
 元素最高正化合价为
元素最高正化合价为②步骤1中不能使用稀硝酸的原因是
③该样品中硫的质量分数为
您最近一年使用:0次
解题方法
3 . 废弃物的综合利用有利于节约资源、保护环境。实验室利用废旧电池的铜帽(Cu、Zn总含量约为99%)制备 和
和 的部分实验步骤如下:
的部分实验步骤如下: ”步骤中,为加快溶解速率,可采取的措施是
”步骤中,为加快溶解速率,可采取的措施是___________ 。(任写一种方法)。
(2)从“滤液 ”中提取
”中提取 的实验步骤依次为
的实验步骤依次为___________ 、过滤、冰水洗涤、低温干燥,其中冰水洗涤晶体的目的是___________ 。
(3)在“溶解 ”步骤中,发生反应的化学方程式为
”步骤中,发生反应的化学方程式为___________ 。
(4)为测定产品中 的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000
的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000
 溶液至刚好完全反应,消耗
溶液至刚好完全反应,消耗 溶液25.00mL。
溶液25.00mL。
已知: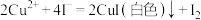 ,
, 。请依据实验数据计算样品中
。请依据实验数据计算样品中 的质量分数
的质量分数___________ (写出计算过程,结果保留2位小数)。
 和
和 的部分实验步骤如下:
的部分实验步骤如下: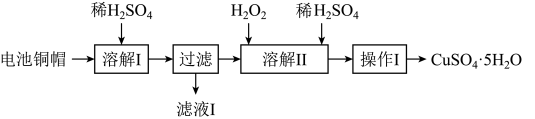
 ”步骤中,为加快溶解速率,可采取的措施是
”步骤中,为加快溶解速率,可采取的措施是(2)从“滤液
 ”中提取
”中提取 的实验步骤依次为
的实验步骤依次为(3)在“溶解
 ”步骤中,发生反应的化学方程式为
”步骤中,发生反应的化学方程式为(4)为测定产品中
 的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000
的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000
 溶液至刚好完全反应,消耗
溶液至刚好完全反应,消耗 溶液25.00mL。
溶液25.00mL。已知:
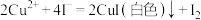 ,
, 。请依据实验数据计算样品中
。请依据实验数据计算样品中 的质量分数
的质量分数
您最近一年使用:0次
解题方法
4 . 废弃物的综合利用有利于节约资源、保护环境。实验室利用废旧电池的铜帽(Cu、Zn总含量约为99%)制备ZnSO4·7H2O和CuSO4·5H2O的部分实验步骤如下:
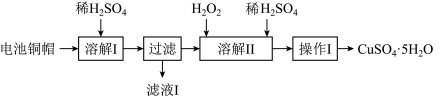
(1)在“溶解I”步骤中,为加快溶解速率,可采取的措施是_______ (任写一种方法)。
(2)从“滤液I”中提取ZnSO4·7H2O的实验步骤依次为_______ 、_______ 、过滤、冰水洗涤、低温干燥。
(3)仔细分析流程,在“溶解II”步骤中,发生反应的化学方程式为_______ (用双线桥标出电子转移的方向和数目)。
(4)为测定产品中CuSO4·5H2O的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000mol/LNa2S2O3标准溶液至滴定终点,消耗Na2S2O3溶液25.00mL。
已知:2CuSO4+4KI=2CuI(白色)+I2+2K2SO4;2Na2S2O3+I2=2NaI+Na2S4O6
请依据实验数据计算样品中CuSO4·5H2O的质量分数_______ (写出计算过程,结果用百分数表示,小数点后保留1位有效数字)。

(1)在“溶解I”步骤中,为加快溶解速率,可采取的措施是
(2)从“滤液I”中提取ZnSO4·7H2O的实验步骤依次为
(3)仔细分析流程,在“溶解II”步骤中,发生反应的化学方程式为
(4)为测定产品中CuSO4·5H2O的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000mol/LNa2S2O3标准溶液至滴定终点,消耗Na2S2O3溶液25.00mL。
已知:2CuSO4+4KI=2CuI(白色)+I2+2K2SO4;2Na2S2O3+I2=2NaI+Na2S4O6
请依据实验数据计算样品中CuSO4·5H2O的质量分数
您最近一年使用:0次
名校
解题方法
5 . 实验室利用含钴废催化剂制备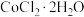 ,并利用其制备
,并利用其制备 。已知:
。已知: 完全沉淀的
完全沉淀的 为
为 ,
, 完全沉淀的
完全沉淀的 为
为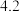 ,
, 开始沉淀的
开始沉淀的 为
为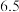 ,
, 的溶解度曲线如图-1所示。
的溶解度曲线如图-1所示。
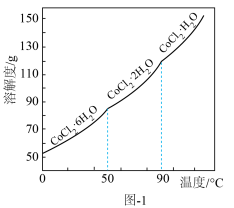
(1)制备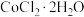 。
。
① 中
中 基态核外电子排布式为
基态核外电子排布式为___________ 。
②补充完整以含钴废催化剂(主要成分为 ,少量
,少量 和
和 )为原料制备
)为原料制备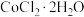 的实验方案:
的实验方案:___________ ,洗涤2~3次,低温干燥,得到产品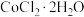 。(实验中须使用的仪器和试剂:
。(实验中须使用的仪器和试剂: 计、
计、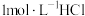 溶液、
溶液、 固体)
固体)
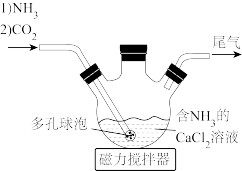
(2)制备 并测定
并测定 含量。将
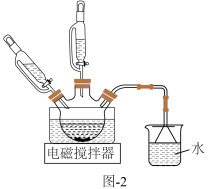
含量。将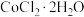 和活性炭(催化剂)加入三颈瓶中(装置见图-2),然后再依次通过滴液漏斗缓慢滴加
和活性炭(催化剂)加入三颈瓶中(装置见图-2),然后再依次通过滴液漏斗缓慢滴加 和浓氨水混合溶液、
和浓氨水混合溶液、 溶液,控制温度不超过
溶液,控制温度不超过 充分反应,冷却后过滤。
充分反应,冷却后过滤。
①三颈瓶中生成 反应的离子方程式为
反应的离子方程式为___________ 。
②加入 的作用是
的作用是___________ 。
③在没有活性炭存在时,能得到一种化学式为 的纯净物。测得
的纯净物。测得 与足量的硝酸银溶液反应生成
与足量的硝酸银溶液反应生成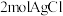 ,该配合物内界的化学式为
,该配合物内界的化学式为___________ 。
④准确称取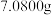 样品于烧杯中,加入足量
样品于烧杯中,加入足量 溶液充分反应,微沸加热至无
溶液充分反应,微沸加热至无 放出。冷却至室温后,加入过量的
放出。冷却至室温后,加入过量的 固体和盐酸,充分摇荡。将所得溶液定容至
固体和盐酸,充分摇荡。将所得溶液定容至 ,然后取出
,然后取出 溶液放入锥形瓶中,滴加少量淀粉溶液,用
溶液放入锥形瓶中,滴加少量淀粉溶液,用 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液的体积为
溶液的体积为 。计算样品中钴元素的质量分数。
。计算样品中钴元素的质量分数。___________ 。已知: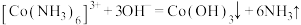 ,
,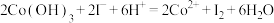 ,
, 。
。
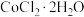 ,并利用其制备
,并利用其制备 。已知:
。已知: 完全沉淀的
完全沉淀的 为
为 ,
, 完全沉淀的
完全沉淀的 为
为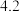 ,
, 开始沉淀的
开始沉淀的 为
为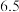 ,
, 的溶解度曲线如图-1所示。
的溶解度曲线如图-1所示。
(1)制备
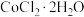 。
。①
 中
中 基态核外电子排布式为
基态核外电子排布式为②补充完整以含钴废催化剂(主要成分为
 ,少量
,少量 和
和 )为原料制备
)为原料制备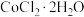 的实验方案:
的实验方案: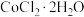 。(实验中须使用的仪器和试剂:
。(实验中须使用的仪器和试剂: 计、
计、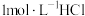 溶液、
溶液、 固体)
固体)(2)制备
 并测定
并测定 含量。将
含量。将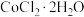 和活性炭(催化剂)加入三颈瓶中(装置见图-2),然后再依次通过滴液漏斗缓慢滴加
和活性炭(催化剂)加入三颈瓶中(装置见图-2),然后再依次通过滴液漏斗缓慢滴加 和浓氨水混合溶液、
和浓氨水混合溶液、 溶液,控制温度不超过
溶液,控制温度不超过 充分反应,冷却后过滤。
充分反应,冷却后过滤。
①三颈瓶中生成
 反应的离子方程式为
反应的离子方程式为②加入
 的作用是
的作用是③在没有活性炭存在时,能得到一种化学式为
 的纯净物。测得
的纯净物。测得 与足量的硝酸银溶液反应生成
与足量的硝酸银溶液反应生成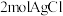 ,该配合物内界的化学式为
,该配合物内界的化学式为④准确称取
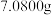 样品于烧杯中,加入足量
样品于烧杯中,加入足量 溶液充分反应,微沸加热至无
溶液充分反应,微沸加热至无 放出。冷却至室温后,加入过量的
放出。冷却至室温后,加入过量的 固体和盐酸,充分摇荡。将所得溶液定容至
固体和盐酸,充分摇荡。将所得溶液定容至 ,然后取出
,然后取出 溶液放入锥形瓶中,滴加少量淀粉溶液,用
溶液放入锥形瓶中,滴加少量淀粉溶液,用 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液的体积为
溶液的体积为 。计算样品中钴元素的质量分数。
。计算样品中钴元素的质量分数。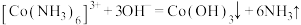 ,
,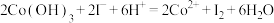 ,
, 。
。
您最近一年使用:0次
2024-01-28更新
|
796次组卷
|
3卷引用:2024届江苏省连云港市高三第一次调研考试(一模)化学试题
2024届江苏省连云港市高三第一次调研考试(一模)化学试题江苏省南菁高中、常州市第一中学2023-2024学年高二下学期3月月考化学试题(已下线)专题09 化学实验综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)
名校
解题方法
6 . 选择性催化还原法(SCR法)去除 是脱硝问题研究的热点,催化剂的选取是技术的核心。
是脱硝问题研究的热点,催化剂的选取是技术的核心。
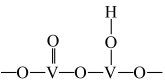
(1)以 为催化剂的催化原理:
为催化剂的催化原理: 与
与 形成能提供氢离子的酸性位(如图所示),
形成能提供氢离子的酸性位(如图所示), 吸附在酸性位上生成中间体继续与NO反应。
吸附在酸性位上生成中间体继续与NO反应。
①五价钒在pH为10~13的溶液中会以焦钒酸根( )形式存在,请写出该离子的结构式
)形式存在,请写出该离子的结构式___________ ;
②其他条件相同, 、NO以一定速率,通过一定量
、NO以一定速率,通过一定量 催化剂催化脱硝,当NO含量一定,
催化剂催化脱硝,当NO含量一定,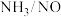 比值大于1.0后NO脱除率变化不大,其原因可能是
比值大于1.0后NO脱除率变化不大,其原因可能是___________ 。
(2)以 为催化剂的反应机理如图1所示:
为催化剂的反应机理如图1所示:

①请写出脱硝过程中总反应方程式:___________ 。
②NO脱除率随温度变化如图2所示,温度高于1000℃时NO脱除率明显下降,可能原因是:___________ 。
(3)以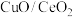 为催化剂
为催化剂
①理想 晶胞如图3所示,实际晶体中会含有部分氧空位。部分
晶胞如图3所示,实际晶体中会含有部分氧空位。部分 填充在由
填充在由 构成的
构成的___________ (填“四面体”或“八面体”)空隙中。

②Cu基催化剂对于使用CO脱去NO有着极为优异的催化性能,现探究不同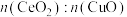 情况下脱硝、脱碳的情况。已知反应机理是CO首先吸附在
情况下脱硝、脱碳的情况。已知反应机理是CO首先吸附在 或CuO表面的活性位点上,由图像可以推断,CO反应的活性位点位于
或CuO表面的活性位点上,由图像可以推断,CO反应的活性位点位于___________ 上(填“ ”或“CuO”);
”或“CuO”);
③测定某催化剂中 质量分数,取催化剂产品0.8000g,用30mL高氯酸和20mL磷酸混合液加热溶解,冷却至室温后,用
质量分数,取催化剂产品0.8000g,用30mL高氯酸和20mL磷酸混合液加热溶解,冷却至室温后,用 硫酸亚铁铵[
硫酸亚铁铵[ ]溶液滴定,已知滴定时发生反应为
]溶液滴定,已知滴定时发生反应为 ,达到滴定终点时消耗硫酸亚铁铵溶液20.50mL,则该产品的纯度为
,达到滴定终点时消耗硫酸亚铁铵溶液20.50mL,则该产品的纯度为___________ (写出计算过程 ,计算结果保留4位有效数字)
 是脱硝问题研究的热点,催化剂的选取是技术的核心。
是脱硝问题研究的热点,催化剂的选取是技术的核心。(1)以
 为催化剂的催化原理:
为催化剂的催化原理: 与
与 形成能提供氢离子的酸性位(如图所示),
形成能提供氢离子的酸性位(如图所示), 吸附在酸性位上生成中间体继续与NO反应。
吸附在酸性位上生成中间体继续与NO反应。
①五价钒在pH为10~13的溶液中会以焦钒酸根(
 )形式存在,请写出该离子的结构式
)形式存在,请写出该离子的结构式②其他条件相同,
 、NO以一定速率,通过一定量
、NO以一定速率,通过一定量 催化剂催化脱硝,当NO含量一定,
催化剂催化脱硝,当NO含量一定,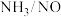 比值大于1.0后NO脱除率变化不大,其原因可能是
比值大于1.0后NO脱除率变化不大,其原因可能是(2)以
 为催化剂的反应机理如图1所示:
为催化剂的反应机理如图1所示:
①请写出脱硝过程中总反应方程式:
②NO脱除率随温度变化如图2所示,温度高于1000℃时NO脱除率明显下降,可能原因是:
(3)以
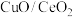 为催化剂
为催化剂①理想
 晶胞如图3所示,实际晶体中会含有部分氧空位。部分
晶胞如图3所示,实际晶体中会含有部分氧空位。部分 填充在由
填充在由 构成的
构成的
②Cu基催化剂对于使用CO脱去NO有着极为优异的催化性能,现探究不同
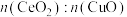 情况下脱硝、脱碳的情况。已知反应机理是CO首先吸附在
情况下脱硝、脱碳的情况。已知反应机理是CO首先吸附在 或CuO表面的活性位点上,由图像可以推断,CO反应的活性位点位于
或CuO表面的活性位点上,由图像可以推断,CO反应的活性位点位于 ”或“CuO”);
”或“CuO”);③测定某催化剂中
 质量分数,取催化剂产品0.8000g,用30mL高氯酸和20mL磷酸混合液加热溶解,冷却至室温后,用
质量分数,取催化剂产品0.8000g,用30mL高氯酸和20mL磷酸混合液加热溶解,冷却至室温后,用 硫酸亚铁铵[
硫酸亚铁铵[ ]溶液滴定,已知滴定时发生反应为
]溶液滴定,已知滴定时发生反应为 ,达到滴定终点时消耗硫酸亚铁铵溶液20.50mL,则该产品的纯度为
,达到滴定终点时消耗硫酸亚铁铵溶液20.50mL,则该产品的纯度为
您最近一年使用:0次
解题方法
7 . 碱式次氯酸镁[化学式为Mg2ClO(OH)3·H2O]是一种白色粉末,难溶于水,也是新一代无机抗菌剂。可由Cl2、NaOH及MgCl2为原料制取。
(1)甲同学拟利用如图装置制备质量分数约为5%的次氯酸钠溶液。
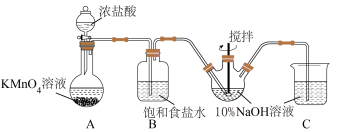
①B装置中饱和食盐水的作用为___________ 。
②Cl2和NaOH在较高的温度下反应生成NaClO3,写出该反应的离子反应方程式___________ ,因此控制反应在0~5℃范围内进行,实验中适宜的措施是___________ 。
(2)乙同学拟利用甲同学制得的NaClO溶液制取碱式次氯酸镁,步骤如下:
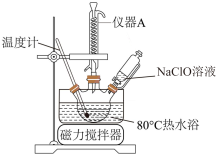
步骤1:往烧瓶中加入氯化镁,开动搅拌器并升温到80℃;
步骤2:逐滴滴入NaClO溶液;
步骤3:调节溶液pH=10,回流反应4h;
步骤4:过滤,烘干。
①上图中,冷凝水从仪器A___________ (填"上口"或“下口"”) 进入。
②过滤时,需用到的玻璃仪器除烧杯外,还需___________ 。
③写出MgCl2、NaOH、Cl2反应制取Mg2ClO(OH)3·H2O的化学方程式:___________ 。
④通过测定Mg2ClO(OH)3·H2O产品有效氯的含量来衡量产品品质。次氯酸盐的有效氯含量可用次氯酸盐与盐酸反应所生成的氯气的含量来表示,有效氯含量=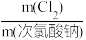 ×100%。实测值的测量方法:称取1.775g所制得的碱式次氯酸镁,放置于带塞的磨口瓶中,加入稍过量KI溶液和稀硫酸(ClO-+2I-+2H+=I2+Cl-+H2O),滴入20.00mL1mol/LNa2S2O3溶液(I2+2
×100%。实测值的测量方法:称取1.775g所制得的碱式次氯酸镁,放置于带塞的磨口瓶中,加入稍过量KI溶液和稀硫酸(ClO-+2I-+2H+=I2+Cl-+H2O),滴入20.00mL1mol/LNa2S2O3溶液(I2+2 =2I-+
=2I-+ )恰好完全反应,测得有效氯含量为
)恰好完全反应,测得有效氯含量为___________ 。(写出计算过程)
(1)甲同学拟利用如图装置制备质量分数约为5%的次氯酸钠溶液。

①B装置中饱和食盐水的作用为
②Cl2和NaOH在较高的温度下反应生成NaClO3,写出该反应的离子反应方程式
(2)乙同学拟利用甲同学制得的NaClO溶液制取碱式次氯酸镁,步骤如下:

步骤1:往烧瓶中加入氯化镁,开动搅拌器并升温到80℃;
步骤2:逐滴滴入NaClO溶液;
步骤3:调节溶液pH=10,回流反应4h;
步骤4:过滤,烘干。
①上图中,冷凝水从仪器A
②过滤时,需用到的玻璃仪器除烧杯外,还需
③写出MgCl2、NaOH、Cl2反应制取Mg2ClO(OH)3·H2O的化学方程式:
④通过测定Mg2ClO(OH)3·H2O产品有效氯的含量来衡量产品品质。次氯酸盐的有效氯含量可用次氯酸盐与盐酸反应所生成的氯气的含量来表示,有效氯含量=
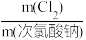 ×100%。实测值的测量方法:称取1.775g所制得的碱式次氯酸镁,放置于带塞的磨口瓶中,加入稍过量KI溶液和稀硫酸(ClO-+2I-+2H+=I2+Cl-+H2O),滴入20.00mL1mol/LNa2S2O3溶液(I2+2
×100%。实测值的测量方法:称取1.775g所制得的碱式次氯酸镁,放置于带塞的磨口瓶中,加入稍过量KI溶液和稀硫酸(ClO-+2I-+2H+=I2+Cl-+H2O),滴入20.00mL1mol/LNa2S2O3溶液(I2+2 =2I-+
=2I-+ )恰好完全反应,测得有效氯含量为
)恰好完全反应,测得有效氯含量为
您最近一年使用:0次
名校
解题方法
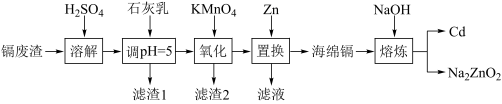
8 . 镉(Cd)可用于制作某些发光电子组件。一种以镉废渣(含CdO及少量ZnO、CuO、MnO、FeO杂质)为原料制备镉的工艺流程如图:
(1)Mn2+的基态核外电子排布式为________ 。
(2)加石灰乳调节pH=5目的是除铜,“滤渣1”的主要成分为________ (填化学式)。
(3)“氧化”时为了除铁、除锰,KMnO4的还原产物是MnO2,该步骤中除锰的离子方程式为_______ 。
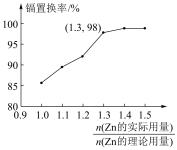
(4)“置换”中镉置换率与 的关系如图所示,其中Zn的理论用量以溶液中Cd2+的量为依据。实际生产中
的关系如图所示,其中Zn的理论用量以溶液中Cd2+的量为依据。实际生产中 比值最佳为1.3,不宜超过该比值的原因是
比值最佳为1.3,不宜超过该比值的原因是_______ 。
(5)“熔炼”时,当反应釜内无明显气泡产生时停止加热,利用Cd与Na2ZnO2的_______ 不同,将Cd从反应釜下口放出,以达到分离的目的。
(6)向“置换”所得溶液经沉淀、过滤、洗涤等系列操作后,得到碱式碳酸锌[Zn4CO3(OH)6]。用乙二胺四乙酸(俗称EDTA,H2Y2-表示乙二胺四乙酸根离子)滴定法测样品中锌的含量,反应原理:Zn2++H2Y2-=ZnY2-+2H+。取1.840g碱式碳酸锌样品,溶于pH为5~6的乙酸-乙酸钠缓冲溶液中配成100mL溶液,滴入少量的铬黑T作指示剂,取25.00mL置于锥形瓶中,向锥形瓶中加入过量的10.00mL2.000mol•L-1EDTA,振荡。用1.000mol•L-1锌离子标准溶液滴定过量的EDTA至终点,消耗锌标准溶液16.00mL。求样品中Zn元素的质量分数_______ (写出计算过程)。

(1)Mn2+的基态核外电子排布式为
(2)加石灰乳调节pH=5目的是除铜,“滤渣1”的主要成分为
(3)“氧化”时为了除铁、除锰,KMnO4的还原产物是MnO2,该步骤中除锰的离子方程式为
(4)“置换”中镉置换率与
 的关系如图所示,其中Zn的理论用量以溶液中Cd2+的量为依据。实际生产中
的关系如图所示,其中Zn的理论用量以溶液中Cd2+的量为依据。实际生产中 比值最佳为1.3,不宜超过该比值的原因是
比值最佳为1.3,不宜超过该比值的原因是
(5)“熔炼”时,当反应釜内无明显气泡产生时停止加热,利用Cd与Na2ZnO2的
(6)向“置换”所得溶液经沉淀、过滤、洗涤等系列操作后,得到碱式碳酸锌[Zn4CO3(OH)6]。用乙二胺四乙酸(俗称EDTA,H2Y2-表示乙二胺四乙酸根离子)滴定法测样品中锌的含量,反应原理:Zn2++H2Y2-=ZnY2-+2H+。取1.840g碱式碳酸锌样品,溶于pH为5~6的乙酸-乙酸钠缓冲溶液中配成100mL溶液,滴入少量的铬黑T作指示剂,取25.00mL置于锥形瓶中,向锥形瓶中加入过量的10.00mL2.000mol•L-1EDTA,振荡。用1.000mol•L-1锌离子标准溶液滴定过量的EDTA至终点,消耗锌标准溶液16.00mL。求样品中Zn元素的质量分数
您最近一年使用:0次
名校
9 .  (三草酸合铁酸钾)为亮绿色晶体,可用于工艺设计和生产科研中晒制蓝图。回答下列问题:
(三草酸合铁酸钾)为亮绿色晶体,可用于工艺设计和生产科研中晒制蓝图。回答下列问题:
(1)探究三草酸合铁酸钾的热分解产物。
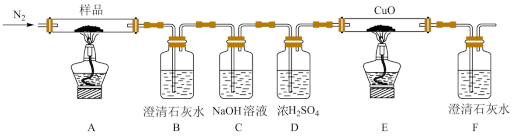
按如上图所示装置进行实验:观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色。
①装置C的作用是_______ 。
②装置E中发生反应的化学方程式为_______ 。
(2)测定三草酸合铁酸钾中铁的含量。
测定原理:

①配制溶液:实验中配制100 mL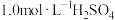 溶液,需要的仪器有烧杯、玻璃棒、量筒、
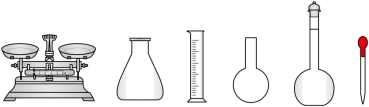
溶液,需要的仪器有烧杯、玻璃棒、量筒、_______ (从下图中选择,写出名称)。
②测定:称量10.00g晶体样品,加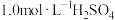 溶解后配成100mL溶液。
溶解后配成100mL溶液。
步骤Ⅰ:取20.00mL配制好的溶液于锥形瓶中,滴加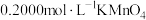 ,溶液至恰好完全反应。
,溶液至恰好完全反应。
步骤Ⅱ:向上述溶液中加入过量铜粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中,加稀 酸化,用
酸化,用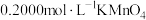 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液20.00mL。
溶液20.00mL。
该晶体样品中铁的质量分数为_______ (写出计算过程)。
 (三草酸合铁酸钾)为亮绿色晶体,可用于工艺设计和生产科研中晒制蓝图。回答下列问题:
(三草酸合铁酸钾)为亮绿色晶体,可用于工艺设计和生产科研中晒制蓝图。回答下列问题:(1)探究三草酸合铁酸钾的热分解产物。

按如上图所示装置进行实验:观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色。
①装置C的作用是
②装置E中发生反应的化学方程式为
(2)测定三草酸合铁酸钾中铁的含量。
测定原理:


①配制溶液:实验中配制100 mL
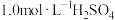 溶液,需要的仪器有烧杯、玻璃棒、量筒、
溶液,需要的仪器有烧杯、玻璃棒、量筒、
②测定:称量10.00g晶体样品,加
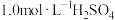 溶解后配成100mL溶液。
溶解后配成100mL溶液。步骤Ⅰ:取20.00mL配制好的溶液于锥形瓶中,滴加
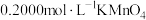 ,溶液至恰好完全反应。
,溶液至恰好完全反应。步骤Ⅱ:向上述溶液中加入过量铜粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中,加稀
 酸化,用
酸化,用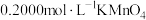 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液20.00mL。
溶液20.00mL。该晶体样品中铁的质量分数为
您最近一年使用:0次
名校
解题方法
10 . 轻质碳酸钙可用作橡胶的填料。以磷石膏(含 和少量
和少量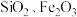 等)为原料制备轻质碳酸钙和铝铵矾的实验流程如图:
等)为原料制备轻质碳酸钙和铝铵矾的实验流程如图:
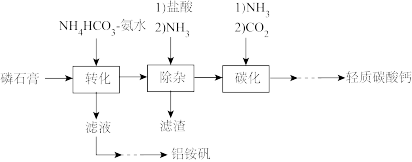
(1)检查图中所示装置气密性的操作为:用止水夹关闭左侧导管,_________ 。
(2)“转化”步骤中 转化为
转化为 的化学方程式
的化学方程式_________ 。
(3)“除杂”时通入NH3的目的是_________ 。
(4)通过下列方法测定产品中碳酸钙的含量:准确称取0.5000g产品用盐酸充分溶解,过滤,将滤液和洗涤液转移至250mL容量瓶中定容、摇匀,记为试液A。取25.00mL试液 ,加入指示剂,调节pH>12,用0.02000mol/LNa2H2Y标准溶液滴定
,加入指示剂,调节pH>12,用0.02000mol/LNa2H2Y标准溶液滴定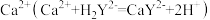 ,至终点时消耗Na2H2Y溶液24.60mL。计算产品中碳酸钙的质量分数
,至终点时消耗Na2H2Y溶液24.60mL。计算产品中碳酸钙的质量分数_________ 。(写出计算过程)。
(5)铝铵矾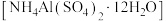 是一种水絮凝剂。请补充由“转化”后的滤液制取铝铵矾的实验方案:
是一种水絮凝剂。请补充由“转化”后的滤液制取铝铵矾的实验方案:
①_________ ,将所得溶液蒸发浓缩至有大量晶体析出,过滤,用无水乙醇洗涤、干燥,得 固体;②
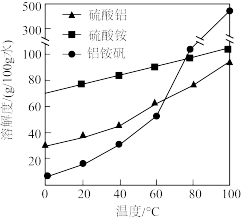
固体;②_________ ,用无水乙醇洗涤,干燥,得到铝铵矾。(部分物质的溶解度随温度的变化如图所示,实验须用的试剂: 的
的 溶液、
溶液、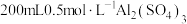 溶液)
溶液)
 和少量
和少量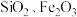 等)为原料制备轻质碳酸钙和铝铵矾的实验流程如图:
等)为原料制备轻质碳酸钙和铝铵矾的实验流程如图:
(1)检查图中所示装置气密性的操作为:用止水夹关闭左侧导管,

(2)“转化”步骤中
 转化为
转化为 的化学方程式
的化学方程式(3)“除杂”时通入NH3的目的是
(4)通过下列方法测定产品中碳酸钙的含量:准确称取0.5000g产品用盐酸充分溶解,过滤,将滤液和洗涤液转移至250mL容量瓶中定容、摇匀,记为试液A。取25.00mL试液
 ,加入指示剂,调节pH>12,用0.02000mol/LNa2H2Y标准溶液滴定
,加入指示剂,调节pH>12,用0.02000mol/LNa2H2Y标准溶液滴定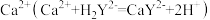 ,至终点时消耗Na2H2Y溶液24.60mL。计算产品中碳酸钙的质量分数
,至终点时消耗Na2H2Y溶液24.60mL。计算产品中碳酸钙的质量分数(5)铝铵矾
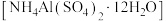 是一种水絮凝剂。请补充由“转化”后的滤液制取铝铵矾的实验方案:
是一种水絮凝剂。请补充由“转化”后的滤液制取铝铵矾的实验方案:①
 固体;②
固体;② 的
的 溶液、
溶液、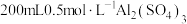 溶液)
溶液)
您最近一年使用:0次



