1 .  和
和 是重要的工业原料。
是重要的工业原料。
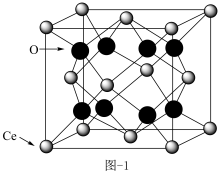
(1) 晶胞见图-1,其中O原子位于Ce构成的
晶胞见图-1,其中O原子位于Ce构成的________ 空隙。(填“正四面体”或“正八面体”)
(2)铜-氧化物( ,其中O均为-2价)可催化氧化除去氢气中少量CO,其反应机理见图-2所示。
,其中O均为-2价)可催化氧化除去氢气中少量CO,其反应机理见图-2所示。
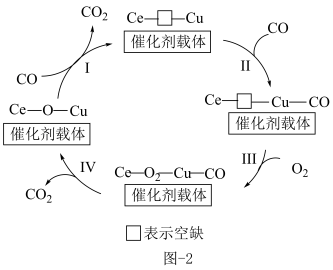
①反应Ⅰ中Ce的化合价变化为:________ 。(已知反应Ⅰ中Cu、Ce的化合价均发生变化)
②若反应Ⅱ中通入 ,检测反应Ⅳ的产物,其中含有
,检测反应Ⅳ的产物,其中含有 有
有________ 种。
(3)用pH约为7的 溶液与
溶液与 溶液反应制备
溶液反应制备 沉淀。若制备
沉淀。若制备 含量少的
含量少的 ,采用的加料方式为:将
,采用的加料方式为:将________ 溶液缓慢滴加到________ 溶液中。(填化学式)
(4)准确称取1.00g 样品置于锥形瓶中,加入适量过二硫酸铵[
样品置于锥形瓶中,加入适量过二硫酸铵[ ]溶液恰好将
]溶液恰好将 氧化为
氧化为 ,然后加入40.00mL
,然后加入40.00mL 与之恰好反应完全。已知:
与之恰好反应完全。已知: 。求该样品中
。求该样品中 的质量分数
的质量分数_____ (写出计算过程)。
 和
和 是重要的工业原料。
是重要的工业原料。(1)
 晶胞见图-1,其中O原子位于Ce构成的
晶胞见图-1,其中O原子位于Ce构成的
(2)铜-氧化物(
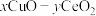 ,其中O均为-2价)可催化氧化除去氢气中少量CO,其反应机理见图-2所示。
,其中O均为-2价)可催化氧化除去氢气中少量CO,其反应机理见图-2所示。
①反应Ⅰ中Ce的化合价变化为:
②若反应Ⅱ中通入
 ,检测反应Ⅳ的产物,其中含有
,检测反应Ⅳ的产物,其中含有 有
有(3)用pH约为7的
 溶液与
溶液与 溶液反应制备
溶液反应制备 沉淀。若制备
沉淀。若制备 含量少的
含量少的 ,采用的加料方式为:将
,采用的加料方式为:将(4)准确称取1.00g
 样品置于锥形瓶中,加入适量过二硫酸铵[
样品置于锥形瓶中,加入适量过二硫酸铵[ ]溶液恰好将
]溶液恰好将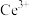 氧化为
氧化为 ,然后加入40.00mL
,然后加入40.00mL 与之恰好反应完全。已知:
与之恰好反应完全。已知: 。求该样品中
。求该样品中 的质量分数
的质量分数
您最近一年使用:0次
解题方法
2 . 某兴趣小组利用废旧电池的铜帽(铜锌总含量约99%)制备了CuSO4·5H2O样品,制备流程如下:
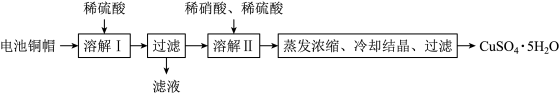
(1)“滤液”中主要含有的阳离子是___________ 。
(2)“溶解II”过程中,发生反应的离子方程式为___________ 。
(3)“溶解II”过程中应控制反应温度不能过高的原因是___________ 。
(4)为测定所得CuSO4·5H2O样品的纯度,兴趣小组进行了如下实验:称取2.570g样品,配制成250mL溶液,取25.00mL溶液于锥形瓶中,加入过量KI并充分振荡后,滴加几滴淀粉溶液,再滴入0.0400mol·L-1的Na2S2O3溶液至刚好完全反应,恰好完全反应时消耗Na2S2O3溶液的体积为25.00mL。实验过程中发生的反应如下: 2Cu2++4I-=CuI↓+I2; 2 +I2=
+I2= +2I-。
+2I-。
①配制250mL溶液所需的玻璃仪器除烧杯、玻璃棒外还有___________ 。
②计算出样品中CuSO4·5H2O的质量分数___________ 。(写出计算过程,保留三位有效数字)

(1)“滤液”中主要含有的阳离子是
(2)“溶解II”过程中,发生反应的离子方程式为
(3)“溶解II”过程中应控制反应温度不能过高的原因是
(4)为测定所得CuSO4·5H2O样品的纯度,兴趣小组进行了如下实验:称取2.570g样品,配制成250mL溶液,取25.00mL溶液于锥形瓶中,加入过量KI并充分振荡后,滴加几滴淀粉溶液,再滴入0.0400mol·L-1的Na2S2O3溶液至刚好完全反应,恰好完全反应时消耗Na2S2O3溶液的体积为25.00mL。实验过程中发生的反应如下: 2Cu2++4I-=CuI↓+I2; 2
 +I2=
+I2= +2I-。
+2I-。①配制250mL溶液所需的玻璃仪器除烧杯、玻璃棒外还有
②计算出样品中CuSO4·5H2O的质量分数
您最近一年使用:0次
解题方法
3 . 利用工业废铁屑制取绿矾(流程如图所示)。
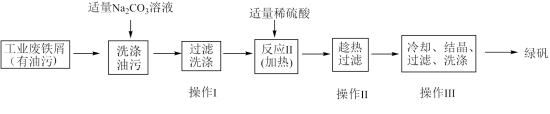
(1)可通过检验 判断操作Ⅰ是否洗涤干净,检验方法是
判断操作Ⅰ是否洗涤干净,检验方法是___________ (写出实验操作、现象及结论)。
(2)测定绿矾产品中 的含量:
的含量:
a.称取3.72g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测液于锥形瓶中;
c.将用硫酸酸化的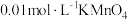 溶液滴入锥形瓶中进行反应,恰好完全反应时消耗
溶液滴入锥形瓶中进行反应,恰好完全反应时消耗 溶液的体积为20mL。
溶液的体积为20mL。
①操作c中发生反应的离子方程式为___________ 。
②样品中 的质量分数为
的质量分数为___________ (结果精确到0.01%)。

(1)可通过检验
 判断操作Ⅰ是否洗涤干净,检验方法是
判断操作Ⅰ是否洗涤干净,检验方法是(2)测定绿矾产品中
 的含量:
的含量:a.称取3.72g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测液于锥形瓶中;
c.将用硫酸酸化的
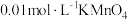 溶液滴入锥形瓶中进行反应,恰好完全反应时消耗
溶液滴入锥形瓶中进行反应,恰好完全反应时消耗 溶液的体积为20mL。
溶液的体积为20mL。①操作c中发生反应的离子方程式为
②样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
名校
4 . 金(Au)广泛应用于电子信息产业,一种从被FeS2包裹的含金矿物中提金的工艺流程如下:

(1)①“预处理”时,FeS2被氧化为Fe2(SO4)3,写出该反应的离子方程式_______ 。
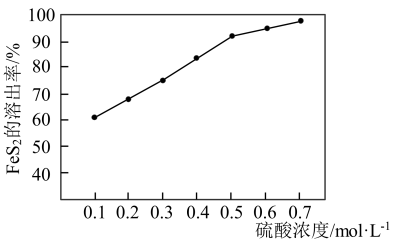
②研究发现H2O2在Fe2+的催化作用下产生具有强氧化能力的中间体∙OH,∙OH将金表面的FeS2氧化溶出。FeS2溶出率与硫酸初始浓度的关系如图所示,随着硫酸初始浓度的增大,FeS2溶出率逐渐提高的主要原因是_______ 。
(2)①“浸取”时Au转化为配合物NH4[Au(SCN)4],该配合物中的配体为_______ 。
②“浸取”时可使用硫脲[SC(NH2)2]代替NH4SCN,硫脲可通过下列反应制备:

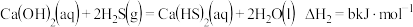

_______ 。
(3)“置换”时需维持无氧环境,其主要原因是_______ 。
(4)测定样品中Au的含量:准确称取0.1000g试样,加入王水,将Au转化成具有强氧化性的氯金酸(HAuCl4),在除去硝酸根后的溶液中,边不断搅拌,边向溶液中加入过量0.4000 mol·L-1FeSO4溶液30.00mL,将HAuCl4完全还原为Au;滴加二苯胺磺酸钠作指示剂,用0.1000 mol·L-1K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液18.00mL。
已知: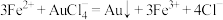

计算样品中金的质量分数(写出计算过程)_______ 。

(1)①“预处理”时,FeS2被氧化为Fe2(SO4)3,写出该反应的离子方程式
②研究发现H2O2在Fe2+的催化作用下产生具有强氧化能力的中间体∙OH,∙OH将金表面的FeS2氧化溶出。FeS2溶出率与硫酸初始浓度的关系如图所示,随着硫酸初始浓度的增大,FeS2溶出率逐渐提高的主要原因是

(2)①“浸取”时Au转化为配合物NH4[Au(SCN)4],该配合物中的配体为
②“浸取”时可使用硫脲[SC(NH2)2]代替NH4SCN,硫脲可通过下列反应制备:

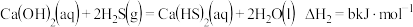

(3)“置换”时需维持无氧环境,其主要原因是
(4)测定样品中Au的含量:准确称取0.1000g试样,加入王水,将Au转化成具有强氧化性的氯金酸(HAuCl4),在除去硝酸根后的溶液中,边不断搅拌,边向溶液中加入过量0.4000 mol·L-1FeSO4溶液30.00mL,将HAuCl4完全还原为Au;滴加二苯胺磺酸钠作指示剂,用0.1000 mol·L-1K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液18.00mL。
已知:
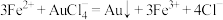

计算样品中金的质量分数(写出计算过程)
您最近一年使用:0次
2022-10-24更新
|
296次组卷
|
2卷引用:江苏省宿迁市泗阳县实验高级中学2022-2023学年高三上学期第一次质量调研化学试题
5 . 铁黑(Fe3O4)是常见的铁系颜料.一种制取铁黑的实验流程如下图所示:
制取铁黑的反应原理可表示为Fe(OH)2+2Fe(OH)3 Fe(OH)2·2Fe(OH)3
Fe(OH)2·2Fe(OH)3 Fe3O4
Fe3O4
(1)加入氨水调pH至7~9时,发生反应的离子方程式为_______________ 。
(2)为了保证铁黑样品的质量,“合成”中需要控制的因素有______________ (填三个)。
(3)铁黑产品中Fe3O4的含量是判断产品等级的依据之一。某铁黑样品中混有的杂质为FeO、Fe2O3中的一种。根据国标方法,进行的测定实验如下:
步骤1:称取1.908g样品置于锥形瓶中,加入足量盐酸,加热使之完全溶解。
步骤2:向锥形瓶中先加入足量的SnCl2溶液,将Fe3+全部转化为Fe2+,除去过量的Sn2+,再加入一定量的硫酸和磷酸,并滴加指示剂。
步骤3:再向锥形瓶中滴加0.08200mol·L-1K2Cr2O7溶液,发生反应:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
恰好完全反应时,共消耗50.00mL K2Cr2O7溶液。请计算样品中Fe3O4的质量分数_____________ (写出计算过程)。
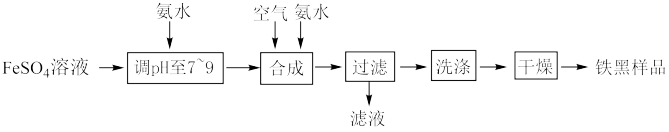
制取铁黑的反应原理可表示为Fe(OH)2+2Fe(OH)3
 Fe(OH)2·2Fe(OH)3
Fe(OH)2·2Fe(OH)3 Fe3O4
Fe3O4(1)加入氨水调pH至7~9时,发生反应的离子方程式为
(2)为了保证铁黑样品的质量,“合成”中需要控制的因素有
(3)铁黑产品中Fe3O4的含量是判断产品等级的依据之一。某铁黑样品中混有的杂质为FeO、Fe2O3中的一种。根据国标方法,进行的测定实验如下:
步骤1:称取1.908g样品置于锥形瓶中,加入足量盐酸,加热使之完全溶解。
步骤2:向锥形瓶中先加入足量的SnCl2溶液,将Fe3+全部转化为Fe2+,除去过量的Sn2+,再加入一定量的硫酸和磷酸,并滴加指示剂。
步骤3:再向锥形瓶中滴加0.08200mol·L-1K2Cr2O7溶液,发生反应:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
恰好完全反应时,共消耗50.00mL K2Cr2O7溶液。请计算样品中Fe3O4的质量分数
您最近一年使用:0次
2017-03-30更新
|
242次组卷
|
2卷引用:江苏省宿迁市沭阳县正德中学2021-2022学年高二上学期9月月考化学试题
12-13高三上·江苏南通·阶段练习
6 . 绿矾( FeSO4·7H2O )、硫酸铵以相等物质的量混合可制得摩尔盐晶体,反应原理为: (NH4)2 SO4 + FeSO4 + 6H2O =(NH4)2SO4·FeSO4·6H2O↓。其流程可表示为:
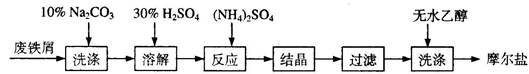
(1)洗涤中Na2CO3的主要作用是____________________________ 。
(2)结晶过程中要加热蒸发溶剂,浓缩结晶。应加热到__________ 时,停止加热
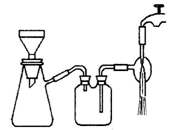
(3)过滤是用下图所示装置进行的,这种过滤跟普通过滤相比,除了过滤速度快外,还有一个优点是_________________ 。
(4)用无水乙醇洗涤的目的是____________________ 。
(5)产品中Fe2+的定量分析:制得的摩尔盐样品中往往含有极少量的Fe3+。为了测定摩尔盐产品中Fe2+的含量,一般采用在酸性条件下KMnO4标准液滴定的方法。称取4.0g的摩尔盐样品,溶于水,并加入适量稀硫酸。用0.2 mol/LKMnO4溶液滴定,当溶液中Fe2+全部被氧化时,消耗KMnO4溶液10.00mL。
①本实验的指示剂是_______ 。(填字母)
酚酞 B.甲基橙C.石蕊D.不需要
②产品中Fe2+的质量分数为_____ 。

(1)洗涤中Na2CO3的主要作用是
(2)结晶过程中要加热蒸发溶剂,浓缩结晶。应加热到
(3)过滤是用下图所示装置进行的,这种过滤跟普通过滤相比,除了过滤速度快外,还有一个优点是

(4)用无水乙醇洗涤的目的是
(5)产品中Fe2+的定量分析:制得的摩尔盐样品中往往含有极少量的Fe3+。为了测定摩尔盐产品中Fe2+的含量,一般采用在酸性条件下KMnO4标准液滴定的方法。称取4.0g的摩尔盐样品,溶于水,并加入适量稀硫酸。用0.2 mol/LKMnO4溶液滴定,当溶液中Fe2+全部被氧化时,消耗KMnO4溶液10.00mL。
①本实验的指示剂是
酚酞 B.甲基橙C.石蕊D.不需要
②产品中Fe2+的质量分数为
您最近一年使用:0次
2016-12-09更新
|
642次组卷
|
5卷引用:2016届江苏省沭阳县如东中学高三上学期阶段考试化学试卷
2016届江苏省沭阳县如东中学高三上学期阶段考试化学试卷(已下线)2012届江苏省启东中学高三上学期第二次月考化学试卷2016届河北省邯郸市大名县第一中学高三上学期10月月考化学试卷2016届江苏省清江中学高三下冲刺模拟三化学试卷【全国百强校】河北省武邑中学2019届高三上学期期中考试化学试题
名校
解题方法
7 . 锰元素能形成 、
、 、
、 、
、 等多种氧化物,其中大颗粒
等多种氧化物,其中大颗粒 是重要的电池材料。工业上以碳酸锰矿(主要成分为
是重要的电池材料。工业上以碳酸锰矿(主要成分为 、
、 ,常温下二者皆为难溶于水的固体)和软锰矿(主要成分为
,常温下二者皆为难溶于水的固体)和软锰矿(主要成分为 )为原料制取
)为原料制取 。其工艺主要包括“酸浸”“沉锰”“打浆”“氧化”。
。其工艺主要包括“酸浸”“沉锰”“打浆”“氧化”。
已知:硫化氢 是一种易燃、具有臭鸡蛋气味的有毒气体,有较强的还原性,溶于水得到氢硫酸溶液,是一种比碳酸还弱的酸。
是一种易燃、具有臭鸡蛋气味的有毒气体,有较强的还原性,溶于水得到氢硫酸溶液,是一种比碳酸还弱的酸。 溶液滴入
溶液滴入 溶液中,发生反应的离子方程式为
溶液中,发生反应的离子方程式为___________ 。
(2)从安全及环保的角度来看“酸浸”过程中,向硫酸溶液中,加料方式为___________ (填标号)。
A.先加软锰矿,再加碳酸锰矿 B.先加碳酸锰矿,再加软锰矿
过滤得到的“酸浸渣”中含有单质S,写出生成单质S的离子方程式:___________ 。
(3)“打浆”:将所得 制成悬浊液,可加快“氧化”反应速率的原因是
制成悬浊液,可加快“氧化”反应速率的原因是___________ 。
(4)“氧化”: 置于空气中在60℃条件下加热即可得到
置于空气中在60℃条件下加热即可得到 ,该反应的化学方程为
,该反应的化学方程为___________ 。
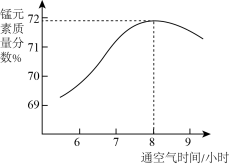
(5)“氧化”所得固体产物中锰元素质量分数随通空气时间的变化如图所示。___________ 。
 、
、 、
、 、
、 等多种氧化物,其中大颗粒
等多种氧化物,其中大颗粒 是重要的电池材料。工业上以碳酸锰矿(主要成分为
是重要的电池材料。工业上以碳酸锰矿(主要成分为 、
、 ,常温下二者皆为难溶于水的固体)和软锰矿(主要成分为
,常温下二者皆为难溶于水的固体)和软锰矿(主要成分为 )为原料制取
)为原料制取 。其工艺主要包括“酸浸”“沉锰”“打浆”“氧化”。
。其工艺主要包括“酸浸”“沉锰”“打浆”“氧化”。已知:硫化氢
 是一种易燃、具有臭鸡蛋气味的有毒气体,有较强的还原性,溶于水得到氢硫酸溶液,是一种比碳酸还弱的酸。
是一种易燃、具有臭鸡蛋气味的有毒气体,有较强的还原性,溶于水得到氢硫酸溶液,是一种比碳酸还弱的酸。
 溶液滴入
溶液滴入 溶液中,发生反应的离子方程式为
溶液中,发生反应的离子方程式为(2)从安全及环保的角度来看“酸浸”过程中,向硫酸溶液中,加料方式为
A.先加软锰矿,再加碳酸锰矿 B.先加碳酸锰矿,再加软锰矿
过滤得到的“酸浸渣”中含有单质S,写出生成单质S的离子方程式:
(3)“打浆”:将所得
 制成悬浊液,可加快“氧化”反应速率的原因是
制成悬浊液,可加快“氧化”反应速率的原因是(4)“氧化”:
 置于空气中在60℃条件下加热即可得到
置于空气中在60℃条件下加热即可得到 ,该反应的化学方程为
,该反应的化学方程为(5)“氧化”所得固体产物中锰元素质量分数随通空气时间的变化如图所示。
您最近一年使用:0次
2023-12-13更新
|
242次组卷
|
3卷引用:江苏省泗阳县实验高级中学2023-2024学年高一上学期第二次调研测试化学试卷
解题方法
8 . 完成下列填空:
(1)某市售的浓氨水, 的质量分数为
的质量分数为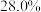 ,密度为
,密度为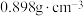 ,则该氨水的物质的量浓度为
,则该氨水的物质的量浓度为___________ 。
(2)已知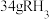 气体中含有
气体中含有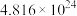 个原子,则该气体的摩尔质量为
个原子,则该气体的摩尔质量为___________ 。
(3)质量为___________  的
的 所含的电子的物质的量为
所含的电子的物质的量为 。
。
(4)质量比为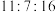 的
的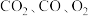 ,其物质的量之比为
,其物质的量之比为___________ 。
(5)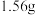 某金属与足量盐酸完全反应,生成
某金属与足量盐酸完全反应,生成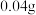 氢气,生成氯化物中金属显
氢气,生成氯化物中金属显 价,则该金属的摩尔质量为
价,则该金属的摩尔质量为___________ 。(写出计算过程)
(1)某市售的浓氨水,
 的质量分数为
的质量分数为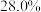 ,密度为
,密度为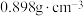 ,则该氨水的物质的量浓度为
,则该氨水的物质的量浓度为(2)已知
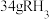 气体中含有
气体中含有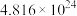 个原子,则该气体的摩尔质量为
个原子,则该气体的摩尔质量为(3)质量为
 的
的 所含的电子的物质的量为
所含的电子的物质的量为 。
。(4)质量比为
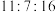 的
的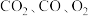 ,其物质的量之比为
,其物质的量之比为(5)
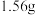 某金属与足量盐酸完全反应,生成
某金属与足量盐酸完全反应,生成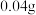 氢气,生成氯化物中金属显
氢气,生成氯化物中金属显 价,则该金属的摩尔质量为
价,则该金属的摩尔质量为
您最近一年使用:0次
名校
9 . 化学实验室里有一瓶盐酸,上面的标签如图所示。下列说法正确的是
| 产品名称:盐酸 化学式:HCl 产品等级:分析纯 质量分数:36.5% 密度:1.2 g⋅cm  |
| A.该试剂瓶中的盐酸属于纯净物 |
B.配制100 mL 1.00 mol⋅L 的稀盐酸需该盐酸8 mL 的稀盐酸需该盐酸8 mL |
C.该盐酸物质的量浓度为12 mol⋅L |
| D.配制稀盐酸时,取用浓盐酸的量筒使用后应洗涤,并将洗涤液也注入容量瓶中 |
您最近一年使用:0次
2023-12-16更新
|
150次组卷
|
2卷引用:江苏省宿迁市沭阳县2023-2024学年高一上学期期中调研测试化学试题
名校
解题方法
10 . 一定温度下,将足量的 固体置于恒容密闭容器中,发生反应
固体置于恒容密闭容器中,发生反应 (不考虑
(不考虑 转化为
转化为 ),下列不能判断该反应达到平衡状态的是
),下列不能判断该反应达到平衡状态的是
 固体置于恒容密闭容器中,发生反应
固体置于恒容密闭容器中,发生反应 (不考虑
(不考虑 转化为
转化为 ),下列不能判断该反应达到平衡状态的是
),下列不能判断该反应达到平衡状态的是| A.气体的颜色不再改变 | B.有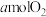 消耗,同时有 消耗,同时有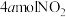 生成 生成 |
| C.气体的平均相对分子质量不再变化 | D.固体混合物中铜元素的质量分数不再变化 |
您最近一年使用:0次
2023-03-17更新
|
820次组卷
|
9卷引用:江苏省宿迁北附同文实验学校2022-2023学年高一3月月考化学试题
江苏省宿迁北附同文实验学校2022-2023学年高一3月月考化学试题浙江省四校联考2022-2023学年高一下学期3月月考化学试题(已下线)【2023】【高一下】【期中考】【杭师大附中】【高中化学】【张明涛收集】湖南省张家界市2022-2023学年高一下学期期末考试化学试题安徽师范大学附属中学2023-2024学年高二上学期开学考试化学试题黑龙江省牡丹江市第一高级中学2023-2024学年高一下学期5月期中考试化学试题湖南省湘楚名校2023-2024学年高一下学期5月联考化学试题(已下线)猜想05 化学反应的速率和限度(考题猜想)-2023-2024学年高一化学下学期期末考点大串讲(人教版2019必修第二册)(已下线)综合01 期末压轴80题之选择题-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(人教版2019必修第二册)



