名校
1 . 硫化物含硫量的测定、脱硫是极具价值的重要课题。
(1)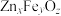 是一种复合脱硫剂,可用于脱除煤气中的
是一种复合脱硫剂,可用于脱除煤气中的 。
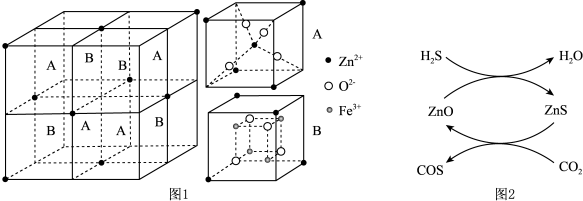
。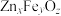 晶胞结构如图1所示(A、B交替排列,且A、B分别为晶胞的
晶胞结构如图1所示(A、B交替排列,且A、B分别为晶胞的 的结构),其化学式为
的结构),其化学式为__________ 。
②一定温度下将一定比例 和
和 的混合气体以一定流速通过装有上述脱硫剂的反应器,一段时间后,出口处检测到
的混合气体以一定流速通过装有上述脱硫剂的反应器,一段时间后,出口处检测到 。研究表明
。研究表明 参与了
参与了 与
与 生成
生成 的反应,反应机理如图2所示,反应前后
的反应,反应机理如图2所示,反应前后 的质量不变,该反应过程可描述为
的质量不变,该反应过程可描述为__________ 。
(2)稀土硫化物中硫含量的测定对其生产和质量控制具有重要意义。用如下方法对稀土硫化物中具有代表性的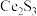 (
( 基态原子核外电子排布式为
基态原子核外电子排布式为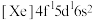 )样品硫含量进行测定。实验检测原理为
)样品硫含量进行测定。实验检测原理为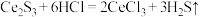
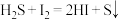

步骤1:称取0.1600g样品于反应瓶中,再准确滴加20.00mL 碘溶液;
碘溶液;
步骤2:缓慢滴加稍过量的稀盐酸(边滴加边摇动反应瓶),盖上瓶塞,剧烈摇动2min;
步骤3:滴入
 溶液至恰好完全反应,消耗
溶液至恰好完全反应,消耗 溶液20.00mL。
溶液20.00mL。
① 元素最高正化合价为
元素最高正化合价为__________ 。
②步骤1中不能使用稀硝酸的原因是__________ 。
③该样品中硫的质量分数为__________ (写出计算过程)。
(1)
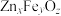 是一种复合脱硫剂,可用于脱除煤气中的
是一种复合脱硫剂,可用于脱除煤气中的 。
。 
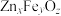 晶胞结构如图1所示(A、B交替排列,且A、B分别为晶胞的
晶胞结构如图1所示(A、B交替排列,且A、B分别为晶胞的 的结构),其化学式为
的结构),其化学式为②一定温度下将一定比例
 和
和 的混合气体以一定流速通过装有上述脱硫剂的反应器,一段时间后,出口处检测到
的混合气体以一定流速通过装有上述脱硫剂的反应器,一段时间后,出口处检测到 。研究表明
。研究表明 参与了
参与了 与
与 生成
生成 的反应,反应机理如图2所示,反应前后
的反应,反应机理如图2所示,反应前后 的质量不变,该反应过程可描述为
的质量不变,该反应过程可描述为(2)稀土硫化物中硫含量的测定对其生产和质量控制具有重要意义。用如下方法对稀土硫化物中具有代表性的
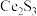 (
( 基态原子核外电子排布式为
基态原子核外电子排布式为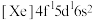 )样品硫含量进行测定。实验检测原理为
)样品硫含量进行测定。实验检测原理为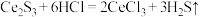
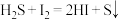

步骤1:称取0.1600g样品于反应瓶中,再准确滴加20.00mL
 碘溶液;
碘溶液;步骤2:缓慢滴加稍过量的稀盐酸(边滴加边摇动反应瓶),盖上瓶塞,剧烈摇动2min;
步骤3:滴入

 溶液至恰好完全反应,消耗
溶液至恰好完全反应,消耗 溶液20.00mL。
溶液20.00mL。①
 元素最高正化合价为
元素最高正化合价为②步骤1中不能使用稀硝酸的原因是
③该样品中硫的质量分数为
您最近一年使用:0次
名校
2 . 废旧锌锰电池中的黑锰粉含有MnO2、MnO(OH)、NH4Cl和少量ZnCl2、Fe2O3及炭黑等,为了保护环境、充分利用锰资源,通过如下流程制备MnSO4。
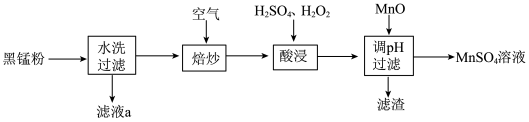
(1)Mn2+的价电子排布式为_______ 。
(2)“焙炒”的目的是除炭、氧化MnO(OH)等。空气中O2氧化MnO(OH)的化学方程式为_______ 。
(3)探究“酸浸”中MnO2溶解的适宜操作。
实验I.向MnO2中加入H2O2溶液,产生大量气泡:再加入稀H2SO4,固体未明显溶解。
实验Ⅱ.向MnO2中加入稀H2SO4,固体未溶解;再加入H2O2溶液,产生大量气泡,固体完全溶解。
①实验I中MnO2的作用是_______ ,实验Ⅱ中发生反应的离子方程式为_______ 。
②由实验可知,“酸浸”溶解MnO2时加入试剂的顺序是_______ 。
(4)最近科学家研制出超薄铁磁β-MnSe半导体,β-MnSe的晶胞结构如图所示。β-MnSe中Mn的配位数为_______ 。

(5)MnSO4可通过反应制得Mn3O4,在加热烘干Mn3O4过程中常常混有Mn2O3杂质,现对样品中Mn3O4的含量进行测定。取Mn3O4样品22.19g加入足量浓盐酸并加热,得到标准状况下2.24L氯气。(Mn3O4和Mn2O3在加热时均能和浓盐酸反应生成MnCl2)计算样品中Mn2O3的质量分数为_______ 。(写出计算过程)

(1)Mn2+的价电子排布式为
(2)“焙炒”的目的是除炭、氧化MnO(OH)等。空气中O2氧化MnO(OH)的化学方程式为
(3)探究“酸浸”中MnO2溶解的适宜操作。
实验I.向MnO2中加入H2O2溶液,产生大量气泡:再加入稀H2SO4,固体未明显溶解。
实验Ⅱ.向MnO2中加入稀H2SO4,固体未溶解;再加入H2O2溶液,产生大量气泡,固体完全溶解。
①实验I中MnO2的作用是
②由实验可知,“酸浸”溶解MnO2时加入试剂的顺序是
(4)最近科学家研制出超薄铁磁β-MnSe半导体,β-MnSe的晶胞结构如图所示。β-MnSe中Mn的配位数为

(5)MnSO4可通过反应制得Mn3O4,在加热烘干Mn3O4过程中常常混有Mn2O3杂质,现对样品中Mn3O4的含量进行测定。取Mn3O4样品22.19g加入足量浓盐酸并加热,得到标准状况下2.24L氯气。(Mn3O4和Mn2O3在加热时均能和浓盐酸反应生成MnCl2)计算样品中Mn2O3的质量分数为
您最近一年使用:0次
名校
解题方法
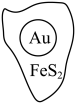
3 . 抗原检测盒中T线处使用的是胶体金(Au)标记物。一种从被 包裹的含金矿物(如图)中提取金单质的过程为:将金矿进行预处理,可除去
包裹的含金矿物(如图)中提取金单质的过程为:将金矿进行预处理,可除去 而露出金矿物,再加入
而露出金矿物,再加入 溶液和
溶液和 溶液对金矿物进行浸取,得到含金的溶液,然后加入
溶液对金矿物进行浸取,得到含金的溶液,然后加入 置换出
置换出 。其工艺流程如下:
。其工艺流程如下:
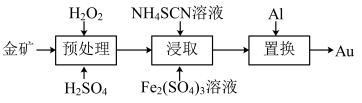
(1)①“预处理”时,用 将
将 直接氧化为
直接氧化为 和硫酸,写出该反应的化学方程式
和硫酸,写出该反应的化学方程式______ 。
②研究发现:在 的催化作用下,
的催化作用下, 产生具有强氧化能力的中间体
产生具有强氧化能力的中间体 ,
, 将金表面的
将金表面的 氧化溶出,
氧化溶出, 越多,
越多, 溶出率越高.
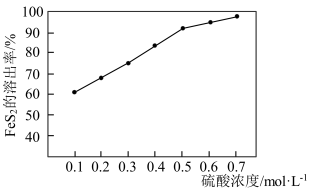
溶出率越高. 溶出率与硫酸初始浓度的关系如图所示,随着硫酸初始浓度的增大,
溶出率与硫酸初始浓度的关系如图所示,随着硫酸初始浓度的增大, 溶出率逐渐提高的主要原因是
溶出率逐渐提高的主要原因是________ 。
(2)“置换”时需维持无氧环境,其主要原因是_________ 。
(3)测定样品中 的含量:准确称取
的含量:准确称取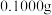 试样,加入王水,将样品中的
试样,加入王水,将样品中的 完全转化成具有强氧化性的氯金酸
完全转化成具有强氧化性的氯金酸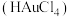 ,在除去硝酸根后的溶液中,边不断搅拌,边向溶液中加入过量
,在除去硝酸根后的溶液中,边不断搅拌,边向溶液中加入过量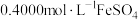 溶液
溶液 ,将
,将 完全还原为
完全还原为 ,滴加二苯胺磺酸钠作指示剂,用
,滴加二苯胺磺酸钠作指示剂,用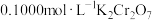 标准溶液滴定至终点(将剩余的
标准溶液滴定至终点(将剩余的 恰好完全氧化),消耗
恰好完全氧化),消耗 溶液
溶液 。
。
已知: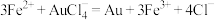

计算样品中金的质量分数(写出计算过程)_____________ 。
 包裹的含金矿物(如图)中提取金单质的过程为:将金矿进行预处理,可除去
包裹的含金矿物(如图)中提取金单质的过程为:将金矿进行预处理,可除去 而露出金矿物,再加入
而露出金矿物,再加入 溶液和
溶液和 溶液对金矿物进行浸取,得到含金的溶液,然后加入
溶液对金矿物进行浸取,得到含金的溶液,然后加入 置换出
置换出 。其工艺流程如下:
。其工艺流程如下:

(1)①“预处理”时,用
 将
将 直接氧化为
直接氧化为 和硫酸,写出该反应的化学方程式
和硫酸,写出该反应的化学方程式②研究发现:在
 的催化作用下,
的催化作用下, 产生具有强氧化能力的中间体
产生具有强氧化能力的中间体 ,
, 将金表面的
将金表面的 氧化溶出,
氧化溶出, 越多,
越多, 溶出率越高.
溶出率越高. 溶出率与硫酸初始浓度的关系如图所示,随着硫酸初始浓度的增大,
溶出率与硫酸初始浓度的关系如图所示,随着硫酸初始浓度的增大, 溶出率逐渐提高的主要原因是
溶出率逐渐提高的主要原因是
(2)“置换”时需维持无氧环境,其主要原因是
(3)测定样品中
 的含量:准确称取
的含量:准确称取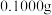 试样,加入王水,将样品中的
试样,加入王水,将样品中的 完全转化成具有强氧化性的氯金酸
完全转化成具有强氧化性的氯金酸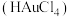 ,在除去硝酸根后的溶液中,边不断搅拌,边向溶液中加入过量
,在除去硝酸根后的溶液中,边不断搅拌,边向溶液中加入过量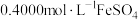 溶液
溶液 ,将
,将 完全还原为
完全还原为 ,滴加二苯胺磺酸钠作指示剂,用
,滴加二苯胺磺酸钠作指示剂,用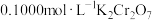 标准溶液滴定至终点(将剩余的
标准溶液滴定至终点(将剩余的 恰好完全氧化),消耗
恰好完全氧化),消耗 溶液
溶液 。
。已知:
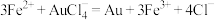

计算样品中金的质量分数(写出计算过程)
您最近一年使用:0次
2023-04-25更新
|
1052次组卷
|
2卷引用:江苏省泰州中学2022-2023学年高一上学期期末考试化学试题
名校
解题方法
4 . 抗原检测盒中T线处是使用的胶体金(Au)标记物,一种从被FeS2包裹的含金矿物中提金的工艺流程如下:
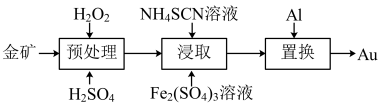
(1)①“预处理”时,FeS2被氧化为Fe2(SO4)3,写出该反应的离子方程式_______ 。
②研究发现H2O2在Fe2+的催化作用下产生具有强氧化能力的中间体·OH,·OH将金表面的FeS2氧化溶出。FeS2溶出率与硫酸初始浓度的关系如图所示,随着硫酸初始浓度的增大,FeS2溶出率逐渐提高的主要原因是_______ 。

(2)“置换”时需维持无氧环境,其主要原因是_______ 。
(3)测定样品中Au的含量:准确称取0.1000g试样,加入王水,将Au转化成具有强氧化性的氯金酸(HAuCl4),在除去硝酸根后的溶液中,边不断搅拌,边向溶液中加入过量0.4000mol·L-1 FeSO4溶液30.00mL,将HAuCl4完全还原为Au:滴加二苯胺磺酸钠作指示剂,用0.1000mol·L-1 K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液18.00mL。
已知: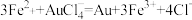

计算样品中金的质量分数(写出计算过程)_______ 。

(1)①“预处理”时,FeS2被氧化为Fe2(SO4)3,写出该反应的离子方程式
②研究发现H2O2在Fe2+的催化作用下产生具有强氧化能力的中间体·OH,·OH将金表面的FeS2氧化溶出。FeS2溶出率与硫酸初始浓度的关系如图所示,随着硫酸初始浓度的增大,FeS2溶出率逐渐提高的主要原因是

(2)“置换”时需维持无氧环境,其主要原因是
(3)测定样品中Au的含量:准确称取0.1000g试样,加入王水,将Au转化成具有强氧化性的氯金酸(HAuCl4),在除去硝酸根后的溶液中,边不断搅拌,边向溶液中加入过量0.4000mol·L-1 FeSO4溶液30.00mL,将HAuCl4完全还原为Au:滴加二苯胺磺酸钠作指示剂,用0.1000mol·L-1 K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液18.00mL。
已知:
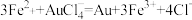

计算样品中金的质量分数(写出计算过程)
您最近一年使用:0次
解题方法
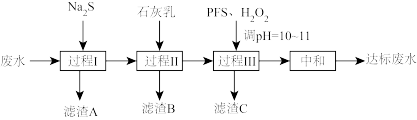
5 . 处理含 的废水(
的废水(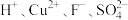 含量均超标)的流程如下:
含量均超标)的流程如下:
已知:① 时,
时,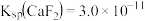 ,
,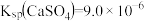 。
。
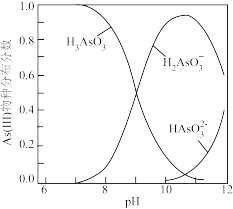
②室温下,溶液中 (III)物种分布分数与
(III)物种分布分数与 的关系如图所示。
的关系如图所示。
(1)“过程I”除 及部分砷。
及部分砷。
①基态As的核外电子排布式为_______ 。
②用离子方程式表示 溶液呈碱性的原因
溶液呈碱性的原因_______ 。
(2)“过程II”除 和
和 。测得滤液中
。测得滤液中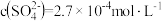 ,此时
,此时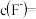
_______  。
。
(3)“过程III”进一步除砷。 (聚合硫酸铁)溶于水形成的
(聚合硫酸铁)溶于水形成的 胶体和加入的
胶体和加入的 可将砷转化为难溶的
可将砷转化为难溶的 除去。
除去。
①生成 的离子方程式为
的离子方程式为_______ 。
②测定“滤渣C”中 含量。称取
含量。称取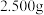 样品用稀硫酸溶解后,转移至100容量瓶中并加水稀释至刻度。量取
样品用稀硫酸溶解后,转移至100容量瓶中并加水稀释至刻度。量取 溶液于锥形瓶中,依次加入足量的
溶液于锥形瓶中,依次加入足量的 溶液和
溶液和 溶液。充分反应后,用
溶液。充分反应后,用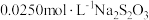 标准溶液滴定至终点,平行滴定3次,平均消耗
标准溶液滴定至终点,平行滴定3次,平均消耗 溶液
溶液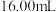 。
。
(已知: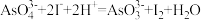 ,
,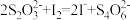 ;
; 与
与 反应生成
反应生成 ,氧化性
,氧化性 。)
。)
i.加入足量的 溶液的作用为
溶液的作用为_______ 。
ii.计算样品中 的质量分数
的质量分数_______ (写出计算过程)。
 的废水(
的废水(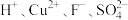 含量均超标)的流程如下:
含量均超标)的流程如下:
已知:①
 时,
时,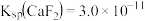 ,
,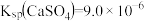 。
。②室温下,溶液中
 (III)物种分布分数与
(III)物种分布分数与 的关系如图所示。
的关系如图所示。
(1)“过程I”除
 及部分砷。
及部分砷。①基态As的核外电子排布式为
②用离子方程式表示
 溶液呈碱性的原因
溶液呈碱性的原因(2)“过程II”除
 和
和 。测得滤液中
。测得滤液中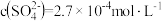 ,此时
,此时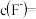
 。
。(3)“过程III”进一步除砷。
 (聚合硫酸铁)溶于水形成的
(聚合硫酸铁)溶于水形成的 胶体和加入的
胶体和加入的 可将砷转化为难溶的
可将砷转化为难溶的 除去。
除去。①生成
 的离子方程式为
的离子方程式为②测定“滤渣C”中
 含量。称取
含量。称取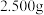 样品用稀硫酸溶解后,转移至100容量瓶中并加水稀释至刻度。量取
样品用稀硫酸溶解后,转移至100容量瓶中并加水稀释至刻度。量取 溶液于锥形瓶中,依次加入足量的
溶液于锥形瓶中,依次加入足量的 溶液和
溶液和 溶液。充分反应后,用
溶液。充分反应后,用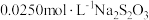 标准溶液滴定至终点,平行滴定3次,平均消耗
标准溶液滴定至终点,平行滴定3次,平均消耗 溶液
溶液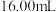 。
。(已知:
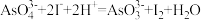 ,
,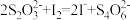 ;
; 与
与 反应生成
反应生成 ,氧化性
,氧化性 。)
。) i.加入足量的
 溶液的作用为
溶液的作用为ii.计算样品中
 的质量分数
的质量分数
您最近一年使用:0次
名校
6 . 硫化物含硫量的测定、脱硫是极具价值的重要课题。
(1)稀土硫化物中硫含量的测定对其生产和质量控制具有重要意义。用如下方法对稀土硫化物中具有代表性的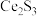 (
( 基态原子核外电子排布式为
基态原子核外电子排布式为 )样品硫含量进行测定。实验检测原理为
)样品硫含量进行测定。实验检测原理为
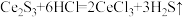
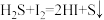

步骤1:称取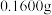 样品于反应瓶中,再准确滴加
样品于反应瓶中,再准确滴加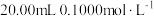 碘溶液;
碘溶液;
步骤2:缓慢滴加稍过量的稀盐酸(边滴加边摇动反应瓶),盖上瓶塞,剧烈摇动 ;
;
步骤3:滴入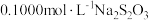 溶液至恰好完全反应,消耗
溶液至恰好完全反应,消耗 溶液
溶液 。
。
①Ce元素最高正化合价为_______ 。
②步骤1中不能使用稀硝酸的原因是_______ 。
③该样品中硫的质量分数为_______ (写出计算过程)。
(2)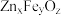 是一种复合脱硫剂,可用于脱除煤气中的
是一种复合脱硫剂,可用于脱除煤气中的 。
。
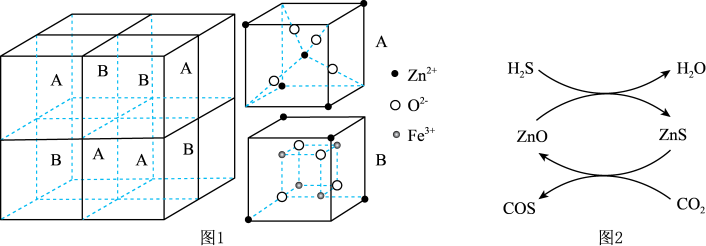
①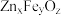 晶胞结构如图1所示(A、B分别为晶胞的
晶胞结构如图1所示(A、B分别为晶胞的 的结构),其化学式为
的结构),其化学式为_______ 。
②一定温度下将一定比例 和
和 的混合气体以一定流速通过装有上述脱硫剂的反应器,一段时间后,出口处检测到
的混合气体以一定流速通过装有上述脱硫剂的反应器,一段时间后,出口处检测到 。研究表明
。研究表明 参与了
参与了 与
与 生成
生成 的反应,反应机理如图2所示,反应前后
的反应,反应机理如图2所示,反应前后 的质量不变,该反应过程可描述为
的质量不变,该反应过程可描述为_______ 。
(1)稀土硫化物中硫含量的测定对其生产和质量控制具有重要意义。用如下方法对稀土硫化物中具有代表性的
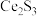 (
( 基态原子核外电子排布式为
基态原子核外电子排布式为 )样品硫含量进行测定。实验检测原理为
)样品硫含量进行测定。实验检测原理为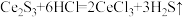
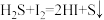

步骤1:称取
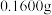 样品于反应瓶中,再准确滴加
样品于反应瓶中,再准确滴加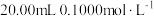 碘溶液;
碘溶液;步骤2:缓慢滴加稍过量的稀盐酸(边滴加边摇动反应瓶),盖上瓶塞,剧烈摇动
 ;
;步骤3:滴入
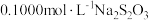 溶液至恰好完全反应,消耗
溶液至恰好完全反应,消耗 溶液
溶液 。
。①Ce元素最高正化合价为
②步骤1中不能使用稀硝酸的原因是
③该样品中硫的质量分数为
(2)
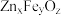 是一种复合脱硫剂,可用于脱除煤气中的
是一种复合脱硫剂,可用于脱除煤气中的 。
。
①
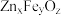 晶胞结构如图1所示(A、B分别为晶胞的
晶胞结构如图1所示(A、B分别为晶胞的 的结构),其化学式为
的结构),其化学式为②一定温度下将一定比例
 和
和 的混合气体以一定流速通过装有上述脱硫剂的反应器,一段时间后,出口处检测到
的混合气体以一定流速通过装有上述脱硫剂的反应器,一段时间后,出口处检测到 。研究表明
。研究表明 参与了
参与了 与
与 生成
生成 的反应,反应机理如图2所示,反应前后
的反应,反应机理如图2所示,反应前后 的质量不变,该反应过程可描述为
的质量不变,该反应过程可描述为
您最近一年使用:0次
名校
解题方法
7 . 利用黄铁矿(主要成分为 )与软锰矿(主要成分为
)与软锰矿(主要成分为 )制备
)制备 并回收单质硫的部分工艺流程如下:
并回收单质硫的部分工艺流程如下: 、
、 、
、 等金属阳离子。
等金属阳离子。
(1)当温度为90℃时,酸浸过程中硫酸浓度c对Mn浸取率的影响如图1所示。 的价电子排布式为
的价电子排布式为___________ 。
②酸浸时反应生成 和S的离子方程式为
和S的离子方程式为___________ 。
③100min后,Mn浸取率随硫酸浓度增大而呈下降趋势,可能的原因是___________ 。
④酸浸液中还含有 等重金属阳离子,请结合数据说明能否用MnS除去
等重金属阳离子,请结合数据说明能否用MnS除去
___________ 。[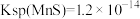 ,
,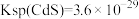 ]
]
(2) 溶液浸取滤渣时的反应为
溶液浸取滤渣时的反应为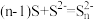 ,单质硫浸取率随温度变化曲线如图2所示。温度高于30℃,单质硫浸取率下降的可能原因是
,单质硫浸取率随温度变化曲线如图2所示。温度高于30℃,单质硫浸取率下降的可能原因是___________ 。 产品中含有少量
产品中含有少量 和
和 杂质,进行以下实验测定产品中
杂质,进行以下实验测定产品中 含量:取10.00g产品溶于水,配成100mL溶液;取10.00mL所配溶液用
含量:取10.00g产品溶于水,配成100mL溶液;取10.00mL所配溶液用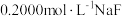 溶液滴定,消耗10.00mL;另取10.00mL所配溶液用
溶液滴定,消耗10.00mL;另取10.00mL所配溶液用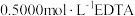 溶液滴定,消耗13.00mL。(已知:
溶液滴定,消耗13.00mL。(已知: 和
和 难溶于水;
难溶于水; 、
、 和
和 与EDTA按物质的量之比1∶1反应。),计算产品中
与EDTA按物质的量之比1∶1反应。),计算产品中 的质量分数
的质量分数___________ 。(写出计算过程)
 )与软锰矿(主要成分为
)与软锰矿(主要成分为 )制备
)制备 并回收单质硫的部分工艺流程如下:
并回收单质硫的部分工艺流程如下: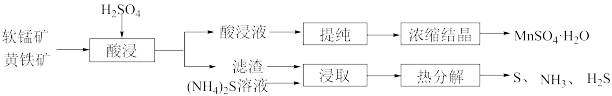
 、
、 、
、 等金属阳离子。
等金属阳离子。(1)当温度为90℃时,酸浸过程中硫酸浓度c对Mn浸取率的影响如图1所示。

 的价电子排布式为
的价电子排布式为②酸浸时反应生成
 和S的离子方程式为
和S的离子方程式为③100min后,Mn浸取率随硫酸浓度增大而呈下降趋势,可能的原因是
④酸浸液中还含有
 等重金属阳离子,请结合数据说明能否用MnS除去
等重金属阳离子,请结合数据说明能否用MnS除去
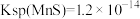 ,
,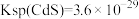 ]
](2)
 溶液浸取滤渣时的反应为
溶液浸取滤渣时的反应为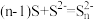 ,单质硫浸取率随温度变化曲线如图2所示。温度高于30℃,单质硫浸取率下降的可能原因是
,单质硫浸取率随温度变化曲线如图2所示。温度高于30℃,单质硫浸取率下降的可能原因是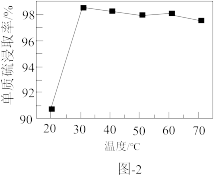
 产品中含有少量
产品中含有少量 和
和 杂质,进行以下实验测定产品中
杂质,进行以下实验测定产品中 含量:取10.00g产品溶于水,配成100mL溶液;取10.00mL所配溶液用
含量:取10.00g产品溶于水,配成100mL溶液;取10.00mL所配溶液用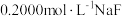 溶液滴定,消耗10.00mL;另取10.00mL所配溶液用
溶液滴定,消耗10.00mL;另取10.00mL所配溶液用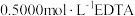 溶液滴定,消耗13.00mL。(已知:
溶液滴定,消耗13.00mL。(已知: 和
和 难溶于水;
难溶于水; 、
、 和
和 与EDTA按物质的量之比1∶1反应。),计算产品中
与EDTA按物质的量之比1∶1反应。),计算产品中 的质量分数
的质量分数
您最近一年使用:0次
2022-01-24更新
|
331次组卷
|
2卷引用:江苏省泰州市2021-2022学年高三上学期期末考试化学试题
解题方法
8 . Na2S2O3•5H2O俗称“海波”,是重要的化工原料,常用作脱氯剂、定影剂和还原剂。
(1)Na2S2O3还原性较强,在碱性溶液中易被Cl2氧化成SO ,常用作脱氯剂,该反应的离子方程式是
,常用作脱氯剂,该反应的离子方程式是___ 。
(2)测定海波在产品中的质量分数。依据反应2S2O +I2═S4O
+I2═S4O +2I-,可用I2的标准溶液测定产品的纯度。称取5.500g产品,配制成100mL溶液。取10.00mL该溶液,以淀粉洛液为指示剂,用浓度为0.05000mol•L-1I2的标准溶液进行滴定,相关数据记录如表所示。
+2I-,可用I2的标准溶液测定产品的纯度。称取5.500g产品,配制成100mL溶液。取10.00mL该溶液,以淀粉洛液为指示剂,用浓度为0.05000mol•L-1I2的标准溶液进行滴定,相关数据记录如表所示。
①判断滴定终点的现象是___ 。
②计算海波在产品中的质量分数___ (写出计算过程)。
③滴定法测得产品中Na2S2O3•5H2O含量为100.5%,则产品中可能混有的物质是___ 。
(1)Na2S2O3还原性较强,在碱性溶液中易被Cl2氧化成SO
 ,常用作脱氯剂,该反应的离子方程式是
,常用作脱氯剂,该反应的离子方程式是(2)测定海波在产品中的质量分数。依据反应2S2O
 +I2═S4O
+I2═S4O +2I-,可用I2的标准溶液测定产品的纯度。称取5.500g产品,配制成100mL溶液。取10.00mL该溶液,以淀粉洛液为指示剂,用浓度为0.05000mol•L-1I2的标准溶液进行滴定,相关数据记录如表所示。
+2I-,可用I2的标准溶液测定产品的纯度。称取5.500g产品,配制成100mL溶液。取10.00mL该溶液,以淀粉洛液为指示剂,用浓度为0.05000mol•L-1I2的标准溶液进行滴定,相关数据记录如表所示。| 编号 | 1 | 2 | 3 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.99 | 19.08 | 20.01 |
②计算海波在产品中的质量分数
③滴定法测得产品中Na2S2O3•5H2O含量为100.5%,则产品中可能混有的物质是
您最近一年使用:0次
名校
解题方法
9 . 废弃物的综合利用有利于节约资源、保护环境。实验室利用废旧电池的铜帽(Cu、Zn总含量约为99%)制备ZnSO4·7H2O和CuSO4·5H2O的部分实验步骤如下:

(1)在“溶解I”步骤中,为加快溶解速率,可采取的措施是_____ (任写一种方法)。
(2) 从“滤液I”中提取ZnSO4·7H2O的实验步骤依次为_____ 、_____ 、过滤、冰水洗涤、低温干燥。
(3)在“溶解II”步骤中,发生反应的化学方程式为_____________ 。
(4)为测定产品中CuSO4·5H2O的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000mol·L-1Na2S2O3溶液至刚好完全反应,消耗Na2S2O3溶液25.00mL。已知:2Cu2++4I-=2CuI(白色)↓+I2, 2S2O +I2=2I-+S4O
+I2=2I-+S4O 请依据实验数据计算样品中CuSO4·5H2O的质量分数(写出计算过程,结果保留4位有效数字)
请依据实验数据计算样品中CuSO4·5H2O的质量分数(写出计算过程,结果保留4位有效数字)_______ 。

(1)在“溶解I”步骤中,为加快溶解速率,可采取的措施是
(2) 从“滤液I”中提取ZnSO4·7H2O的实验步骤依次为
(3)在“溶解II”步骤中,发生反应的化学方程式为
(4)为测定产品中CuSO4·5H2O的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000mol·L-1Na2S2O3溶液至刚好完全反应,消耗Na2S2O3溶液25.00mL。已知:2Cu2++4I-=2CuI(白色)↓+I2, 2S2O
 +I2=2I-+S4O
+I2=2I-+S4O 请依据实验数据计算样品中CuSO4·5H2O的质量分数(写出计算过程,结果保留4位有效数字)
请依据实验数据计算样品中CuSO4·5H2O的质量分数(写出计算过程,结果保留4位有效数字)
您最近一年使用:0次
2020-11-11更新
|
161次组卷
|
2卷引用:江苏省靖江高级中学2020~2021学年高一上学期阶段考试化学试题
名校
解题方法
10 . 对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂,浓硫酸为催化剂,通过甲苯的硝化反应制备。
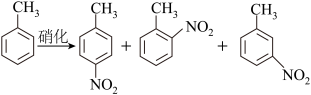
一种新的制备对硝基甲苯的实验方法是:以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),在CCl4溶液中,加入乙酸酐(有脱水作用),45℃反应1h 。反应结束后,过滤,滤液分别用5% NaHCO3溶液、水洗至中性,再经分离提纯得到对硝基甲苯。
(1)上述实验中过滤的目的是___________ 。
(2)滤液在分液漏斗中洗涤静置后,有机层处于________ 层(填“上”或'下”)。
(3)5% NaHCO3溶液洗涤的目的是__________
(4)下列给出了催化剂种类及用量对甲苯硝化反应影响的实验结果。
①NaHSO4催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为_______________ 。
②由甲苯硝化得到的各种产物的含量可知,甲苯硝化反应的特点是_________________ 。
③与浓硫酸催化甲苯硝化相比,NaHSO4催化甲苯硝化的优点有_____________ 。

一种新的制备对硝基甲苯的实验方法是:以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),在CCl4溶液中,加入乙酸酐(有脱水作用),45℃反应1h 。反应结束后,过滤,滤液分别用5% NaHCO3溶液、水洗至中性,再经分离提纯得到对硝基甲苯。
(1)上述实验中过滤的目的是
(2)滤液在分液漏斗中洗涤静置后,有机层处于
(3)5% NaHCO3溶液洗涤的目的是
(4)下列给出了催化剂种类及用量对甲苯硝化反应影响的实验结果。
| 催化剂 | n(催化剂)/n(甲苯) | 硝化产物中各种异构体质量分数(%) | 总产率(%) | ||
| 对硝基甲苯 | 邻硝基甲苯 | 间硝基甲苯 | |||
| 浓H2SO4 | 1.0 | 35.6 | 60.2 | 4.2 | 98.0 |
| 1.2 | 36.5 | 59.5 | 4.0 | 99.8 | |
| NaHSO4 | 0.15 | 44.6 | 55.1 | 0.3 | 98.9 |
| 0.25 | 46.3 | 52.8 | 0.9 | 99.9 | |
| 0.32 | 47.9 | 51.8 | 0.3 | 99.9 | |
| 0.36 | 45.2 | 54.2 | 0.6 | 99.9 | |
②由甲苯硝化得到的各种产物的含量可知,甲苯硝化反应的特点是
③与浓硫酸催化甲苯硝化相比,NaHSO4催化甲苯硝化的优点有
您最近一年使用:0次
2020-05-18更新
|
203次组卷
|
3卷引用:江苏省泰州中学2019-2020学年高二下学期第二次月考化学试题



