名校
1 .  (三草酸合铁酸钾)为亮绿色晶体,可用于工艺设计和生产科研中晒制蓝图。回答下列问题:
(三草酸合铁酸钾)为亮绿色晶体,可用于工艺设计和生产科研中晒制蓝图。回答下列问题:
(1)探究三草酸合铁酸钾的热分解产物。
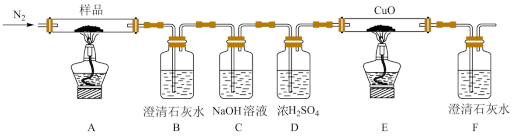
按如上图所示装置进行实验:观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色。
①装置C的作用是_______ 。
②装置E中发生反应的化学方程式为_______ 。
(2)测定三草酸合铁酸钾中铁的含量。
测定原理:
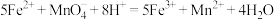
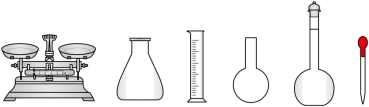
①配制溶液:实验中配制100 mL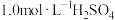 溶液,需要的仪器有烧杯、玻璃棒、量筒、
溶液,需要的仪器有烧杯、玻璃棒、量筒、_______ (从下图中选择,写出名称)。
②测定:称量10.00g晶体样品,加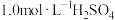 溶解后配成100mL溶液。
溶解后配成100mL溶液。
步骤Ⅰ:取20.00mL配制好的溶液于锥形瓶中,滴加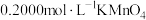 ,溶液至恰好完全反应。
,溶液至恰好完全反应。
步骤Ⅱ:向上述溶液中加入过量铜粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中,加稀 酸化,用
酸化,用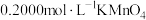 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液20.00mL。
溶液20.00mL。
该晶体样品中铁的质量分数为_______ (写出计算过程)。
 (三草酸合铁酸钾)为亮绿色晶体,可用于工艺设计和生产科研中晒制蓝图。回答下列问题:
(三草酸合铁酸钾)为亮绿色晶体,可用于工艺设计和生产科研中晒制蓝图。回答下列问题:(1)探究三草酸合铁酸钾的热分解产物。

按如上图所示装置进行实验:观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色。
①装置C的作用是
②装置E中发生反应的化学方程式为
(2)测定三草酸合铁酸钾中铁的含量。
测定原理:

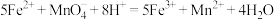
①配制溶液:实验中配制100 mL
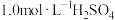 溶液,需要的仪器有烧杯、玻璃棒、量筒、
溶液,需要的仪器有烧杯、玻璃棒、量筒、
②测定:称量10.00g晶体样品,加
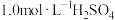 溶解后配成100mL溶液。
溶解后配成100mL溶液。步骤Ⅰ:取20.00mL配制好的溶液于锥形瓶中,滴加
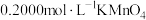 ,溶液至恰好完全反应。
,溶液至恰好完全反应。步骤Ⅱ:向上述溶液中加入过量铜粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中,加稀
 酸化,用
酸化,用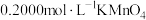 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液20.00mL。
溶液20.00mL。该晶体样品中铁的质量分数为
您最近一年使用:0次
名校
2 . 某兴趣小组利用废旧电池的铜帽(铜锌总含量约99%)制备了 样品,制备流程如下:
样品,制备流程如下:
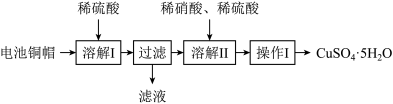
(1)“滤液”中主要含有的阳离子是______ 。
(2)“溶解II”过程中,发生反应的离子方程式为______ 。
(3)“溶解II”过程中应控制反应温度不能过高的原因是______ 。
(4)操作I的具体操作是______ 。
(5)为测定所得 样品的纯度,兴趣小组进行了如下实验:称取2.570 g样品,配制成250 mL溶液,取25.00 mL溶液于锥形瓶中,加入过量KI并充分振荡后,滴加几滴淀粉溶液,再滴入
样品的纯度,兴趣小组进行了如下实验:称取2.570 g样品,配制成250 mL溶液,取25.00 mL溶液于锥形瓶中,加入过量KI并充分振荡后,滴加几滴淀粉溶液,再滴入 的
的 溶液至刚好完全反应,恰好完全反应时消耗
溶液至刚好完全反应,恰好完全反应时消耗 溶液的体积为25.00 mL。实验过程中发生的反应如下:
溶液的体积为25.00 mL。实验过程中发生的反应如下:
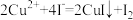 ;
; 。
。
①配制250 mL溶液所需的玻璃仪器除烧杯、玻璃棒外还有______ 。
②计算出样品中 的质量分数
的质量分数______ 。(写出计算过程,保留三位有效数字)
 样品,制备流程如下:
样品,制备流程如下:
(1)“滤液”中主要含有的阳离子是
(2)“溶解II”过程中,发生反应的离子方程式为
(3)“溶解II”过程中应控制反应温度不能过高的原因是
(4)操作I的具体操作是
(5)为测定所得
 样品的纯度,兴趣小组进行了如下实验:称取2.570 g样品,配制成250 mL溶液,取25.00 mL溶液于锥形瓶中,加入过量KI并充分振荡后,滴加几滴淀粉溶液,再滴入
样品的纯度,兴趣小组进行了如下实验:称取2.570 g样品,配制成250 mL溶液,取25.00 mL溶液于锥形瓶中,加入过量KI并充分振荡后,滴加几滴淀粉溶液,再滴入 的
的 溶液至刚好完全反应,恰好完全反应时消耗
溶液至刚好完全反应,恰好完全反应时消耗 溶液的体积为25.00 mL。实验过程中发生的反应如下:
溶液的体积为25.00 mL。实验过程中发生的反应如下: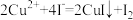 ;
; 。
。①配制250 mL溶液所需的玻璃仪器除烧杯、玻璃棒外还有
②计算出样品中
 的质量分数
的质量分数
您最近一年使用:0次
2023-04-23更新
|
256次组卷
|
2卷引用:江苏省徐州市2022-2023学年高一下学期期中考试化学试题
名校
解题方法
3 . 钒的氧化物(如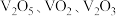 等,均难溶于水)在光储材料等领域有广泛应用。在800℃下,
等,均难溶于水)在光储材料等领域有广泛应用。在800℃下, 和焦炭反应可生成
和焦炭反应可生成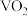 和
和 ,同时得到
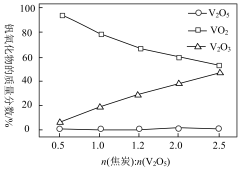
,同时得到 气体。反应体系中钒氧化物的质量分数(%)随n(焦炭):
气体。反应体系中钒氧化物的质量分数(%)随n(焦炭):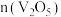 的变化关系如图。下列说法
的变化关系如图。下列说法不 正确的是
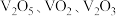 等,均难溶于水)在光储材料等领域有广泛应用。在800℃下,
等,均难溶于水)在光储材料等领域有广泛应用。在800℃下, 和焦炭反应可生成
和焦炭反应可生成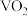 和
和 ,同时得到
,同时得到 气体。反应体系中钒氧化物的质量分数(%)随n(焦炭):
气体。反应体系中钒氧化物的质量分数(%)随n(焦炭):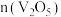 的变化关系如图。下列说法
的变化关系如图。下列说法
A.该条件下 的氧化性强于 的氧化性强于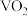 和 和 |
B.铝还原 制钒的反应属于置换反应 制钒的反应属于置换反应 |
C.参加反应的n(焦炭):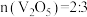 时,反应所得 时,反应所得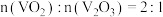 |
D.碳的用量越大,还原产物中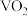 含量越低 含量越低 |
您最近一年使用:0次
2023-07-16更新
|
485次组卷
|
6卷引用:江苏省徐州市等3地2022-2023学年高一上学期期末考试化学试题
江苏省徐州市等3地2022-2023学年高一上学期期末考试化学试题江苏省南通市海安市2022-2023学年高一上学期期末考试化学试题(已下线)题型04 氧化还原反应方程式的配平及其计算-学易金卷:备战2023-2024学年高一化学期末真题分类汇编(江苏专用)江苏省苏州市工业园区星海实验高级中学2023-2024学年高一上学期12月调研化学试题江苏省苏州市吴江中学2023-2024学年高一上学期12月月考化学试题(1卷)江苏省苏州市黄埭中学2023-2024学年高一上学期12月月考化学试题
4 . 过氧化镁(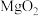 )不溶于水,与酸反应生成
)不溶于水,与酸反应生成 ,在医学上可作解酸剂。常温下
,在医学上可作解酸剂。常温下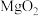 较稳定,加热时会分解生成
较稳定,加热时会分解生成 和MgO。MgO与
和MgO。MgO与 反应可制得
反应可制得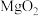 ,同时放出大量热。一种制备
,同时放出大量热。一种制备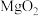 的流程如图所示:请回答下列问题:
的流程如图所示:请回答下列问题:
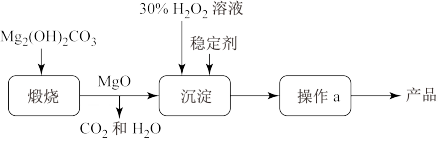
(1)过氧化镁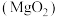 中氧元素的价态为
中氧元素的价态为_______ 。煅烧 的化学反应方程式
的化学反应方程式_______ 。
(2)上述制备过程中加入稳定剂的作用是_______ ;操作a为_______ 。
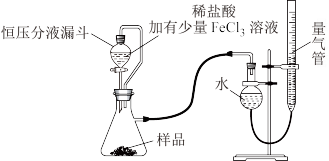
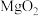 产品中常会混有少量MgO,实验室可通过多种方案测定样品中
产品中常会混有少量MgO,实验室可通过多种方案测定样品中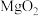 的含量。某研究小组拟用下图装置测定样品(含
的含量。某研究小组拟用下图装置测定样品(含 杂质)中
杂质)中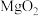 的含量。
的含量。
(3)研究小组的实验原理是(用化学方程式表示)
①_______ ;
②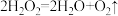 ,稀盐酸中加入
,稀盐酸中加入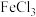 溶液的作用是
溶液的作用是_______ 。
(4)实验中使用恒压分液漏斗的优点是:使分液漏斗中的溶液顺利滴下、_______ 。
(5)该小组记录的实验数据如下,样品的质量为mg;反应开始前量气管的读数为amL;反应结束后量气管的读数为bmL,则样品中过氧化镁的质量分数为_______ 。(该实验条件下 密度为
密度为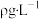 )
)
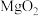 )不溶于水,与酸反应生成
)不溶于水,与酸反应生成 ,在医学上可作解酸剂。常温下
,在医学上可作解酸剂。常温下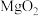 较稳定,加热时会分解生成
较稳定,加热时会分解生成 和MgO。MgO与
和MgO。MgO与 反应可制得
反应可制得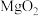 ,同时放出大量热。一种制备
,同时放出大量热。一种制备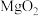 的流程如图所示:请回答下列问题:
的流程如图所示:请回答下列问题:
(1)过氧化镁
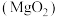 中氧元素的价态为
中氧元素的价态为 的化学反应方程式
的化学反应方程式(2)上述制备过程中加入稳定剂的作用是
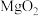 产品中常会混有少量MgO,实验室可通过多种方案测定样品中
产品中常会混有少量MgO,实验室可通过多种方案测定样品中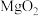 的含量。某研究小组拟用下图装置测定样品(含
的含量。某研究小组拟用下图装置测定样品(含 杂质)中
杂质)中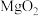 的含量。
的含量。
(3)研究小组的实验原理是(用化学方程式表示)
①
②
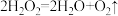 ,稀盐酸中加入
,稀盐酸中加入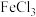 溶液的作用是
溶液的作用是(4)实验中使用恒压分液漏斗的优点是:使分液漏斗中的溶液顺利滴下、
(5)该小组记录的实验数据如下,样品的质量为mg;反应开始前量气管的读数为amL;反应结束后量气管的读数为bmL,则样品中过氧化镁的质量分数为
 密度为
密度为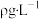 )
)
您最近一年使用:0次
5 . 某实验小组为了分析补血剂 FeSO4·7H2O中铁元素的质量分数,用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是5Fe2++ +8H+=5Fe3++Mn2++4H2O。
+8H+=5Fe3++Mn2++4H2O。
(1)实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要用的仪器除天平、药匙、玻璃棒、烧杯、量筒、胶头滴管外,还需_______ 。
(2)滴定前是否要滴加指示剂?_______ (填“是”或“否”),理由是_______ 。
(3)某同学设计的下列滴定方式中,最合理的是_______ (填字母)。

(4)该实验小组称取12.0 g补血剂在容量瓶中配成100 mL溶液,量取25.00 mL试样溶液,用0.100 mol·L-1 KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00 mL,则所测补血剂中铁元素的质量分数是_______ (精确至0.01%)。
(5)若该小组配制溶液和滴定操作时引起的误差忽略,最终所测补血剂中铁元素含量仍偏小,其可能原因是_______ 。
 +8H+=5Fe3++Mn2++4H2O。
+8H+=5Fe3++Mn2++4H2O。(1)实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要用的仪器除天平、药匙、玻璃棒、烧杯、量筒、胶头滴管外,还需
(2)滴定前是否要滴加指示剂?
(3)某同学设计的下列滴定方式中,最合理的是

(4)该实验小组称取12.0 g补血剂在容量瓶中配成100 mL溶液,量取25.00 mL试样溶液,用0.100 mol·L-1 KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00 mL,则所测补血剂中铁元素的质量分数是
(5)若该小组配制溶液和滴定操作时引起的误差忽略,最终所测补血剂中铁元素含量仍偏小,其可能原因是
您最近一年使用:0次
2022-09-30更新
|
244次组卷
|
2卷引用:江苏省徐州市沛县树恩高级中学2021-2022学年高二下学期期中测试化学试题
解题方法
6 . 某兴趣小组利用废旧电池的铜帽(铜锌总含量约 )制备了
)制备了 晶体,制备流程如下:
晶体,制备流程如下:
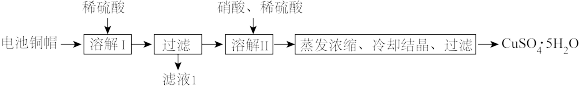
完成下列问题:
(1)“滤液Ⅰ”含有的溶质主要是_______ (填化学式)。
(2)“溶解Ⅱ”发生反应的离子方程式是_______ 。
(3)“溶解Ⅱ”常要加热,但是加热温度不宜过高,原因是_______ 。
(4)锌与稀硫酸反应制取氢气,当加入少量 溶液时,生成氢气的速率会大大提高,但当加入的
溶液时,生成氢气的速率会大大提高,但当加入的 溶液超过一定量时,生成氢气的速率反而会下降。请分析生成氢气速率下降的主要原因:
溶液超过一定量时,生成氢气的速率反而会下降。请分析生成氢气速率下降的主要原因:_______ 。
(5)某 晶体中常含有亚硝酸钠
晶体中常含有亚硝酸钠 ,现测定亚硝酸钠的含量,称取
,现测定亚硝酸钠的含量,称取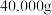 样品溶于水配成
样品溶于水配成 溶液,取
溶液,取 溶液于锥形瓶中,再向锥形瓶中加入
溶液于锥形瓶中,再向锥形瓶中加入 酸性
酸性 溶液
溶液 ,两者恰好完全反应:
,两者恰好完全反应: 。计算原晶体中亚硝酸钠的质量分数
。计算原晶体中亚硝酸钠的质量分数_______ 。(写出计算过程)
 )制备了
)制备了 晶体,制备流程如下:
晶体,制备流程如下: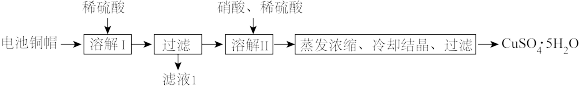
完成下列问题:
(1)“滤液Ⅰ”含有的溶质主要是
(2)“溶解Ⅱ”发生反应的离子方程式是
(3)“溶解Ⅱ”常要加热,但是加热温度不宜过高,原因是
(4)锌与稀硫酸反应制取氢气,当加入少量
 溶液时,生成氢气的速率会大大提高,但当加入的
溶液时,生成氢气的速率会大大提高,但当加入的 溶液超过一定量时,生成氢气的速率反而会下降。请分析生成氢气速率下降的主要原因:
溶液超过一定量时,生成氢气的速率反而会下降。请分析生成氢气速率下降的主要原因:(5)某
 晶体中常含有亚硝酸钠
晶体中常含有亚硝酸钠 ,现测定亚硝酸钠的含量,称取
,现测定亚硝酸钠的含量,称取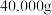 样品溶于水配成
样品溶于水配成 溶液,取
溶液,取 溶液于锥形瓶中,再向锥形瓶中加入
溶液于锥形瓶中,再向锥形瓶中加入 酸性
酸性 溶液
溶液 ,两者恰好完全反应:
,两者恰好完全反应: 。计算原晶体中亚硝酸钠的质量分数
。计算原晶体中亚硝酸钠的质量分数
您最近一年使用:0次
名校
解题方法
7 . 草酸及其化合物在工业中有重要作用,例如:草酸可用于除铁锈,反应的离子方程式为: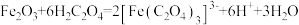 ;草酸铁铵[
;草酸铁铵[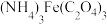 ]是一种常用的金属着色剂。
]是一种常用的金属着色剂。
(1)草酸( )是一种弱酸,不稳定,受热或遇浓硫酸会发生分解。在浓硫酸催化作用下,用硝酸氧化葡萄糖可制取草酸,实验装置如图所示
)是一种弱酸,不稳定,受热或遇浓硫酸会发生分解。在浓硫酸催化作用下,用硝酸氧化葡萄糖可制取草酸,实验装置如图所示
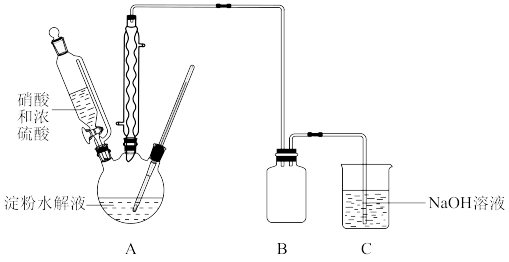
①葡萄糖溶液可由反应 得到。该实验中证明淀粉已经完全水解的实验操作及现象是
得到。该实验中证明淀粉已经完全水解的实验操作及现象是___________ 。
②55℃~60℃时,装置A中生成 ,同时生成NO。要将16.2g淀粉完全水解后的淀粉水解液完全转化为草酸,理论上消耗
,同时生成NO。要将16.2g淀粉完全水解后的淀粉水解液完全转化为草酸,理论上消耗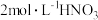 溶液的体积为
溶液的体积为___________ mL。
③该实验中催化剂浓硫酸用量过多,会导致草酸产率减少,原因是___________ 。
(2)草酸铁铵晶体[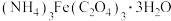 ]易溶于水,常温下其水溶液pH为4.0~5.0。设计以
]易溶于水,常温下其水溶液pH为4.0~5.0。设计以 、草酸溶液和氨水为原料,制备草酸铁铵晶体的实验方案:
、草酸溶液和氨水为原料,制备草酸铁铵晶体的实验方案:___________ 。
(3)制得的草酸铁铵晶体中往往会混有少量草酸,为测定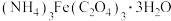 (M=428g/mol)的含量,进行下列实验:称取样品9.46g,加稀硫酸溶解后,配成100mL溶液。取20.00mL配制的溶液,用浓度为0.2000mol/L的KMnO4溶液滴定至终点时消耗KMnO4溶液28.00mL。已知:
(M=428g/mol)的含量,进行下列实验:称取样品9.46g,加稀硫酸溶解后,配成100mL溶液。取20.00mL配制的溶液,用浓度为0.2000mol/L的KMnO4溶液滴定至终点时消耗KMnO4溶液28.00mL。已知: (未配平)。通过计算,确定样品中
(未配平)。通过计算,确定样品中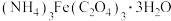 的质量分数
的质量分数___________ (写出计算过程)。
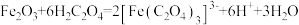 ;草酸铁铵[
;草酸铁铵[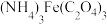 ]是一种常用的金属着色剂。
]是一种常用的金属着色剂。(1)草酸(
 )是一种弱酸,不稳定,受热或遇浓硫酸会发生分解。在浓硫酸催化作用下,用硝酸氧化葡萄糖可制取草酸,实验装置如图所示
)是一种弱酸,不稳定,受热或遇浓硫酸会发生分解。在浓硫酸催化作用下,用硝酸氧化葡萄糖可制取草酸,实验装置如图所示
①葡萄糖溶液可由反应
 得到。该实验中证明淀粉已经完全水解的实验操作及现象是
得到。该实验中证明淀粉已经完全水解的实验操作及现象是②55℃~60℃时,装置A中生成
 ,同时生成NO。要将16.2g淀粉完全水解后的淀粉水解液完全转化为草酸,理论上消耗
,同时生成NO。要将16.2g淀粉完全水解后的淀粉水解液完全转化为草酸,理论上消耗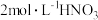 溶液的体积为
溶液的体积为③该实验中催化剂浓硫酸用量过多,会导致草酸产率减少,原因是
(2)草酸铁铵晶体[
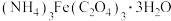 ]易溶于水,常温下其水溶液pH为4.0~5.0。设计以
]易溶于水,常温下其水溶液pH为4.0~5.0。设计以 、草酸溶液和氨水为原料,制备草酸铁铵晶体的实验方案:
、草酸溶液和氨水为原料,制备草酸铁铵晶体的实验方案:(3)制得的草酸铁铵晶体中往往会混有少量草酸,为测定
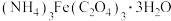 (M=428g/mol)的含量,进行下列实验:称取样品9.46g,加稀硫酸溶解后,配成100mL溶液。取20.00mL配制的溶液,用浓度为0.2000mol/L的KMnO4溶液滴定至终点时消耗KMnO4溶液28.00mL。已知:
(M=428g/mol)的含量,进行下列实验:称取样品9.46g,加稀硫酸溶解后,配成100mL溶液。取20.00mL配制的溶液,用浓度为0.2000mol/L的KMnO4溶液滴定至终点时消耗KMnO4溶液28.00mL。已知: (未配平)。通过计算,确定样品中
(未配平)。通过计算,确定样品中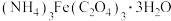 的质量分数
的质量分数
您最近一年使用:0次
2021-10-12更新
|
970次组卷
|
7卷引用:江苏省徐州市第七中学2021-2022学年高三下学期4月学情调研化学试题
江苏省徐州市第七中学2021-2022学年高三下学期4月学情调研化学试题江苏省(盐城中学、南通中学)2021-2022学年高三上学期第一次大联考化学试题江苏省扬州中学2021-2022学年高三下学期3月月考化学试题(已下线)必刷卷01-2022年高考化学考前信息必刷卷(江苏专用)江苏省南通市八校2022-2023学年高三上学期期初联考化学试题江苏省盐城市五校2023届高三上学期期末联考化学试题(已下线)专题27 物质制备类综合性实验题(学生版)-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)
名校
8 . CuCl为白色粉末,微溶于水,溶于浓盐酸或NaCl浓溶液,不溶于乙醇。一种由海绵铜(Cu和少量CuO等)为原料制备CuCl的工艺流程如图:
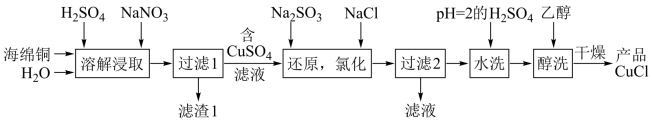
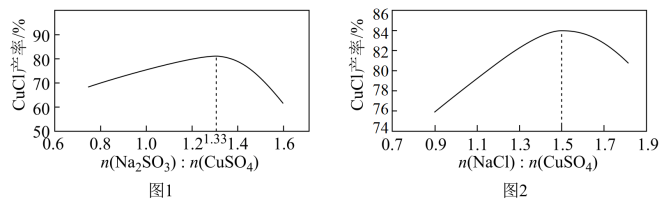
(1)“还原,氯化”时,Na2SO3和NaCl的用量对CuCl产率的影响如图1、图2所示。
①CuSO4与Na2SO3、NaCl在溶液中反应生成CuCl的离子方程式为___ 。
②当n(Na2SO3):n(CuSO4)>1.33时,比值越大CuCl产率越小,其原因是___ 。
③当1.0<n(NaCl):n(CuSO4)<1.5时,比值越大CuCl产率越大,结合沉淀平衡移动原理分析其原因是___ 。
(2)用“醇洗”可快速去除滤渣表面的水,防止滤渣被空气氧化为Cu2(OH)3Cl。CuCl被氧化为Cu2(OH)3Cl的化学方程式为___ 。
(3)为测定某氯化亚铜样品中CuCl的含量,某同学设计如下实验:准确称取氯化亚铜样品mg,将其置于过量的FeCl3溶液中,待固体完全溶解后,加入适量稀硫酸,用amol/L的K2Cr2O7溶液氧化反应生成的Fe2+,消耗K2Cr2O7溶液bmL,反应中Cr2O 被还原为Cr3+,求样品中CuCl的质量分数
被还原为Cr3+,求样品中CuCl的质量分数___ (写计算过程)。

(1)“还原,氯化”时,Na2SO3和NaCl的用量对CuCl产率的影响如图1、图2所示。

①CuSO4与Na2SO3、NaCl在溶液中反应生成CuCl的离子方程式为
②当n(Na2SO3):n(CuSO4)>1.33时,比值越大CuCl产率越小,其原因是
③当1.0<n(NaCl):n(CuSO4)<1.5时,比值越大CuCl产率越大,结合沉淀平衡移动原理分析其原因是
(2)用“醇洗”可快速去除滤渣表面的水,防止滤渣被空气氧化为Cu2(OH)3Cl。CuCl被氧化为Cu2(OH)3Cl的化学方程式为
(3)为测定某氯化亚铜样品中CuCl的含量,某同学设计如下实验:准确称取氯化亚铜样品mg,将其置于过量的FeCl3溶液中,待固体完全溶解后,加入适量稀硫酸,用amol/L的K2Cr2O7溶液氧化反应生成的Fe2+,消耗K2Cr2O7溶液bmL,反应中Cr2O
 被还原为Cr3+,求样品中CuCl的质量分数
被还原为Cr3+,求样品中CuCl的质量分数
您最近一年使用:0次
2021-12-22更新
|
743次组卷
|
7卷引用:江苏省徐州市第七中学2021-2022学年高三下学期2月检测化学试题
江苏省徐州市第七中学2021-2022学年高三下学期2月检测化学试题江苏省前黄高级中学、如东中学、姜堰中学2021-2022学年高三上学期12月份阶段性测试化学试题江苏省姜堰中学、如东中学、前黄中学三校2021- 2022学年高三联考化学试题(已下线)黄金卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(江苏卷)湖南省益阳市第一中学2021-2022学年高二下学期期末考试化学试题(已下线)2022年江苏卷高考真题变式题14-17(已下线)江苏省2022年普通高中学业水平选择性考试变式题(实验探究题)
9 . CH4、CH3OH、CO等都是重要的能源,也是重要的化工原料。
(1)已知25℃、101kPa时,1g甲烷完全燃烧生成CO和液态水时放出38kJ热量,则该条件下反应的热化学反应方程式___________ 。
(2)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量,有效地开发利用CO2,工业上可以用CO2来生产甲醇燃料。在体积为2L的密闭容器中,充入lmolCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。经测得CH3OH和CO2的物质的量随时间变化如图所示。
CH3OH(g)+H2O(g)。经测得CH3OH和CO2的物质的量随时间变化如图所示。
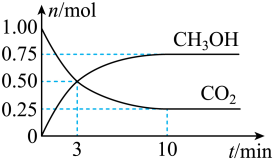
①从反应开始到平衡,CO2的平均反应速率v(CO2)=___________ 。
②达到平衡时,H2的转化率为___________ 。
(3)工业上也可以用CO和H2为原料制备CH3OH,反应方程式为:CO(g)+2H2(g) CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是
CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是___________ 。
A.反应中CO与CH3OH的物质的量之比为1:1
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗1molCO,同时生成1molCH3OH
D.CH3OH的质量分数在混合气体中保持不变
(1)已知25℃、101kPa时,1g甲烷完全燃烧生成CO和液态水时放出38kJ热量,则该条件下反应的热化学反应方程式
(2)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量,有效地开发利用CO2,工业上可以用CO2来生产甲醇燃料。在体积为2L的密闭容器中,充入lmolCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)。经测得CH3OH和CO2的物质的量随时间变化如图所示。
CH3OH(g)+H2O(g)。经测得CH3OH和CO2的物质的量随时间变化如图所示。
①从反应开始到平衡,CO2的平均反应速率v(CO2)=
②达到平衡时,H2的转化率为
(3)工业上也可以用CO和H2为原料制备CH3OH,反应方程式为:CO(g)+2H2(g)
 CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是
CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是A.反应中CO与CH3OH的物质的量之比为1:1
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗1molCO,同时生成1molCH3OH
D.CH3OH的质量分数在混合气体中保持不变
您最近一年使用:0次
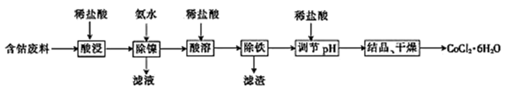
10 . 常温下,用含钴废料(主要成分为CoCO3,还含有少量NiCO3与铁屑)制备CoCl2•6H2O的工艺流程如图。
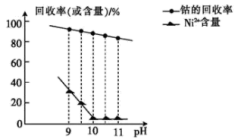
①已知除镍过程中溶液pH对钴的回收率及Ni2+含量的影响如图所示。
②部分金属阳离子在实验条件下开始沉淀和完全沉淀的pH如表所示:
回答下列问题:
(1)酸浸后溶液中的阳离子为:Co2+,Ni2+和__ 。
(2)除镍时,应调节溶液pH=__ ,此时Ni2+是否形成Ni(OH)2沉淀?___ (是或否)。若pH过小,则产品纯度会___ (升高,降低,或不变)。
(3)酸溶时,当调节pH=8时,溶液中n(Fe3+):n(Co2+)=__ 。
已知Ksp[Co(OH)2]=2.0×10-16,Ksp[Fe(OH)3]=4.0×10-38。
(4)除铁时先向溶液中加入30%的H2O2发生的离子反应方程式是:__ 。充分反应后再向溶液中加入CoCO3,调节溶液pH范围为__ ,使Fe3+完全转化为Fe(OH)3沉淀,最后过滤得到CoCl2溶液。
(5)已知Ag++SCN-=AgSCN↓,为测定粗产品中CoCl2•6H2O的含量,称取11.9g粗产品配成100mL溶液,从中取出25mL先加入含0.03mol的AgNO3,(杂质不与其反应),再用0.5mol/L的KSCN溶液标定过量的AgNO3,该标定操作所用的指示剂为__ (填化学式),若消耗20.00mL的KSCN溶液,则该粗产品中CoCl2•6H2O的质量分数为__ 。

①已知除镍过程中溶液pH对钴的回收率及Ni2+含量的影响如图所示。

②部分金属阳离子在实验条件下开始沉淀和完全沉淀的pH如表所示:
| 金属阳离子 | 开始沉淀pH | 完全沉淀pH |
| Fe3+ | 1.5 | 4.0 |
| Fe2+ | 7.5 | 9.7 |
| Co2+ | 6.6 | 9.4 |
| Ni2+ | 7.7 | 9.5 |
回答下列问题:
(1)酸浸后溶液中的阳离子为:Co2+,Ni2+和
(2)除镍时,应调节溶液pH=
(3)酸溶时,当调节pH=8时,溶液中n(Fe3+):n(Co2+)=
已知Ksp[Co(OH)2]=2.0×10-16,Ksp[Fe(OH)3]=4.0×10-38。
(4)除铁时先向溶液中加入30%的H2O2发生的离子反应方程式是:
(5)已知Ag++SCN-=AgSCN↓,为测定粗产品中CoCl2•6H2O的含量,称取11.9g粗产品配成100mL溶液,从中取出25mL先加入含0.03mol的AgNO3,(杂质不与其反应),再用0.5mol/L的KSCN溶液标定过量的AgNO3,该标定操作所用的指示剂为
您最近一年使用:0次
2020-07-18更新
|
242次组卷
|
5卷引用:江苏省徐州市2019-2020学年高二下学期期末抽测化学试题



