名校
解题方法
1 . 选择性催化还原法(SCR法)去除 是脱硝问题研究的热点,催化剂的选取是技术的核心。
是脱硝问题研究的热点,催化剂的选取是技术的核心。
(1)以 为催化剂的催化原理:
为催化剂的催化原理: 与
与 形成能提供氢离子的酸性位(如图所示),
形成能提供氢离子的酸性位(如图所示), 吸附在酸性位上生成中间体继续与NO反应。
吸附在酸性位上生成中间体继续与NO反应。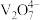 )形式存在,请写出该离子的结构式
)形式存在,请写出该离子的结构式___________ ;
②其他条件相同, 、NO以一定速率,通过一定量
、NO以一定速率,通过一定量 催化剂催化脱硝,当NO含量一定,
催化剂催化脱硝,当NO含量一定,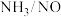 比值大于1.0后NO脱除率变化不大,其原因可能是
比值大于1.0后NO脱除率变化不大,其原因可能是___________ 。
(2)以 为催化剂的反应机理如图1所示:
为催化剂的反应机理如图1所示:___________ 。
②NO脱除率随温度变化如图2所示,温度高于1000℃时NO脱除率明显下降,可能原因是:___________ 。
(3)以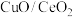 为催化剂
为催化剂
①理想 晶胞如图3所示,实际晶体中会含有部分氧空位。部分
晶胞如图3所示,实际晶体中会含有部分氧空位。部分 填充在由
填充在由 构成的
构成的___________ (填“四面体”或“八面体”)空隙中。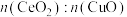 情况下脱硝、脱碳的情况。已知反应机理是CO首先吸附在
情况下脱硝、脱碳的情况。已知反应机理是CO首先吸附在 或CuO表面的活性位点上,由图像可以推断,CO反应的活性位点位于
或CuO表面的活性位点上,由图像可以推断,CO反应的活性位点位于___________ 上(填“ ”或“CuO”);
”或“CuO”);
③测定某催化剂中 质量分数,取催化剂产品0.8000g,用30mL高氯酸和20mL磷酸混合液加热溶解,冷却至室温后,用
质量分数,取催化剂产品0.8000g,用30mL高氯酸和20mL磷酸混合液加热溶解,冷却至室温后,用 硫酸亚铁铵[
硫酸亚铁铵[ ]溶液滴定,已知滴定时发生反应为
]溶液滴定,已知滴定时发生反应为 ,达到滴定终点时消耗硫酸亚铁铵溶液20.50mL,则该产品的纯度为
,达到滴定终点时消耗硫酸亚铁铵溶液20.50mL,则该产品的纯度为___________ (写出计算过程 ,计算结果保留4位有效数字)
 是脱硝问题研究的热点,催化剂的选取是技术的核心。
是脱硝问题研究的热点,催化剂的选取是技术的核心。(1)以
 为催化剂的催化原理:
为催化剂的催化原理: 与
与 形成能提供氢离子的酸性位(如图所示),
形成能提供氢离子的酸性位(如图所示), 吸附在酸性位上生成中间体继续与NO反应。
吸附在酸性位上生成中间体继续与NO反应。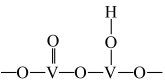
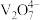 )形式存在,请写出该离子的结构式
)形式存在,请写出该离子的结构式②其他条件相同,
 、NO以一定速率,通过一定量
、NO以一定速率,通过一定量 催化剂催化脱硝,当NO含量一定,
催化剂催化脱硝,当NO含量一定,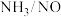 比值大于1.0后NO脱除率变化不大,其原因可能是
比值大于1.0后NO脱除率变化不大,其原因可能是(2)以
 为催化剂的反应机理如图1所示:
为催化剂的反应机理如图1所示:
②NO脱除率随温度变化如图2所示,温度高于1000℃时NO脱除率明显下降,可能原因是:
(3)以
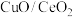 为催化剂
为催化剂①理想
 晶胞如图3所示,实际晶体中会含有部分氧空位。部分
晶胞如图3所示,实际晶体中会含有部分氧空位。部分 填充在由
填充在由 构成的
构成的
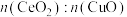 情况下脱硝、脱碳的情况。已知反应机理是CO首先吸附在
情况下脱硝、脱碳的情况。已知反应机理是CO首先吸附在 或CuO表面的活性位点上,由图像可以推断,CO反应的活性位点位于
或CuO表面的活性位点上,由图像可以推断,CO反应的活性位点位于 ”或“CuO”);
”或“CuO”);③测定某催化剂中
 质量分数,取催化剂产品0.8000g,用30mL高氯酸和20mL磷酸混合液加热溶解,冷却至室温后,用
质量分数,取催化剂产品0.8000g,用30mL高氯酸和20mL磷酸混合液加热溶解,冷却至室温后,用 硫酸亚铁铵[
硫酸亚铁铵[ ]溶液滴定,已知滴定时发生反应为
]溶液滴定,已知滴定时发生反应为 ,达到滴定终点时消耗硫酸亚铁铵溶液20.50mL,则该产品的纯度为
,达到滴定终点时消耗硫酸亚铁铵溶液20.50mL,则该产品的纯度为
您最近一年使用:0次
2024-01-21更新
|
396次组卷
|
2卷引用:江苏省海安高级中学2023-2024学年高三上学期12月月考化学试题
名校
解题方法
2 . 轻质碳酸钙可用作橡胶的填料。以磷石膏(含 和少量
和少量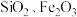 等)为原料制备轻质碳酸钙和铝铵矾的实验流程如图:
等)为原料制备轻质碳酸钙和铝铵矾的实验流程如图:
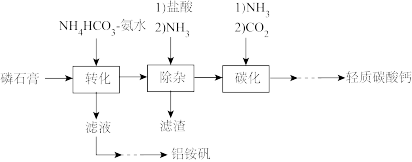
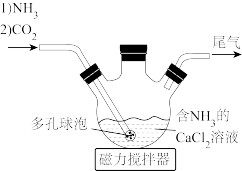
(1)检查图中所示装置气密性的操作为:用止水夹关闭左侧导管,_________ 。
(2)“转化”步骤中 转化为
转化为 的化学方程式
的化学方程式_________ 。
(3)“除杂”时通入NH3的目的是_________ 。
(4)通过下列方法测定产品中碳酸钙的含量:准确称取0.5000g产品用盐酸充分溶解,过滤,将滤液和洗涤液转移至250mL容量瓶中定容、摇匀,记为试液A。取25.00mL试液 ,加入指示剂,调节pH>12,用0.02000mol/LNa2H2Y标准溶液滴定
,加入指示剂,调节pH>12,用0.02000mol/LNa2H2Y标准溶液滴定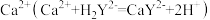 ,至终点时消耗Na2H2Y溶液24.60mL。计算产品中碳酸钙的质量分数
,至终点时消耗Na2H2Y溶液24.60mL。计算产品中碳酸钙的质量分数_________ 。(写出计算过程)。
(5)铝铵矾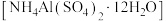 是一种水絮凝剂。请补充由“转化”后的滤液制取铝铵矾的实验方案:
是一种水絮凝剂。请补充由“转化”后的滤液制取铝铵矾的实验方案:
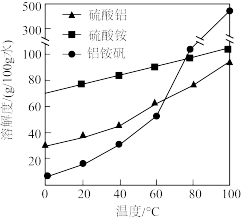
①_________ ,将所得溶液蒸发浓缩至有大量晶体析出,过滤,用无水乙醇洗涤、干燥,得 固体;②
固体;②_________ ,用无水乙醇洗涤,干燥,得到铝铵矾。(部分物质的溶解度随温度的变化如图所示,实验须用的试剂: 的
的 溶液、
溶液、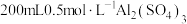 溶液)
溶液)
 和少量
和少量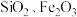 等)为原料制备轻质碳酸钙和铝铵矾的实验流程如图:
等)为原料制备轻质碳酸钙和铝铵矾的实验流程如图:
(1)检查图中所示装置气密性的操作为:用止水夹关闭左侧导管,

(2)“转化”步骤中
 转化为
转化为 的化学方程式
的化学方程式(3)“除杂”时通入NH3的目的是
(4)通过下列方法测定产品中碳酸钙的含量:准确称取0.5000g产品用盐酸充分溶解,过滤,将滤液和洗涤液转移至250mL容量瓶中定容、摇匀,记为试液A。取25.00mL试液
 ,加入指示剂,调节pH>12,用0.02000mol/LNa2H2Y标准溶液滴定
,加入指示剂,调节pH>12,用0.02000mol/LNa2H2Y标准溶液滴定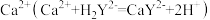 ,至终点时消耗Na2H2Y溶液24.60mL。计算产品中碳酸钙的质量分数
,至终点时消耗Na2H2Y溶液24.60mL。计算产品中碳酸钙的质量分数(5)铝铵矾
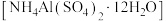 是一种水絮凝剂。请补充由“转化”后的滤液制取铝铵矾的实验方案:
是一种水絮凝剂。请补充由“转化”后的滤液制取铝铵矾的实验方案:①
 固体;②
固体;② 的
的 溶液、
溶液、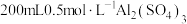 溶液)
溶液)
您最近一年使用:0次
名校
解题方法
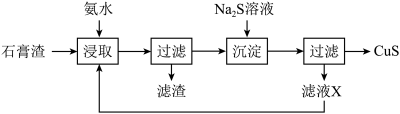
3 .  是一种重要的P型半导体材料。以一种石膏渣[含
是一种重要的P型半导体材料。以一种石膏渣[含 及少量
及少量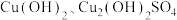 、
、 等]为原料制备
等]为原料制备 的实验流程如下:
的实验流程如下:
已知:常温下,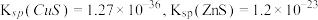 。
。
(1)“浸取”时,生成 与
与 等。
等。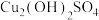 参加反应的离子方程式为
参加反应的离子方程式为_______ 。
(2)“沉淀”时 溶液的用量不宜过多,其原因是
溶液的用量不宜过多,其原因是_______ 。
(3)循环“浸取”多次后,“滤液X”中浓度增大的阳离子主要有_______ 。
(4)为测定“浸取”时 元素浸出率,需先测定石膏渣中
元素浸出率,需先测定石膏渣中 元素含量。称取
元素含量。称取 石膏渣,加入足量稀
石膏渣,加入足量稀 充分溶解,过滤并洗涤滤渣,将滤液转移至
充分溶解,过滤并洗涤滤渣,将滤液转移至 容量瓶中,加水稀释至刻度;准确量取
容量瓶中,加水稀释至刻度;准确量取 稀释后的溶液于锥形瓶中,加入足量KI溶液(
稀释后的溶液于锥形瓶中,加入足量KI溶液( ),用
),用 标准溶液滴定至终点(
标准溶液滴定至终点(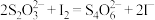 ),平行滴定3次,平均消耗
),平行滴定3次,平均消耗 标准溶液
标准溶液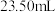 。计算石膏渣中
。计算石膏渣中 元素质量分数(写出计算过程)
元素质量分数(写出计算过程)_______ 。
 是一种重要的P型半导体材料。以一种石膏渣[含
是一种重要的P型半导体材料。以一种石膏渣[含 及少量
及少量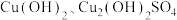 、
、 等]为原料制备
等]为原料制备 的实验流程如下:
的实验流程如下:
已知:常温下,
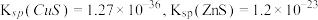 。
。(1)“浸取”时,生成
 与
与 等。
等。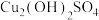 参加反应的离子方程式为
参加反应的离子方程式为(2)“沉淀”时
 溶液的用量不宜过多,其原因是
溶液的用量不宜过多,其原因是(3)循环“浸取”多次后,“滤液X”中浓度增大的阳离子主要有
(4)为测定“浸取”时
 元素浸出率,需先测定石膏渣中
元素浸出率,需先测定石膏渣中 元素含量。称取
元素含量。称取 石膏渣,加入足量稀
石膏渣,加入足量稀 充分溶解,过滤并洗涤滤渣,将滤液转移至
充分溶解,过滤并洗涤滤渣,将滤液转移至 容量瓶中,加水稀释至刻度;准确量取
容量瓶中,加水稀释至刻度;准确量取 稀释后的溶液于锥形瓶中,加入足量KI溶液(
稀释后的溶液于锥形瓶中,加入足量KI溶液( ),用
),用 标准溶液滴定至终点(
标准溶液滴定至终点(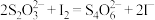 ),平行滴定3次,平均消耗
),平行滴定3次,平均消耗 标准溶液
标准溶液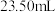 。计算石膏渣中
。计算石膏渣中 元素质量分数(写出计算过程)
元素质量分数(写出计算过程)
您最近一年使用:0次
解题方法
4 . 纳米氧化铜不同于常规氧化铜,由于其晶粒尺寸小,比表面积大,具有优异的物理和化学性质,可用作催化剂脱除废气中的 。
。
(1)纳米CuO催化剂的制备:先向0.3mol/L 先加入过量的氨水,充分搅拌,生成铜氨络合物,再在一定温度下,加入NaOH乙醇溶液生成纳米氧化铜。
先加入过量的氨水,充分搅拌,生成铜氨络合物,再在一定温度下,加入NaOH乙醇溶液生成纳米氧化铜。
已知:i. ;
;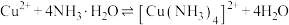

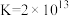
ii.其他条件相同时,溶液中离子浓度大小影响晶粒生成速率与晶粒生长速率,从而决定了晶粒半径大小。
①反应 的平衡常数K1的数值为
的平衡常数K1的数值为___________ 。
②向0.3mol/L 溶液中先加入过量的氨水的目的是
溶液中先加入过量的氨水的目的是___________ 。
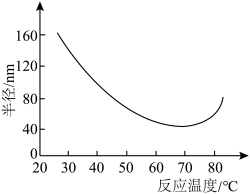
③其他条件不变,产物晶粒半径与反应温度的关系如图所示,30℃生成CuO的晶粒半径较大可能的原因是___________ 。
(2)催化氧化脱除废气中的 :
:
① 主要被废气中的
主要被废气中的 氧化成
氧化成 固体除去,温度低于100℃时,氧化生成的固体中砷元素质量分数会升高,原因是
固体除去,温度低于100℃时,氧化生成的固体中砷元素质量分数会升高,原因是___________ 。
②已知 的结构可表示为
的结构可表示为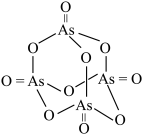 ,则
,则 结构式可表示为
结构式可表示为___________ 。
(3)纳米CuO再生:“再生”时需除去纳米CuO催化剂上的 和少量
和少量 ,可采用在氮气氛围中加热分解的方法。已知:250℃时催化剂上的
,可采用在氮气氛围中加热分解的方法。已知:250℃时催化剂上的 完全升华,350℃时催化剂上的
完全升华,350℃时催化剂上的 完全分解为
完全分解为 和
和 ,将处理过10L废气的纳米CuO催化剂进行加热再生处理,加热到250℃,催化剂质量减轻1.9800g,加热到350℃,催化剂质量又减轻了0.4600g,计算10L废气中
,将处理过10L废气的纳米CuO催化剂进行加热再生处理,加热到250℃,催化剂质量减轻1.9800g,加热到350℃,催化剂质量又减轻了0.4600g,计算10L废气中 的含量是
的含量是___________  。
。
(已知 ,
, ,
,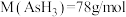 ;写出计算过程)。
;写出计算过程)。
 。
。(1)纳米CuO催化剂的制备:先向0.3mol/L
 先加入过量的氨水,充分搅拌,生成铜氨络合物,再在一定温度下,加入NaOH乙醇溶液生成纳米氧化铜。
先加入过量的氨水,充分搅拌,生成铜氨络合物,再在一定温度下,加入NaOH乙醇溶液生成纳米氧化铜。已知:i.
 ;
;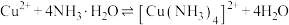

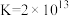
ii.其他条件相同时,溶液中离子浓度大小影响晶粒生成速率与晶粒生长速率,从而决定了晶粒半径大小。
①反应
 的平衡常数K1的数值为
的平衡常数K1的数值为②向0.3mol/L
 溶液中先加入过量的氨水的目的是
溶液中先加入过量的氨水的目的是③其他条件不变,产物晶粒半径与反应温度的关系如图所示,30℃生成CuO的晶粒半径较大可能的原因是

(2)催化氧化脱除废气中的
 :
:①
 主要被废气中的
主要被废气中的 氧化成
氧化成 固体除去,温度低于100℃时,氧化生成的固体中砷元素质量分数会升高,原因是
固体除去,温度低于100℃时,氧化生成的固体中砷元素质量分数会升高,原因是②已知
 的结构可表示为
的结构可表示为 ,则
,则 结构式可表示为
结构式可表示为(3)纳米CuO再生:“再生”时需除去纳米CuO催化剂上的
 和少量
和少量 ,可采用在氮气氛围中加热分解的方法。已知:250℃时催化剂上的
,可采用在氮气氛围中加热分解的方法。已知:250℃时催化剂上的 完全升华,350℃时催化剂上的
完全升华,350℃时催化剂上的 完全分解为
完全分解为 和
和 ,将处理过10L废气的纳米CuO催化剂进行加热再生处理,加热到250℃,催化剂质量减轻1.9800g,加热到350℃,催化剂质量又减轻了0.4600g,计算10L废气中
,将处理过10L废气的纳米CuO催化剂进行加热再生处理,加热到250℃,催化剂质量减轻1.9800g,加热到350℃,催化剂质量又减轻了0.4600g,计算10L废气中 的含量是
的含量是 。
。(已知
 ,
, ,
,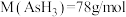 ;写出计算过程)。
;写出计算过程)。
您最近一年使用:0次
名校
解题方法
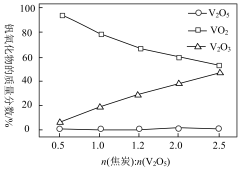
5 . 钒的氧化物(如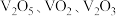 等,均难溶于水)在光储材料等领域有广泛应用。在800℃下,
等,均难溶于水)在光储材料等领域有广泛应用。在800℃下, 和焦炭反应可生成
和焦炭反应可生成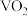 和
和 ,同时得到
,同时得到 气体。反应体系中钒氧化物的质量分数(%)随n(焦炭):
气体。反应体系中钒氧化物的质量分数(%)随n(焦炭):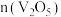 的变化关系如图。下列说法
的变化关系如图。下列说法不 正确的是
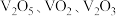 等,均难溶于水)在光储材料等领域有广泛应用。在800℃下,
等,均难溶于水)在光储材料等领域有广泛应用。在800℃下, 和焦炭反应可生成
和焦炭反应可生成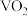 和
和 ,同时得到
,同时得到 气体。反应体系中钒氧化物的质量分数(%)随n(焦炭):
气体。反应体系中钒氧化物的质量分数(%)随n(焦炭):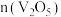 的变化关系如图。下列说法
的变化关系如图。下列说法
A.该条件下 的氧化性强于 的氧化性强于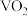 和 和 |
B.铝还原 制钒的反应属于置换反应 制钒的反应属于置换反应 |
C.参加反应的n(焦炭):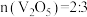 时,反应所得 时,反应所得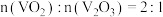 |
D.碳的用量越大,还原产物中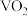 含量越低 含量越低 |
您最近一年使用:0次
2023-07-16更新
|
486次组卷
|
6卷引用:江苏省南通市海安市2022-2023学年高一上学期期末考试化学试题
江苏省南通市海安市2022-2023学年高一上学期期末考试化学试题江苏省徐州市等3地2022-2023学年高一上学期期末考试化学试题(已下线)题型04 氧化还原反应方程式的配平及其计算-学易金卷:备战2023-2024学年高一化学期末真题分类汇编(江苏专用)江苏省苏州市工业园区星海实验高级中学2023-2024学年高一上学期12月调研化学试题江苏省苏州市吴江中学2023-2024学年高一上学期12月月考化学试题(1卷)江苏省苏州市黄埭中学2023-2024学年高一上学期12月月考化学试题
名校
解题方法
6 . 柠檬酸亚铁(FeC6H6O7)是一种易被人体吸收的高效铁制剂,医疗上可以用来治疗缺铁性贫血。某课题组以硫铁矿烧渣(含Fe2O3、SiO2、少量Al2O3等)为原料,先制备碳酸亚铁,再与柠檬酸反应可以制得柠檬酸亚铁。其工艺流程如下:

已知:相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算):
(1)基态Fe2+的核外电子排布式为_______ 。
(2)“浸泡”时加入过量硫酸的目的:_______ 。
(3)“除杂”时有同学提出下列两种途径,请选择较合理的途径并说明理由_______ 。
途径一:
途径二:
(4)“制备FeCO3”时,Na2CO3溶液的浓度对沉淀中铁元素的质量分数以及FeCO3产率的影响如图:
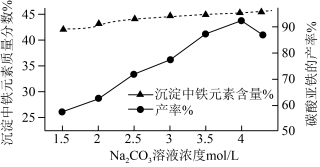
Na2CO3溶液的浓度大于4mol/L时,FeCO3的产率有所下降,而沉淀中铁元素质量分数仍在上升的原因是_______ 。
(5)已知柠檬酸亚铁易被氧化,能溶于水,不溶于乙醇。设计试验方案,从“除杂”后的FeSO4溶液制备柠檬酸亚铁晶体:_______ ,静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体。(必须用到的试剂有:Fe粉、4mol/LNa2CO3溶液、柠檬酸溶液、无水乙醇)
(6)产品纯度的测定。产品中铁的含量用 EDTA 配位滴定法测定:称取0.4000g产品中加入足量H2O2溶液和适量的稀H2SO4,充分反应后再用0.0600mol·L-1EDTA溶液滴定至终点(其他离子对滴定过程无干扰),消耗EDTA溶液的体积为20.00mL(已知:EDTA与Fe3+的滴定比例为1:1,柠檬酸亚铁的摩尔质量为246g/mol)。计算产品的纯度为_______ 。
(7)上述滴定过程中,导致测定结果偏大的是_______ 。
a.滴定前,盛装EDTA的酸式滴定管未润洗
b.滴定时,酸式滴定管中开始有气泡,后来无气泡
c.滴定开始时平视,滴定结束时俯视

已知:相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算):
金属离子 | 沉淀开始pH | 沉淀完全pH |
Al3+ | 3.1 | 5.1 |
Fe2+ | 5.9 | 6.9 |
Fe3+ | 1.2 | 3.2 |
(1)基态Fe2+的核外电子排布式为
(2)“浸泡”时加入过量硫酸的目的:
(3)“除杂”时有同学提出下列两种途径,请选择较合理的途径并说明理由
途径一:

途径二:

(4)“制备FeCO3”时,Na2CO3溶液的浓度对沉淀中铁元素的质量分数以及FeCO3产率的影响如图:

Na2CO3溶液的浓度大于4mol/L时,FeCO3的产率有所下降,而沉淀中铁元素质量分数仍在上升的原因是
(5)已知柠檬酸亚铁易被氧化,能溶于水,不溶于乙醇。设计试验方案,从“除杂”后的FeSO4溶液制备柠檬酸亚铁晶体:
(6)产品纯度的测定。产品中铁的含量用 EDTA 配位滴定法测定:称取0.4000g产品中加入足量H2O2溶液和适量的稀H2SO4,充分反应后再用0.0600mol·L-1EDTA溶液滴定至终点(其他离子对滴定过程无干扰),消耗EDTA溶液的体积为20.00mL(已知:EDTA与Fe3+的滴定比例为1:1,柠檬酸亚铁的摩尔质量为246g/mol)。计算产品的纯度为
(7)上述滴定过程中,导致测定结果偏大的是
a.滴定前,盛装EDTA的酸式滴定管未润洗
b.滴定时,酸式滴定管中开始有气泡,后来无气泡
c.滴定开始时平视,滴定结束时俯视
您最近一年使用:0次
解题方法
7 . 硝酸铈铵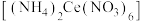 、二氧化铈(
、二氧化铈( )均是常见的强氧化剂,可以以
)均是常见的强氧化剂,可以以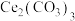 为原料进行制取。
为原料进行制取。

(1)“沉淀1”时,溶液中 转化为
转化为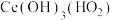 沉淀。写出沉淀1反应的化学方程式:
沉淀。写出沉淀1反应的化学方程式:_______ 。
(2)“酸溶2”时,控制反应温度为80℃,硝酸与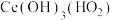 分解产生的
分解产生的 反应生成
反应生成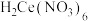 ,反应过程中有少量红棕色气体逸出。“酸溶2”时需控制硝酸的温度为80℃,同时将
,反应过程中有少量红棕色气体逸出。“酸溶2”时需控制硝酸的温度为80℃,同时将 分批加入硝酸中,原因是
分批加入硝酸中,原因是_______ 。
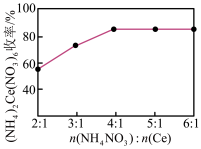
(3)“沉淀2”时,控制其他条件一定,改变加入 固体的量,测得
固体的量,测得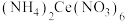 沉淀的收率如图所示。“沉淀2”时,不是采用反应计量数之比,而是控制加入
沉淀的收率如图所示。“沉淀2”时,不是采用反应计量数之比,而是控制加入 的目的是
的目的是_______ 。
(4)实验小组以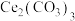 为原料制取
为原料制取 ,请补充完整实验方案:将
,请补充完整实验方案:将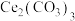 完全溶解于盐酸中,
完全溶解于盐酸中,_______ ,得 固体。[已知:
固体。[已知: (白色沉淀)
(白色沉淀)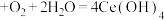 (黄色沉淀),
(黄色沉淀), 受热分解时失重百分比与温度的关系如图所示。可选用的仪器和试剂:
受热分解时失重百分比与温度的关系如图所示。可选用的仪器和试剂: 氨水、
氨水、 、
、 、
、 溶液、马弗炉(可用于固体的高温加热)]
溶液、马弗炉(可用于固体的高温加热)]
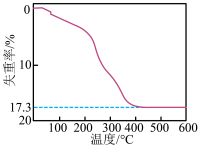
(5)实验制得的硝酸铈铵(摩尔质量为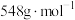 )含量可用如下方法测定:准确称取16.0g硝酸铈铵样品,加水充分溶解,并转移至100mL容量瓶中定容、摇匀,得硝酸铈铵溶液试样。准确量取5mL的硝酸铈铵溶液试样,移入250mL锥形瓶中,加入适量硫酸和磷酸,并加入2滴0.25%邻二氮杂菲指示剂,用
)含量可用如下方法测定:准确称取16.0g硝酸铈铵样品,加水充分溶解,并转移至100mL容量瓶中定容、摇匀,得硝酸铈铵溶液试样。准确量取5mL的硝酸铈铵溶液试样,移入250mL锥形瓶中,加入适量硫酸和磷酸,并加入2滴0.25%邻二氮杂菲指示剂,用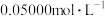 硫酸亚铁铵
硫酸亚铁铵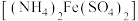 标准溶液滴定至终点(滴定过程中
标准溶液滴定至终点(滴定过程中 被还原为
被还原为 ),消耗标准溶液24.00mL。计算该样品中硝酸铈铵的质量分数
),消耗标准溶液24.00mL。计算该样品中硝酸铈铵的质量分数______ 。
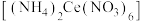 、二氧化铈(
、二氧化铈( )均是常见的强氧化剂,可以以
)均是常见的强氧化剂,可以以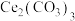 为原料进行制取。
为原料进行制取。
(1)“沉淀1”时,溶液中
 转化为
转化为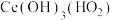 沉淀。写出沉淀1反应的化学方程式:
沉淀。写出沉淀1反应的化学方程式:(2)“酸溶2”时,控制反应温度为80℃,硝酸与
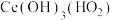 分解产生的
分解产生的 反应生成
反应生成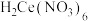 ,反应过程中有少量红棕色气体逸出。“酸溶2”时需控制硝酸的温度为80℃,同时将
,反应过程中有少量红棕色气体逸出。“酸溶2”时需控制硝酸的温度为80℃,同时将 分批加入硝酸中,原因是
分批加入硝酸中,原因是(3)“沉淀2”时,控制其他条件一定,改变加入
 固体的量,测得
固体的量,测得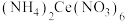 沉淀的收率如图所示。“沉淀2”时,不是采用反应计量数之比,而是控制加入
沉淀的收率如图所示。“沉淀2”时,不是采用反应计量数之比,而是控制加入 的目的是
的目的是
(4)实验小组以
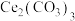 为原料制取
为原料制取 ,请补充完整实验方案:将
,请补充完整实验方案:将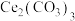 完全溶解于盐酸中,
完全溶解于盐酸中, 固体。[已知:
固体。[已知: (白色沉淀)
(白色沉淀)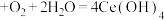 (黄色沉淀),
(黄色沉淀), 受热分解时失重百分比与温度的关系如图所示。可选用的仪器和试剂:
受热分解时失重百分比与温度的关系如图所示。可选用的仪器和试剂: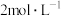 氨水、
氨水、 、
、 、
、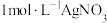 溶液、马弗炉(可用于固体的高温加热)]
溶液、马弗炉(可用于固体的高温加热)]
(5)实验制得的硝酸铈铵(摩尔质量为
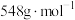 )含量可用如下方法测定:准确称取16.0g硝酸铈铵样品,加水充分溶解,并转移至100mL容量瓶中定容、摇匀,得硝酸铈铵溶液试样。准确量取5mL的硝酸铈铵溶液试样,移入250mL锥形瓶中,加入适量硫酸和磷酸,并加入2滴0.25%邻二氮杂菲指示剂,用
)含量可用如下方法测定:准确称取16.0g硝酸铈铵样品,加水充分溶解,并转移至100mL容量瓶中定容、摇匀,得硝酸铈铵溶液试样。准确量取5mL的硝酸铈铵溶液试样,移入250mL锥形瓶中,加入适量硫酸和磷酸,并加入2滴0.25%邻二氮杂菲指示剂,用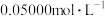 硫酸亚铁铵
硫酸亚铁铵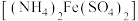 标准溶液滴定至终点(滴定过程中
标准溶液滴定至终点(滴定过程中 被还原为
被还原为 ),消耗标准溶液24.00mL。计算该样品中硝酸铈铵的质量分数
),消耗标准溶液24.00mL。计算该样品中硝酸铈铵的质量分数
您最近一年使用:0次
22-23高三上·江苏南通·开学考试
名校
8 . ClO2是一种高效消毒灭菌剂,可用于灭活新冠病毒。ClO2稳定性差,工业上可将ClO2转化为较稳定的NaClO2保存。一种由NaClO3制取NaClO2晶体的流程如下:

已知高于60℃时,NaClO2易分解为NaClO3和NaCl。
(1)制C1O2.向用硫酸酸化的NaClO3中通入混有空气(起稀释作用)的SO2的气体,可制得C1O2气体。其他条件一定,若通入的SO2过量,所得ClO2的体积将减小,原因是_______ 。
(2)制NaClO2溶液。将一定量的ClO2通入NaOH和H2O2的混合溶液中,充分反应后可制得NaClO2溶液。由该反应可以比较反应物和产物中两种微粒的氧化性大小。碱性条件下,两种微粒的氧化性大小规律为_______>_______。_______
(3)制NaClO2晶体。已知NaClO2的溶解度曲线如图所示。设计由质量分数为10%的NaClO2溶液(含少量NaOH)制取NaClO2·3H2O晶体的实验方案:_______ 。

(4)NaClO2晶体使用时,向其中加入盐酸,即可得到ClO2气体。已知反应产物中只有一种气体和一种盐,则消耗1molNaClO2,可生成ClO2的物质的量为_______ 。
(5)ClO2还可将碱性废水中的CN-化为N2和CO ,自身转化为Cl-。经测定,某冶炼废水中CN-含量为1040mg·L-1,处理该废水10m3,理论上需要通入标准状况下ClO2的体积为多少升?(写出计算过程)
,自身转化为Cl-。经测定,某冶炼废水中CN-含量为1040mg·L-1,处理该废水10m3,理论上需要通入标准状况下ClO2的体积为多少升?(写出计算过程)__________

已知高于60℃时,NaClO2易分解为NaClO3和NaCl。
(1)制C1O2.向用硫酸酸化的NaClO3中通入混有空气(起稀释作用)的SO2的气体,可制得C1O2气体。其他条件一定,若通入的SO2过量,所得ClO2的体积将减小,原因是
(2)制NaClO2溶液。将一定量的ClO2通入NaOH和H2O2的混合溶液中,充分反应后可制得NaClO2溶液。由该反应可以比较反应物和产物中两种微粒的氧化性大小。碱性条件下,两种微粒的氧化性大小规律为_______>_______。
(3)制NaClO2晶体。已知NaClO2的溶解度曲线如图所示。设计由质量分数为10%的NaClO2溶液(含少量NaOH)制取NaClO2·3H2O晶体的实验方案:

(4)NaClO2晶体使用时,向其中加入盐酸,即可得到ClO2气体。已知反应产物中只有一种气体和一种盐,则消耗1molNaClO2,可生成ClO2的物质的量为
(5)ClO2还可将碱性废水中的CN-化为N2和CO
 ,自身转化为Cl-。经测定,某冶炼废水中CN-含量为1040mg·L-1,处理该废水10m3,理论上需要通入标准状况下ClO2的体积为多少升?(写出计算过程)
,自身转化为Cl-。经测定,某冶炼废水中CN-含量为1040mg·L-1,处理该废水10m3,理论上需要通入标准状况下ClO2的体积为多少升?(写出计算过程)
您最近一年使用:0次
9 . Na2CO3、NaHCO3和NaCl都是重要的无机化工原料。
(1)以NaCl和NH4HCO3为原料制备Na2CO3,并测定产品中少量NaHCO3的含量,过程如下:
Ⅰ.Na2CO3的制备

Ⅱ.产品中NaHCO3含量的测定
步骤1 称取产品2.500g;溶解,配成250mL溶液。
步骤2 取25.00mL上述溶液,向其中滴入0.1000mol/L盐酸至22.45mL时,溶液中 恰好完全转化为
恰好完全转化为 。
。
步骤3 向步骤 2中溶液继续滴入0.1000mol/L盐酸,又消耗盐酸23.45mL时,溶液中 恰好完全转化为CO2。
恰好完全转化为CO2。
有关盐的溶解度曲线如图所示。
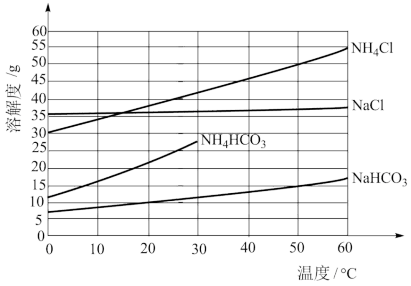
①Ⅰ中“反应”的化学方程式为_______ 。
②题图中碳酸氢铵溶解度在 后无数据的原因可能是
后无数据的原因可能是_______ 。
③“滤液”中除了Na+外,还含有一种阳离子,检验该阳离子的实验方法是_______ 。
④产品中NaHCO3的质量分数为_______ 。
(2)精制氯化钠可由海水晒制的粗盐(含有少量Ca2+、Mg2+、 等杂质离子)获得。请补充完整由粗盐获得精制氯化钠的实验方案:将粗盐加水溶解,
等杂质离子)获得。请补充完整由粗盐获得精制氯化钠的实验方案:将粗盐加水溶解,_______ ,蒸发结晶,得到精制氯化钠(实验中须用 的用品:饱和Na2CO3溶液、NaOH溶液、BaCl2溶液、盐酸、pH试纸)。
(1)以NaCl和NH4HCO3为原料制备Na2CO3,并测定产品中少量NaHCO3的含量,过程如下:
Ⅰ.Na2CO3的制备

Ⅱ.产品中NaHCO3含量的测定
步骤1 称取产品2.500g;溶解,配成250mL溶液。
步骤2 取25.00mL上述溶液,向其中滴入0.1000mol/L盐酸至22.45mL时,溶液中
 恰好完全转化为
恰好完全转化为 。
。步骤3 向步骤 2中溶液继续滴入0.1000mol/L盐酸,又消耗盐酸23.45mL时,溶液中
 恰好完全转化为CO2。
恰好完全转化为CO2。有关盐的溶解度曲线如图所示。

①Ⅰ中“反应”的化学方程式为
②题图中碳酸氢铵溶解度在
 后无数据的原因可能是
后无数据的原因可能是③“滤液”中除了Na+外,还含有一种阳离子,检验该阳离子的实验方法是
④产品中NaHCO3的质量分数为
(2)精制氯化钠可由海水晒制的粗盐(含有少量Ca2+、Mg2+、
 等杂质离子)获得。请补充完整由粗盐获得精制氯化钠的实验方案:将粗盐加水溶解,
等杂质离子)获得。请补充完整由粗盐获得精制氯化钠的实验方案:将粗盐加水溶解,
您最近一年使用:0次
名校
10 . 金(Au)广泛应用于电子信息产业,一种从被FeS2包裹的含金矿物中提金的工艺流程如下:

(1)①“预处理”时,FeS2被氧化为Fe2(SO4)3,写出该反应的离子方程式_______ 。
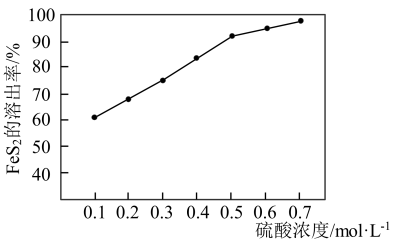
②研究发现H2O2在Fe2+的催化作用下产生具有强氧化能力的中间体∙OH,∙OH将金表面的FeS2氧化溶出。FeS2溶出率与硫酸初始浓度的关系如图所示,随着硫酸初始浓度的增大,FeS2溶出率逐渐提高的主要原因是_______ 。
(2)①“浸取”时Au转化为配合物NH4[Au(SCN)4],该配合物中的配体为_______ 。
②“浸取”时可使用硫脲[SC(NH2)2]代替NH4SCN,硫脲可通过下列反应制备:

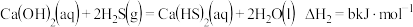

_______ 。
(3)“置换”时需维持无氧环境,其主要原因是_______ 。
(4)测定样品中Au的含量:准确称取0.1000g试样,加入王水,将Au转化成具有强氧化性的氯金酸(HAuCl4),在除去硝酸根后的溶液中,边不断搅拌,边向溶液中加入过量0.4000 mol·L-1FeSO4溶液30.00mL,将HAuCl4完全还原为Au;滴加二苯胺磺酸钠作指示剂,用0.1000 mol·L-1K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液18.00mL。
已知: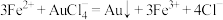

计算样品中金的质量分数(写出计算过程)_______ 。

(1)①“预处理”时,FeS2被氧化为Fe2(SO4)3,写出该反应的离子方程式
②研究发现H2O2在Fe2+的催化作用下产生具有强氧化能力的中间体∙OH,∙OH将金表面的FeS2氧化溶出。FeS2溶出率与硫酸初始浓度的关系如图所示,随着硫酸初始浓度的增大,FeS2溶出率逐渐提高的主要原因是

(2)①“浸取”时Au转化为配合物NH4[Au(SCN)4],该配合物中的配体为
②“浸取”时可使用硫脲[SC(NH2)2]代替NH4SCN,硫脲可通过下列反应制备:

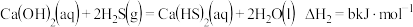

(3)“置换”时需维持无氧环境,其主要原因是
(4)测定样品中Au的含量:准确称取0.1000g试样,加入王水,将Au转化成具有强氧化性的氯金酸(HAuCl4),在除去硝酸根后的溶液中,边不断搅拌,边向溶液中加入过量0.4000 mol·L-1FeSO4溶液30.00mL,将HAuCl4完全还原为Au;滴加二苯胺磺酸钠作指示剂,用0.1000 mol·L-1K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液18.00mL。
已知:
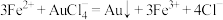

计算样品中金的质量分数(写出计算过程)
您最近一年使用:0次
2022-10-24更新
|
296次组卷
|
2卷引用:江苏省南通市海门中学2022-2023学年高三上学期第一次诊断测试化学试题



