名校
解题方法
1 . 乳酸亚铁晶体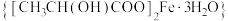 是一种很好的食品铁强化剂,吸收效果比无机铁好,易溶于水,几乎不溶于乙醇,可由
是一种很好的食品铁强化剂,吸收效果比无机铁好,易溶于水,几乎不溶于乙醇,可由 与乳酸(结构简式为:
与乳酸(结构简式为: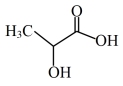 )反应制得。
)反应制得。
Ⅰ.制备

实验步骤如下:
ⅰ.检查气密性,按图示添加药品;
ⅱ.在装置B中制取硫酸亚铁,并将整个装置内的空气排净;
ⅲ.将B中溶液导入C中产生 沉淀;
沉淀;
ⅳ.将C中混合物分离提纯,获得纯净的碳酸亚铁产品。
(1)装置D的作用是_______ 。
(2)装置C中生成 的离子方程式是
的离子方程式是_______ 。
(3)步骤ⅱ和步骤ⅲ中应打开的开关分别是_______ (选填“ 和
和 ”或“
”或“ 和
和 ”)
”)
Ⅱ.制备乳酸亚铁晶体
将制得的 加入到乳酸溶液中,加入少量铁粉,在75℃下搅拌使之充分反应,然后再加入适量乳酸。冷却,加入乙醇,过滤,再洗涤和干燥,得到产品。
加入到乳酸溶液中,加入少量铁粉,在75℃下搅拌使之充分反应,然后再加入适量乳酸。冷却,加入乙醇,过滤,再洗涤和干燥,得到产品。
(4)加入乙醇的目的是_______ 。
Ⅲ.探究乳酸亚铁晶体中铁元素的含量
乙同学称取g样品溶于水,用 的酸性
的酸性 标准溶液滴定,当溶液恰好显浅红色,且30s内浅红色不褪去,停止滴定,测得消耗标准溶液V1mL。
标准溶液滴定,当溶液恰好显浅红色,且30s内浅红色不褪去,停止滴定,测得消耗标准溶液V1mL。
(5)乙同学方案是否正确?_______ (选填“是”或“否”),如填“是”,计算铁元素的质量分数(用含有 、
、 、
、 的代数式表示);如填“否”,说明偏高还是偏低,并写出理由
的代数式表示);如填“否”,说明偏高还是偏低,并写出理由_______ 。
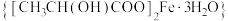 是一种很好的食品铁强化剂,吸收效果比无机铁好,易溶于水,几乎不溶于乙醇,可由
是一种很好的食品铁强化剂,吸收效果比无机铁好,易溶于水,几乎不溶于乙醇,可由 与乳酸(结构简式为:
与乳酸(结构简式为: )反应制得。
)反应制得。Ⅰ.制备


实验步骤如下:
ⅰ.检查气密性,按图示添加药品;
ⅱ.在装置B中制取硫酸亚铁,并将整个装置内的空气排净;
ⅲ.将B中溶液导入C中产生
 沉淀;
沉淀;ⅳ.将C中混合物分离提纯,获得纯净的碳酸亚铁产品。
(1)装置D的作用是
(2)装置C中生成
 的离子方程式是
的离子方程式是(3)步骤ⅱ和步骤ⅲ中应打开的开关分别是
 和
和 ”或“
”或“ 和
和 ”)
”) Ⅱ.制备乳酸亚铁晶体
将制得的
 加入到乳酸溶液中,加入少量铁粉,在75℃下搅拌使之充分反应,然后再加入适量乳酸。冷却,加入乙醇,过滤,再洗涤和干燥,得到产品。
加入到乳酸溶液中,加入少量铁粉,在75℃下搅拌使之充分反应,然后再加入适量乳酸。冷却,加入乙醇,过滤,再洗涤和干燥,得到产品。(4)加入乙醇的目的是
Ⅲ.探究乳酸亚铁晶体中铁元素的含量
乙同学称取g样品溶于水,用
 的酸性
的酸性 标准溶液滴定,当溶液恰好显浅红色,且30s内浅红色不褪去,停止滴定,测得消耗标准溶液V1mL。
标准溶液滴定,当溶液恰好显浅红色,且30s内浅红色不褪去,停止滴定,测得消耗标准溶液V1mL。(5)乙同学方案是否正确?
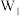 、
、 、
、 的代数式表示);如填“否”,说明偏高还是偏低,并写出理由
的代数式表示);如填“否”,说明偏高还是偏低,并写出理由
您最近一年使用:0次
2022-09-11更新
|
366次组卷
|
5卷引用:实验综合题
名校
解题方法
2 . 某种胃药的有效成分为碳酸氢钠,测定其中碳酸氢钠含量的操作如下(设该药片中的其他成分不与盐酸或氢氧化钠反应):
①配制250 mL 0.50 mol·L-1稀盐酸和90 mL0.50 mol·L-1 NaOH溶液;
②向2片研碎后的药片中加入20.0mL蒸馏水;
③加入25.0 mL 0.50 mol·L-1稀盐酸;
④用0.50 mol·L-1 NaOH溶液中和过量的稀盐酸,消耗NaOH溶液的体积为5.0 mL。
请回答下列问题:
(1)需量取质量分数为36.5%的浓盐酸(密度为1.2 g/cm3)_______ mL。
(2)配制90 mL 0.50 mol·L-1 NaOH溶液,必须用到的玻璃仪器有烧杯、玻璃棒、_______ 、_______ 。
(3)配制NaOH溶液过程中,下列说法不正确的是_______
A.取2.0 g NaOH固体放在滤纸上称量
B.固体NaOH在烧杯中完全溶解后,立即转移到容量瓶中
C.定容时仰视容量瓶的刻度线,使配得的NaOH溶液浓度偏低
D.定容时加水时不慎超过了刻度线,把液体倒出一些,重新加水至刻度线
E.摇匀后发现液面低于刻度线,加水定容至刻度线会使所配溶液浓度偏低
(4)测定过程中发生反应的离子方程式_______ 、_______
(5)该药片中碳酸氢钠的含量为_______ g/片。
①配制250 mL 0.50 mol·L-1稀盐酸和90 mL0.50 mol·L-1 NaOH溶液;
②向2片研碎后的药片中加入20.0mL蒸馏水;
③加入25.0 mL 0.50 mol·L-1稀盐酸;
④用0.50 mol·L-1 NaOH溶液中和过量的稀盐酸,消耗NaOH溶液的体积为5.0 mL。
请回答下列问题:
(1)需量取质量分数为36.5%的浓盐酸(密度为1.2 g/cm3)
(2)配制90 mL 0.50 mol·L-1 NaOH溶液,必须用到的玻璃仪器有烧杯、玻璃棒、
(3)配制NaOH溶液过程中,下列说法不正确的是
A.取2.0 g NaOH固体放在滤纸上称量
B.固体NaOH在烧杯中完全溶解后,立即转移到容量瓶中
C.定容时仰视容量瓶的刻度线,使配得的NaOH溶液浓度偏低
D.定容时加水时不慎超过了刻度线,把液体倒出一些,重新加水至刻度线
E.摇匀后发现液面低于刻度线,加水定容至刻度线会使所配溶液浓度偏低
(4)测定过程中发生反应的离子方程式
(5)该药片中碳酸氢钠的含量为
您最近一年使用:0次
2022-11-16更新
|
137次组卷
|
2卷引用:江苏省常州市十校2022-2023学年高一上学期12月联合调研化学试题
3 . Na2CO3、NaHCO3和NaCl都是重要的无机化工原料。
(1)以NaCl和NH4HCO3为原料制备Na2CO3,并测定产品中少量NaHCO3的含量,过程如下:
Ⅰ.Na2CO3的制备

Ⅱ.产品中NaHCO3含量的测定
步骤1 称取产品2.500g;溶解,配成250mL溶液。
步骤2 取25.00mL上述溶液,向其中滴入0.1000mol/L盐酸至22.45mL时,溶液中 恰好完全转化为
恰好完全转化为 。
。
步骤3 向步骤 2中溶液继续滴入0.1000mol/L盐酸,又消耗盐酸23.45mL时,溶液中 恰好完全转化为CO2。
恰好完全转化为CO2。
有关盐的溶解度曲线如图所示。
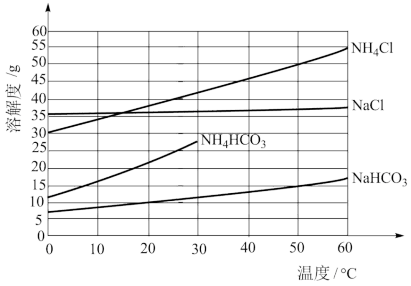
①Ⅰ中“反应”的化学方程式为_______ 。
②题图中碳酸氢铵溶解度在 后无数据的原因可能是
后无数据的原因可能是_______ 。
③“滤液”中除了Na+外,还含有一种阳离子,检验该阳离子的实验方法是_______ 。
④产品中NaHCO3的质量分数为_______ 。
(2)精制氯化钠可由海水晒制的粗盐(含有少量Ca2+、Mg2+、 等杂质离子)获得。请补充完整由粗盐获得精制氯化钠的实验方案:将粗盐加水溶解,
等杂质离子)获得。请补充完整由粗盐获得精制氯化钠的实验方案:将粗盐加水溶解,_______ ,蒸发结晶,得到精制氯化钠(实验中须用 的用品:饱和Na2CO3溶液、NaOH溶液、BaCl2溶液、盐酸、pH试纸)。
(1)以NaCl和NH4HCO3为原料制备Na2CO3,并测定产品中少量NaHCO3的含量,过程如下:
Ⅰ.Na2CO3的制备

Ⅱ.产品中NaHCO3含量的测定
步骤1 称取产品2.500g;溶解,配成250mL溶液。
步骤2 取25.00mL上述溶液,向其中滴入0.1000mol/L盐酸至22.45mL时,溶液中
 恰好完全转化为
恰好完全转化为 。
。步骤3 向步骤 2中溶液继续滴入0.1000mol/L盐酸,又消耗盐酸23.45mL时,溶液中
 恰好完全转化为CO2。
恰好完全转化为CO2。有关盐的溶解度曲线如图所示。

①Ⅰ中“反应”的化学方程式为
②题图中碳酸氢铵溶解度在
 后无数据的原因可能是
后无数据的原因可能是③“滤液”中除了Na+外,还含有一种阳离子,检验该阳离子的实验方法是
④产品中NaHCO3的质量分数为
(2)精制氯化钠可由海水晒制的粗盐(含有少量Ca2+、Mg2+、
 等杂质离子)获得。请补充完整由粗盐获得精制氯化钠的实验方案:将粗盐加水溶解,
等杂质离子)获得。请补充完整由粗盐获得精制氯化钠的实验方案:将粗盐加水溶解,
您最近一年使用:0次
4 . 地球海洋是巨大的物质资源宝库,有待于人们进一步开发、利用和保护。氯化钠在海水中的质量分数为2.72%,是海水中含量最多的盐。从远古时代开始,人们就掌握了从海水中获取食盐的方法。近代以来,随着科学技术和化学工业的发展,人们在工业上以氯化钠为原料进一步制备金属钠、氯气、烧碱、碳酸氢钠和碳酸钠,并以氯气、烧碱等为原料进一步从海洋中提取出溴、碘、镁。这些海洋化工产品为化学工业生产体系输送了大量的基础原料,为人类的可持续发展做出了重要贡献。用下列装置模拟侯氏制碱法的部分工艺。下列对于该实验方案的说法不正确 的是
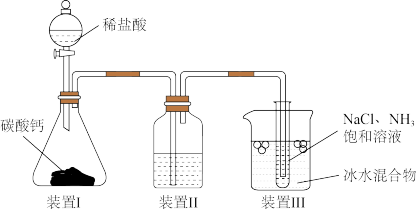

A.装置Ⅰ中使用小颗粒 可加快气体生成 可加快气体生成 |
B.装置Ⅱ中的试剂可使用饱和 溶液 溶液 |
C.装置Ⅲ中使用冰水可促进 析出 析出 |
D.侯氏制碱法可以实现 的循环利用 的循环利用 |
您最近一年使用:0次
解题方法
5 . 地球海洋是巨大的物质资源宝库,有待于人们进一步开发、利用和保护。氯化钠在海水中的质量分数为2.72%,是海水中含量最多的盐。从远古时代开始,人们就掌握了从海水中获取食盐的方法。近代以来,随着科学技术和化学工业的发展,人们在工业上以氯化钠为原料进一步制备金属钠、氯气、烧碱、碳酸氢钠和碳酸钠,并以氯气、烧碱等为原料进一步从海洋中提取出溴、碘、镁。这些海洋化工产品为化学工业生产体系输送了大量的基础原料,为人类的可持续发展做出了重要贡献。实验小组利用食盐、 和水等进行氯系消毒剂的制备。下列反应的离子方程式
和水等进行氯系消毒剂的制备。下列反应的离子方程式不正确 的是
 和水等进行氯系消毒剂的制备。下列反应的离子方程式
和水等进行氯系消毒剂的制备。下列反应的离子方程式A.电解饱和食盐水制氯气和碱: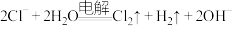 |
B.氯气和水反应制备次氯酸: |
C.氯气和碳酸钠溶液反应制备氯酸钠: |
D.氯酸钠和浓盐酸反应制备二氧化氯: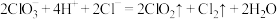 |
您最近一年使用:0次
解题方法
6 . 四氧化三铅(Pb3O4,也可写作2PbO•PbO2)俗名“铅丹”或“红丹”,可用作防锈剂。工业上以废旧铅酸电池的铅膏(主要成分是PbSO4和PbO2)为原料制备Pb3O4的流程如图:
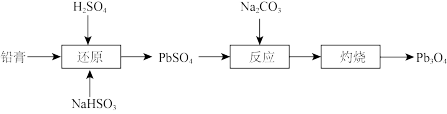
(1)CO 中碳原子杂化方式为
中碳原子杂化方式为____ 。
(2)“还原”时的化学方程式为____ 。
(3)已知:Ksp(PbCO3)=1.5×10-13。若使溶液中Pb2+的浓度小于1×10-5mol·L-1,此时溶液中的c(CO )>
)>____ mol·L-1。
(4)为测定某样品四氧化三铅含量,称取样品0.1200g,加入足量的6mol·L-1HNO3充分溶解,过滤,得到含Pb2+的滤液和PbO2固体。将固体PbO2连同滤纸一并置于另一只锥形瓶中,加入足量的醋酸和醋酸钠混合溶液,再加入过量KI,使PbO2充分氧化I-,以淀粉溶液作指示剂,用0.01000mol·L-1Na2S2O3溶液滴定,终点时用去30.00mL。已知:I2+2Na2S2O3=Na2S4O6+2NaI。
①所加KI必须过量,原因是____ 。
②计算试样中Pb3O4的质量分数____ 。(写出计算过程)

(1)CO
 中碳原子杂化方式为
中碳原子杂化方式为(2)“还原”时的化学方程式为
(3)已知:Ksp(PbCO3)=1.5×10-13。若使溶液中Pb2+的浓度小于1×10-5mol·L-1,此时溶液中的c(CO
 )>
)>(4)为测定某样品四氧化三铅含量,称取样品0.1200g,加入足量的6mol·L-1HNO3充分溶解,过滤,得到含Pb2+的滤液和PbO2固体。将固体PbO2连同滤纸一并置于另一只锥形瓶中,加入足量的醋酸和醋酸钠混合溶液,再加入过量KI,使PbO2充分氧化I-,以淀粉溶液作指示剂,用0.01000mol·L-1Na2S2O3溶液滴定,终点时用去30.00mL。已知:I2+2Na2S2O3=Na2S4O6+2NaI。
①所加KI必须过量,原因是
②计算试样中Pb3O4的质量分数
您最近一年使用:0次
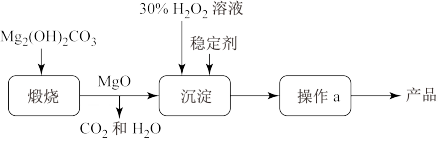
7 . 过氧化镁( )不溶于水,与酸反应生成
)不溶于水,与酸反应生成 ,在医学上可作解酸剂。常温下
,在医学上可作解酸剂。常温下 较稳定,加热时会分解生成
较稳定,加热时会分解生成 和MgO。MgO与
和MgO。MgO与 反应可制得
反应可制得 ,同时放出大量热。一种制备
,同时放出大量热。一种制备 的流程如图所示:请回答下列问题:
的流程如图所示:请回答下列问题:
(1)过氧化镁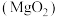 中氧元素的价态为
中氧元素的价态为_______ 。煅烧 的化学反应方程式
的化学反应方程式_______ 。
(2)上述制备过程中加入稳定剂的作用是_______ ;操作a为_______ 。
 产品中常会混有少量MgO,实验室可通过多种方案测定样品中
产品中常会混有少量MgO,实验室可通过多种方案测定样品中 的含量。某研究小组拟用下图装置测定样品(含
的含量。某研究小组拟用下图装置测定样品(含 杂质)中
杂质)中 的含量。
的含量。
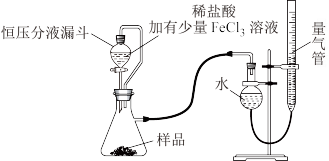
(3)研究小组的实验原理是(用化学方程式表示)
①_______ ;
②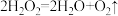 ,稀盐酸中加入
,稀盐酸中加入 溶液的作用是
溶液的作用是_______ 。
(4)实验中使用恒压分液漏斗的优点是:使分液漏斗中的溶液顺利滴下、_______ 。
(5)该小组记录的实验数据如下,样品的质量为mg;反应开始前量气管的读数为amL;反应结束后量气管的读数为bmL,则样品中过氧化镁的质量分数为_______ 。(该实验条件下 密度为
密度为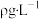 )
)
 )不溶于水,与酸反应生成
)不溶于水,与酸反应生成 ,在医学上可作解酸剂。常温下
,在医学上可作解酸剂。常温下 较稳定,加热时会分解生成
较稳定,加热时会分解生成 和MgO。MgO与
和MgO。MgO与 反应可制得
反应可制得 ,同时放出大量热。一种制备
,同时放出大量热。一种制备 的流程如图所示:请回答下列问题:
的流程如图所示:请回答下列问题:
(1)过氧化镁
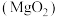 中氧元素的价态为
中氧元素的价态为 的化学反应方程式
的化学反应方程式(2)上述制备过程中加入稳定剂的作用是
 产品中常会混有少量MgO,实验室可通过多种方案测定样品中
产品中常会混有少量MgO,实验室可通过多种方案测定样品中 的含量。某研究小组拟用下图装置测定样品(含
的含量。某研究小组拟用下图装置测定样品(含 杂质)中
杂质)中 的含量。
的含量。
(3)研究小组的实验原理是(用化学方程式表示)
①
②
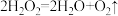 ,稀盐酸中加入
,稀盐酸中加入 溶液的作用是
溶液的作用是(4)实验中使用恒压分液漏斗的优点是:使分液漏斗中的溶液顺利滴下、
(5)该小组记录的实验数据如下,样品的质量为mg;反应开始前量气管的读数为amL;反应结束后量气管的读数为bmL,则样品中过氧化镁的质量分数为
 密度为
密度为 )
)
您最近一年使用:0次
名校
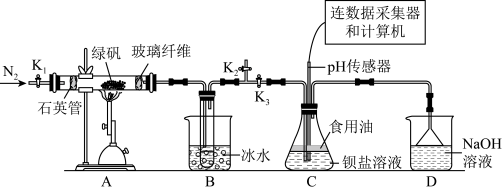
8 . 某实验小组利用如图装置模拟古法硫酸生产方法并进行SO2性质探究。
 -
-
已知A中反应的化学方程式2FeSO4•7H2O Fe2O3+SO2↑+SO3↑+14H2O。
Fe2O3+SO2↑+SO3↑+14H2O。
实验开始前打开活塞K1、K2,关闭活塞K3,通入一段时间N2后,关闭活塞K1、K2,打开活区K3,高温加热绿矾。
完成下列填空:
(1)先通入一段时间N2的目的是____ ;D装置的作用____ 。
(2)B中所得硫酸溶液的质量分数理论值为____ (保留三位小数)。
为探究SO2与钡盐溶液的反点,在装置C中先后四次加入不同的溶液:
得到如图pH-t图:
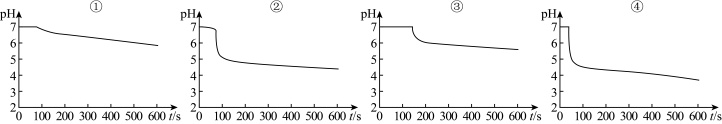
(3)曲线①显缓慢下降趋势,这是因为____ 。曲线②出现骤降,表明溶液中生成了____ (填物质名称)。
(4)对比分析上述四组数据,可得出的结论是____ (任写2条)。
(5)为对接气法收集到的SO2气体进行含量测定,将2240mL(已折算为标准状况)通入足量的Ba(NO3)2溶液中,经过滤、洗涤、烘干,最终得到沉淀20.97g,则SO2气体的体积分数为____ 。若该实验数据较实际值偏大,则可能的原因是____ (选填编号)。
a.气体通入速率过快 b.未用食用油覆盖液面
c.收集的气体中有CO2 d.沉淀未进行恒重操作
 -
-已知A中反应的化学方程式2FeSO4•7H2O
 Fe2O3+SO2↑+SO3↑+14H2O。
Fe2O3+SO2↑+SO3↑+14H2O。实验开始前打开活塞K1、K2,关闭活塞K3,通入一段时间N2后,关闭活塞K1、K2,打开活区K3,高温加热绿矾。
完成下列填空:
(1)先通入一段时间N2的目的是
(2)B中所得硫酸溶液的质量分数理论值为
为探究SO2与钡盐溶液的反点,在装置C中先后四次加入不同的溶液:
| ① | ② | ③ | ④ |
| 已煮沸的BaCl2溶液 | 未煮沸的BaCl2溶液 | 已煮沸的Ba(NO3)2溶液 | 未煮沸的Ba(NO3)2溶液 |
| 注:锥形瓶中溶液体积相同,钡盐溶液浓度相同;油层厚度一致,通入SO2流速一致。 | |||

(3)曲线①显缓慢下降趋势,这是因为
(4)对比分析上述四组数据,可得出的结论是
(5)为对接气法收集到的SO2气体进行含量测定,将2240mL(已折算为标准状况)通入足量的Ba(NO3)2溶液中,经过滤、洗涤、烘干,最终得到沉淀20.97g,则SO2气体的体积分数为
a.气体通入速率过快 b.未用食用油覆盖液面
c.收集的气体中有CO2 d.沉淀未进行恒重操作
您最近一年使用:0次
2022-10-14更新
|
376次组卷
|
2卷引用:江苏省扬州市广陵区名校2022-2023学年高一上学期12月月考化学试题
名校
9 . 金(Au)广泛应用于电子信息产业,一种从被FeS2包裹的含金矿物中提金的工艺流程如下:

(1)①“预处理”时,FeS2被氧化为Fe2(SO4)3,写出该反应的离子方程式_______ 。
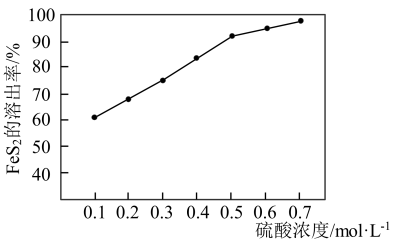
②研究发现H2O2在Fe2+的催化作用下产生具有强氧化能力的中间体∙OH,∙OH将金表面的FeS2氧化溶出。FeS2溶出率与硫酸初始浓度的关系如图所示,随着硫酸初始浓度的增大,FeS2溶出率逐渐提高的主要原因是_______ 。
(2)①“浸取”时Au转化为配合物NH4[Au(SCN)4],该配合物中的配体为_______ 。
②“浸取”时可使用硫脲[SC(NH2)2]代替NH4SCN,硫脲可通过下列反应制备:

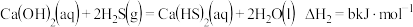

_______ 。
(3)“置换”时需维持无氧环境,其主要原因是_______ 。
(4)测定样品中Au的含量:准确称取0.1000g试样,加入王水,将Au转化成具有强氧化性的氯金酸(HAuCl4),在除去硝酸根后的溶液中,边不断搅拌,边向溶液中加入过量0.4000 mol·L-1FeSO4溶液30.00mL,将HAuCl4完全还原为Au;滴加二苯胺磺酸钠作指示剂,用0.1000 mol·L-1K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液18.00mL。
已知: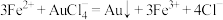

计算样品中金的质量分数(写出计算过程)_______ 。

(1)①“预处理”时,FeS2被氧化为Fe2(SO4)3,写出该反应的离子方程式
②研究发现H2O2在Fe2+的催化作用下产生具有强氧化能力的中间体∙OH,∙OH将金表面的FeS2氧化溶出。FeS2溶出率与硫酸初始浓度的关系如图所示,随着硫酸初始浓度的增大,FeS2溶出率逐渐提高的主要原因是

(2)①“浸取”时Au转化为配合物NH4[Au(SCN)4],该配合物中的配体为
②“浸取”时可使用硫脲[SC(NH2)2]代替NH4SCN,硫脲可通过下列反应制备:

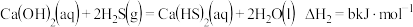

(3)“置换”时需维持无氧环境,其主要原因是
(4)测定样品中Au的含量:准确称取0.1000g试样,加入王水,将Au转化成具有强氧化性的氯金酸(HAuCl4),在除去硝酸根后的溶液中,边不断搅拌,边向溶液中加入过量0.4000 mol·L-1FeSO4溶液30.00mL,将HAuCl4完全还原为Au;滴加二苯胺磺酸钠作指示剂,用0.1000 mol·L-1K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液18.00mL。
已知:
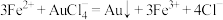

计算样品中金的质量分数(写出计算过程)
您最近一年使用:0次
2022-10-24更新
|
296次组卷
|
2卷引用:江苏省宿迁市泗阳县实验高级中学2022-2023学年高三上学期第一次质量调研化学试题
解题方法
10 . 利用工业废铁屑制取绿矾(流程如图所示)。
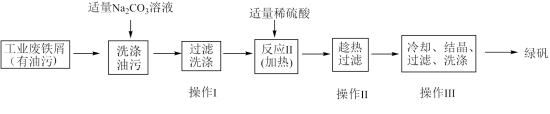
(1)可通过检验 判断操作Ⅰ是否洗涤干净,检验方法是
判断操作Ⅰ是否洗涤干净,检验方法是___________ (写出实验操作、现象及结论)。
(2)测定绿矾产品中 的含量:
的含量:
a.称取3.72g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测液于锥形瓶中;
c.将用硫酸酸化的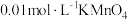 溶液滴入锥形瓶中进行反应,恰好完全反应时消耗
溶液滴入锥形瓶中进行反应,恰好完全反应时消耗 溶液的体积为20mL。
溶液的体积为20mL。
①操作c中发生反应的离子方程式为___________ 。
②样品中 的质量分数为
的质量分数为___________ (结果精确到0.01%)。

(1)可通过检验
 判断操作Ⅰ是否洗涤干净,检验方法是
判断操作Ⅰ是否洗涤干净,检验方法是(2)测定绿矾产品中
 的含量:
的含量:a.称取3.72g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测液于锥形瓶中;
c.将用硫酸酸化的
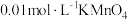 溶液滴入锥形瓶中进行反应,恰好完全反应时消耗
溶液滴入锥形瓶中进行反应,恰好完全反应时消耗 溶液的体积为20mL。
溶液的体积为20mL。①操作c中发生反应的离子方程式为
②样品中
 的质量分数为
的质量分数为
您最近一年使用:0次



