名校
1 . 在精制饱和食盐水中加入碳酸氢铵可制备小苏打(NaHCO3),并提取氯化铵作为肥料或进一步提纯为工业区氯化铵。完成下列填空:
(1)写出上述制备小苏打的化学方程式:__ 。
(2)滤出小苏打后,母液提取氢化铵有两种方法:
①通入氨,冷却、加食盐,过滤
②不通氨,冷却、加食盐,过滤
对以上两种方法的评价正确的是__ (填字母)。
a.①析出的氯化铵纯度更高
b.②析出的氯化铵纯度更高
c.①的滤液可直接循环使用
d.②的滤液可直接循环利用
(3)提取的NH4Cl中含少量Fe2+、SO 。将产品溶解,加入H2O2,如热至沸,再加入BaCl2溶液。过滤,蒸发结晶。得到工业氯化铵。
。将产品溶解,加入H2O2,如热至沸,再加入BaCl2溶液。过滤,蒸发结晶。得到工业氯化铵。
①加热至沸的目的是__ ,滤渣的主要成分是__ 。
(4)称取1.840g小苏打样品(含少量NaCl),配成250mL溶液取出25.00mL用0.1000mol/L盐酸滴定,消耗盐酸21.50mL。选甲基橙而不选酚酞作为指示剂的原因是__ 。样品中NaHCO3的质量分数为___ 。
(5)小苏打样品(含少量NaCl)溶于足量盐酸,蒸干后称量固体质量。也可测定小苏打的含量。若蒸发过程中有少量液体溅出,则测定结果__ (填“偏高”“偏低”或“无影响”)。
(1)写出上述制备小苏打的化学方程式:
(2)滤出小苏打后,母液提取氢化铵有两种方法:
①通入氨,冷却、加食盐,过滤
②不通氨,冷却、加食盐,过滤
对以上两种方法的评价正确的是
a.①析出的氯化铵纯度更高
b.②析出的氯化铵纯度更高
c.①的滤液可直接循环使用
d.②的滤液可直接循环利用
(3)提取的NH4Cl中含少量Fe2+、SO
 。将产品溶解,加入H2O2,如热至沸,再加入BaCl2溶液。过滤,蒸发结晶。得到工业氯化铵。
。将产品溶解,加入H2O2,如热至沸,再加入BaCl2溶液。过滤,蒸发结晶。得到工业氯化铵。①加热至沸的目的是
(4)称取1.840g小苏打样品(含少量NaCl),配成250mL溶液取出25.00mL用0.1000mol/L盐酸滴定,消耗盐酸21.50mL。选甲基橙而不选酚酞作为指示剂的原因是
(5)小苏打样品(含少量NaCl)溶于足量盐酸,蒸干后称量固体质量。也可测定小苏打的含量。若蒸发过程中有少量液体溅出,则测定结果
您最近一年使用:0次
名校
2 . 某校化学兴趣小组为研究氯气的性质并模拟工业制备漂白粉,设计了下列装置进行实验。
已知:①A中反应为 KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O;②石灰乳的主要成分为Ca(OH)2,其他杂质不参与反应。
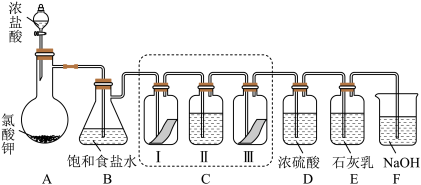
(1)用“双线桥”标出A中反应电子转移的方向和数目_______ 。
(2)B装置作用_______ 。
(3)装置C的目的是验证氯气是否有漂白性,C中I、II、III依次放入的物质正确的是_______ (填编号)。
(4)为测定所得漂白粉的有效成分含量。称取ag漂白粉样品溶解,往所得溶液中通入 CO2至产生沉淀最大值时,该过程的化学方程式为_______ ,若反应生成沉淀的物质的量为bmol,则该漂白粉中有效成份的质量分数为_______ (用含a、b的式子表示)。
已知:①A中反应为 KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O;②石灰乳的主要成分为Ca(OH)2,其他杂质不参与反应。

(1)用“双线桥”标出A中反应电子转移的方向和数目
(2)B装置作用
(3)装置C的目的是验证氯气是否有漂白性,C中I、II、III依次放入的物质正确的是
| 编号 | I | II | III |
| A | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| B | 干燥的有色布条 | 浓硫酸 | 湿润的有色布条 |
| C | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| D | 湿润的有色布条 | 碱石灰 | 干燥的有色布条 |
您最近一年使用:0次
名校
3 . Ⅰ.某同学要测定NaCl固体中Na2SO4的含量(设不含其它杂质)。
①称取w g样品,溶于适量水,②加入稍过量BaCl2溶液,③过滤,洗涤,干燥,④称量,得固体质量是a g
回答下列问题。
(1)确定BaCl2溶液过量的方法是_______
(2)Na2SO4的质量分数是_______
Ⅱ.某溶液中可能含有下列6种离子中的某几种:Cl-、SO 、CO
、CO 、NH
、NH 、Na+。为确认溶液组成进行如下实验:
、Na+。为确认溶液组成进行如下实验:
①取200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4. 30g,向沉淀中加入过量的盐酸,有2. 33g沉淀不溶。
②向①的滤液中加入足量的NaOH溶液,加热,产生能促使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出)。
试问答下列问题:
(1)原溶液中c(NH )=
)=_______ mol/L.
(2)原溶液中还应有_______ 离子存在,其物质的量浓度的范围是_______ 。
①称取w g样品,溶于适量水,②加入稍过量BaCl2溶液,③过滤,洗涤,干燥,④称量,得固体质量是a g
回答下列问题。
(1)确定BaCl2溶液过量的方法是
(2)Na2SO4的质量分数是
Ⅱ.某溶液中可能含有下列6种离子中的某几种:Cl-、SO
 、CO
、CO 、NH
、NH 、Na+。为确认溶液组成进行如下实验:
、Na+。为确认溶液组成进行如下实验:①取200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4. 30g,向沉淀中加入过量的盐酸,有2. 33g沉淀不溶。
②向①的滤液中加入足量的NaOH溶液,加热,产生能促使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出)。
试问答下列问题:
(1)原溶液中c(NH
 )=
)=(2)原溶液中还应有
您最近一年使用:0次
名校
4 . 某感光材料主要成分为KBr和KI,测定其中KBr含量的方法如下:
①称取试样1.000 g,溶解后制备成200.0 mL溶液。
②取50 mL上述溶液,用Br2水将I-氧化成IO ,除去过量Br2,加入过量KI,酸化溶液,加入指示剂,以0.100 0 mol·L-1 Na2S2O3溶液滴定析出的I2,终点时消耗30 mL。(已知:I2 + 2Na2S2O3 = Na2S2O4 + 2NaI )
,除去过量Br2,加入过量KI,酸化溶液,加入指示剂,以0.100 0 mol·L-1 Na2S2O3溶液滴定析出的I2,终点时消耗30 mL。(已知:I2 + 2Na2S2O3 = Na2S2O4 + 2NaI )
③另取50.00 mL试液,酸化后加入足量K2Cr2O7溶液处理,将释放出的I2和Br2蒸馏收集于含有过量KI的溶液中,反应完全后,加入指示剂,以0.100 0 mol·L-1的Na2S2O3溶液滴定其中的I2至终点,消耗15.00 mL 。
(1)写出第②步中用Br2水氧化I-的离子方程式:_______ 。
(2)第②步若未除去过量的Br2,对KBr含量测定结果的影响是_______ (填“偏大”“偏小”或“无影响”)。
(3)计算试样中KBr的质量分数_______ (写出计算过程)。
①称取试样1.000 g,溶解后制备成200.0 mL溶液。
②取50 mL上述溶液,用Br2水将I-氧化成IO
 ,除去过量Br2,加入过量KI,酸化溶液,加入指示剂,以0.100 0 mol·L-1 Na2S2O3溶液滴定析出的I2,终点时消耗30 mL。(已知:I2 + 2Na2S2O3 = Na2S2O4 + 2NaI )
,除去过量Br2,加入过量KI,酸化溶液,加入指示剂,以0.100 0 mol·L-1 Na2S2O3溶液滴定析出的I2,终点时消耗30 mL。(已知:I2 + 2Na2S2O3 = Na2S2O4 + 2NaI )③另取50.00 mL试液,酸化后加入足量K2Cr2O7溶液处理,将释放出的I2和Br2蒸馏收集于含有过量KI的溶液中,反应完全后,加入指示剂,以0.100 0 mol·L-1的Na2S2O3溶液滴定其中的I2至终点,消耗15.00 mL 。
(1)写出第②步中用Br2水氧化I-的离子方程式:
(2)第②步若未除去过量的Br2,对KBr含量测定结果的影响是
(3)计算试样中KBr的质量分数
您最近一年使用:0次
解题方法
5 . Na2S2O3•5H2O俗称“海波”,是重要的化工原料,常用作脱氯剂、定影剂和还原剂。
(1)Na2S2O3还原性较强,在碱性溶液中易被Cl2氧化成SO ,常用作脱氯剂,该反应的离子方程式是
,常用作脱氯剂,该反应的离子方程式是___ 。
(2)测定海波在产品中的质量分数。依据反应2S2O +I2═S4O
+I2═S4O +2I-,可用I2的标准溶液测定产品的纯度。称取5.500g产品,配制成100mL溶液。取10.00mL该溶液,以淀粉洛液为指示剂,用浓度为0.05000mol•L-1I2的标准溶液进行滴定,相关数据记录如表所示。
+2I-,可用I2的标准溶液测定产品的纯度。称取5.500g产品,配制成100mL溶液。取10.00mL该溶液,以淀粉洛液为指示剂,用浓度为0.05000mol•L-1I2的标准溶液进行滴定,相关数据记录如表所示。
①判断滴定终点的现象是___ 。
②计算海波在产品中的质量分数___ (写出计算过程)。
③滴定法测得产品中Na2S2O3•5H2O含量为100.5%,则产品中可能混有的物质是___ 。
(1)Na2S2O3还原性较强,在碱性溶液中易被Cl2氧化成SO
 ,常用作脱氯剂,该反应的离子方程式是
,常用作脱氯剂,该反应的离子方程式是(2)测定海波在产品中的质量分数。依据反应2S2O
 +I2═S4O
+I2═S4O +2I-,可用I2的标准溶液测定产品的纯度。称取5.500g产品,配制成100mL溶液。取10.00mL该溶液,以淀粉洛液为指示剂,用浓度为0.05000mol•L-1I2的标准溶液进行滴定,相关数据记录如表所示。
+2I-,可用I2的标准溶液测定产品的纯度。称取5.500g产品,配制成100mL溶液。取10.00mL该溶液,以淀粉洛液为指示剂,用浓度为0.05000mol•L-1I2的标准溶液进行滴定,相关数据记录如表所示。| 编号 | 1 | 2 | 3 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.99 | 19.08 | 20.01 |
②计算海波在产品中的质量分数
③滴定法测得产品中Na2S2O3•5H2O含量为100.5%,则产品中可能混有的物质是
您最近一年使用:0次
名校
6 . 三草酸合铁酸钾晶体{K3[Fe(C2O4)3]·xH2O)}是一种光敏材料,可用于摄影和蓝色印刷。为测定该晶体中铁的含量,某实验小组做了如下实验:
(1)已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。现称量5.000g三草酸合铁酸钾晶体,配制成250mL溶液。取所配溶液25.00mL于锥形瓶中加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部被氧化成二氧化碳。向反应后的溶液中加入足量锌粉,加热至溶液完全由黄色变为浅绿色时,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性。加入锌粉的目的是_______ 。
(2)向(1)锥形瓶中先加入足量稀硫酸,后用0.010mol·L-1KMnO4溶液滴定上一步骤所得溶液至终点,消耗KMnO4溶液20.02mL,滴定中 被还原成Mn2+。写出发生反应的离子方程式:
被还原成Mn2+。写出发生反应的离子方程式:_______ 。
(3)上述实验滴定时,指示剂应该_______ (填“加”或“不加”),判断滴定终点的现象是_______ 。
(4)再重复(1)、(2)步骤操作两次,滴定消耗0.010mol·L-1KMnO4溶液平均每次为19.98mL。计算确定该晶体中铁的质量分数(写出计算过程)___________ 。
(1)已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。现称量5.000g三草酸合铁酸钾晶体,配制成250mL溶液。取所配溶液25.00mL于锥形瓶中加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部被氧化成二氧化碳。向反应后的溶液中加入足量锌粉,加热至溶液完全由黄色变为浅绿色时,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性。加入锌粉的目的是
(2)向(1)锥形瓶中先加入足量稀硫酸,后用0.010mol·L-1KMnO4溶液滴定上一步骤所得溶液至终点,消耗KMnO4溶液20.02mL,滴定中
 被还原成Mn2+。写出发生反应的离子方程式:
被还原成Mn2+。写出发生反应的离子方程式:(3)上述实验滴定时,指示剂应该
(4)再重复(1)、(2)步骤操作两次,滴定消耗0.010mol·L-1KMnO4溶液平均每次为19.98mL。计算确定该晶体中铁的质量分数(写出计算过程)
您最近一年使用:0次
名校
解题方法
7 . 废弃物的综合利用有利于节约资源、保护环境。实验室利用废旧电池的铜帽(Cu、Zn总含量约为99%)制备ZnSO4·7H2O和CuSO4·5H2O的部分实验步骤如下:

(1)在“溶解I”步骤中,为加快溶解速率,可采取的措施是_____ (任写一种方法)。
(2) 从“滤液I”中提取ZnSO4·7H2O的实验步骤依次为_____ 、_____ 、过滤、冰水洗涤、低温干燥。
(3)在“溶解II”步骤中,发生反应的化学方程式为_____________ 。
(4)为测定产品中CuSO4·5H2O的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000mol·L-1Na2S2O3溶液至刚好完全反应,消耗Na2S2O3溶液25.00mL。已知:2Cu2++4I-=2CuI(白色)↓+I2, 2S2O +I2=2I-+S4O
+I2=2I-+S4O 请依据实验数据计算样品中CuSO4·5H2O的质量分数(写出计算过程,结果保留4位有效数字)
请依据实验数据计算样品中CuSO4·5H2O的质量分数(写出计算过程,结果保留4位有效数字)_______ 。

(1)在“溶解I”步骤中,为加快溶解速率,可采取的措施是
(2) 从“滤液I”中提取ZnSO4·7H2O的实验步骤依次为
(3)在“溶解II”步骤中,发生反应的化学方程式为
(4)为测定产品中CuSO4·5H2O的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000mol·L-1Na2S2O3溶液至刚好完全反应,消耗Na2S2O3溶液25.00mL。已知:2Cu2++4I-=2CuI(白色)↓+I2, 2S2O
 +I2=2I-+S4O
+I2=2I-+S4O 请依据实验数据计算样品中CuSO4·5H2O的质量分数(写出计算过程,结果保留4位有效数字)
请依据实验数据计算样品中CuSO4·5H2O的质量分数(写出计算过程,结果保留4位有效数字)
您最近一年使用:0次
2020-11-11更新
|
157次组卷
|
2卷引用:江苏省扬州中学2020-2021学年高一上学期期中考试化学试题
解题方法
8 . 某校化学兴趣小组为研究氯气的性质并模拟工业制备漂白粉,设计了下列装置进行实验。
已知:①A中反应为KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O;
②石灰乳的主要成分为Ca(OH)2,其他杂质不参与反应。
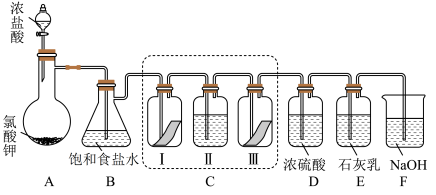
(1)用“双线桥”标出A中反应电子转移的方向和数目________ 。
(2)B装置作用________ 。
(3)装置C的目的是验证氯气是否有漂白性,C中I、Ⅱ、Ⅲ依次放入的物质正确的是___ (填编号)。
(4)待E中物质完全反应后,经过一系列加工处理,得到漂白粉样品,其主要成分为________ (填化学式)
(5)F装置的作用是(用离子方程式表示)________ 。
(6)为测定(4)中所得漂白粉的有效成分含量。称取ag漂白粉样品溶解,往所得溶液中通入CO2至产生沉淀最大值时,该过程的化学方程式为________ ,若反应生成沉淀的物质的量为bmol,则该漂白粉中有效成分的质量分数为_____ (用含a、b的式子表示)。
已知:①A中反应为KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O;
②石灰乳的主要成分为Ca(OH)2,其他杂质不参与反应。

(1)用“双线桥”标出A中反应电子转移的方向和数目
(2)B装置作用
(3)装置C的目的是验证氯气是否有漂白性,C中I、Ⅱ、Ⅲ依次放入的物质正确的是
| 编号 | I | Ⅱ | Ⅲ |
| A | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| B | 干燥的有色布条 | 浓硫酸 | 湿润的有色布条 |
| C | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| D | 湿润的有色布条 | 碱石灰 | 干燥的有色布条 |
(5)F装置的作用是(用离子方程式表示)
(6)为测定(4)中所得漂白粉的有效成分含量。称取ag漂白粉样品溶解,往所得溶液中通入CO2至产生沉淀最大值时,该过程的化学方程式为
您最近一年使用:0次
名校
9 . 聚合硫酸铁[Fex(OH)y(SO4)z]m简称PFS,是一种高效絮凝剂,广泛用于水的净化,其中铁元素为+3价。
(1)聚合硫酸铁PFS化学式中x、y、z之间的等量关系式是___________ 。
(2)用聚合硫酸铁PFS进行模拟净化高岭土废水(用高岭土与自来水配制而成,其中质量浓度为100 mg·L-1)。该高岭土废水净化效果(即浊度去除率)受絮凝剂的投加量及pH的影响如下左右图所示:
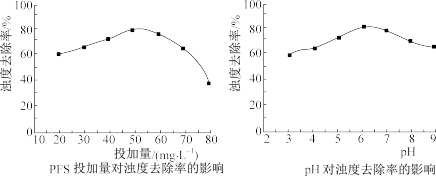
可知聚合硫酸铁PFS最佳投加量是___________ ,最佳pH是___________ 。
(3)已知:①聚合硫酸铁一等品质总铁含量性能指标要求:铁的质量分数大于11.0%。
②MnO +5Fe2++8H+=Mn2++5Fe3++4H2O
+5Fe2++8H+=Mn2++5Fe3++4H2O
为测定某聚合硫酸铁样品中铁的含量是否达到一级品质指标要求,进行如下实验:
a.准确称取1.500 g该聚合硫酸铁样品溶于适量硫酸,配成100.00 mL溶液A。
b.准确量取20.00 mL溶液A,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗涤的滤出液合并配成溶液B。
c 用0.0100 mol·L-1的酸性KMnO4溶液滴加到溶液B中至恰好反应完全,消耗酸性KMnO4溶液13.20 mL。
请通过计算确定该聚合硫酸铁样品中铁的含量是否符合指标要求_________ (写出计算过程)。
(1)聚合硫酸铁PFS化学式中x、y、z之间的等量关系式是
(2)用聚合硫酸铁PFS进行模拟净化高岭土废水(用高岭土与自来水配制而成,其中质量浓度为100 mg·L-1)。该高岭土废水净化效果(即浊度去除率)受絮凝剂的投加量及pH的影响如下左右图所示:

可知聚合硫酸铁PFS最佳投加量是
(3)已知:①聚合硫酸铁一等品质总铁含量性能指标要求:铁的质量分数大于11.0%。
②MnO
 +5Fe2++8H+=Mn2++5Fe3++4H2O
+5Fe2++8H+=Mn2++5Fe3++4H2O为测定某聚合硫酸铁样品中铁的含量是否达到一级品质指标要求,进行如下实验:
a.准确称取1.500 g该聚合硫酸铁样品溶于适量硫酸,配成100.00 mL溶液A。
b.准确量取20.00 mL溶液A,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗涤的滤出液合并配成溶液B。
c 用0.0100 mol·L-1的酸性KMnO4溶液滴加到溶液B中至恰好反应完全,消耗酸性KMnO4溶液13.20 mL。
请通过计算确定该聚合硫酸铁样品中铁的含量是否符合指标要求
您最近一年使用:0次
10 . 钛白粉(TiO2)在涂料、油墨等工业中有重要用途。实验室利用金红石(主要成分为TiO2,含少量SiO2杂质)制备钛白粉并测定其质量分数的过程如下:
已知:①TiO2是白色粉末,不溶于水和稀酸,溶于氢氟酸和热的浓硫酸;Ti3+在空气中容易被氧化。
②有关物质的性质如下表。
Ⅰ. 制备TiCl4:
利用反应TiO2 (s)+CCl4(g) TiCl4(g)+CO2(g),在下图装置中制备TiCl4。
TiCl4(g)+CO2(g),在下图装置中制备TiCl4。
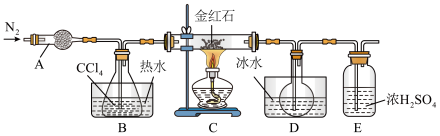
(1)实验过程中的操作包括:①组装仪器,②____ ;③加装药品;④通N2一段时间;⑤最后点燃酒精灯……。实验结束后欲分离D中烧瓶内的液态混合物,所采用操作的名称是____________ 。
(2)装置E的主要作用是__________ 。
(3)若用反应TiO2(s)+2C(s)+2Cl2(g) TiCl4(g)+2CO(g) 制取TiCl4,可将上述实验作如下改变:①将通N2改为通Cl2;②撤去装置B;③石英管内改为盛TiO2和C;④
TiCl4(g)+2CO(g) 制取TiCl4,可将上述实验作如下改变:①将通N2改为通Cl2;②撤去装置B;③石英管内改为盛TiO2和C;④____ ;⑤增加CO的吸收装置。
Ⅱ. 制备钛白粉:
在TiCl4中加水、加热,水解得到沉淀TiO2·xH2O,经过滤、水洗、烘干、焙烧除去水分得到钛白粉。
(4)写出水解生成TiO2·xH2O的化学方程式_______ 。
Ⅲ. 测定钛白粉中TiO2的质量分数:
(5)某研究小组欲测定制得的钛白粉中TiO2的质量分数,实验步骤如下:
步骤一:将a g钛白粉试样溶于足量热的硫酸;在隔绝空气的条件下加入过量的铝粉将Ti4+还原为Ti3+后过滤;
步骤二:配制0.100 mol·L-1 1000 mL硫酸铁铵标准溶液。称取48.2 g硫酸铁铵[NH4Fe (SO4)2·12H2O]于适量的稀硫酸中加热溶解, ,塞好瓶塞,反复颠倒摇匀。
步骤三:加入几滴KSCN溶液作指示剂,用配制的NH4Fe(SO4)2标准溶液滴定(将Ti3+氧化为Ti4+),至终点时消耗NH4Fe(SO4)2溶液的体积V mL。
①补齐步骤二中实验步骤____ 。
②钛白粉试样中所含(TiO2)的质量分数表达式为____ 。
③下列关于测定过程的分析,说法正确的是____ (填字母)。
a.若钛白粉中含有少量铁元素,将导致测定结果偏高
b.若步骤三滴定过程中速度过慢,将导致结果偏低
c.若步骤三中所用的酸式滴定管未用NH4Fe(SO4)2标准溶液润洗,则测得样品中Ti元素含量偏高
已知:①TiO2是白色粉末,不溶于水和稀酸,溶于氢氟酸和热的浓硫酸;Ti3+在空气中容易被氧化。
②有关物质的性质如下表。
物质 | 熔点/℃ | 沸点/℃ | 其它 |
CCl4 | -23 | 76 | 与TiCl4互溶 |
TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
SiCl4 | -70 | 57.6 | 遇潮湿空气产生白雾 |
利用反应TiO2 (s)+CCl4(g)
 TiCl4(g)+CO2(g),在下图装置中制备TiCl4。
TiCl4(g)+CO2(g),在下图装置中制备TiCl4。
(1)实验过程中的操作包括:①组装仪器,②
(2)装置E的主要作用是
(3)若用反应TiO2(s)+2C(s)+2Cl2(g)
 TiCl4(g)+2CO(g) 制取TiCl4,可将上述实验作如下改变:①将通N2改为通Cl2;②撤去装置B;③石英管内改为盛TiO2和C;④
TiCl4(g)+2CO(g) 制取TiCl4,可将上述实验作如下改变:①将通N2改为通Cl2;②撤去装置B;③石英管内改为盛TiO2和C;④Ⅱ. 制备钛白粉:
在TiCl4中加水、加热,水解得到沉淀TiO2·xH2O,经过滤、水洗、烘干、焙烧除去水分得到钛白粉。
(4)写出水解生成TiO2·xH2O的化学方程式
Ⅲ. 测定钛白粉中TiO2的质量分数:
(5)某研究小组欲测定制得的钛白粉中TiO2的质量分数,实验步骤如下:
步骤一:将a g钛白粉试样溶于足量热的硫酸;在隔绝空气的条件下加入过量的铝粉将Ti4+还原为Ti3+后过滤;
步骤二:配制0.100 mol·L-1 1000 mL硫酸铁铵标准溶液。称取48.2 g硫酸铁铵[NH4Fe (SO4)2·12H2O]于适量的稀硫酸中加热溶解, ,塞好瓶塞,反复颠倒摇匀。
步骤三:加入几滴KSCN溶液作指示剂,用配制的NH4Fe(SO4)2标准溶液滴定(将Ti3+氧化为Ti4+),至终点时消耗NH4Fe(SO4)2溶液的体积V mL。
①补齐步骤二中实验步骤
②钛白粉试样中所含(TiO2)的质量分数表达式为
③下列关于测定过程的分析,说法正确的是
a.若钛白粉中含有少量铁元素,将导致测定结果偏高
b.若步骤三滴定过程中速度过慢,将导致结果偏低
c.若步骤三中所用的酸式滴定管未用NH4Fe(SO4)2标准溶液润洗,则测得样品中Ti元素含量偏高
您最近一年使用:0次



